响应面法优化海蓬子皂苷提取工艺条件与生物活性研究
2014-01-17陈美珍
梁 彬,李 娟,余 杰*,陈美珍
(汕头大学理学院生物 学系,广东 汕头 515063)
响应面法优化海蓬子皂苷提取工艺条件与生物活性研究
梁 彬,李 娟,余 杰*,陈美珍
(汕头大学理学院生物 学系,广东 汕头 515063)
响应面分析法优化海蓬子皂苷提取工艺,初步鉴定海蓬子皂苷的 结构,并探讨其对α-葡萄糖苷酶与胰脂肪酶的体外抑制活性。海蓬子皂苷最佳提取条件为料液比1∶27(g/mL)、乙醇体积分数62%、超声时间30 min。在此条件下,海蓬子皂苷的提取量为10.14 mg/g;显色反应和红外光谱初步分析表明,海蓬子皂苷为四环三萜类皂苷;体外实验表明,经纯化的海蓬子皂苷提取物对α-葡 萄糖苷酶和胰脂肪酶均有较强抑制作用,并呈剂量效应,对α-葡萄糖苷酶、胰脂肪酶的抑制率分别达到68.20%和84.28%。该结果提示海蓬子皂苷可能具有阿卡波糖样的降血糖机制以及降血脂的功效。
海蓬子;皂苷;响应面分析法;α-糖苷酶;胰脂肪酶
皂苷是一类以三萜或甾体为苷元,具有较高分子质量的糖苷类化合物,它广分布于植物中,是一类具有多种生理功能、高药理活性的天然化合物[1]。研究证实,皂苷具有降血脂、抗氧化、抗动脉粥样硬化、免疫调节、抗菌抗病毒等作用[2-4],可应用于医药和功能食品等。因此,对皂苷的研究已成为国内外的热门领域。
海蓬子为藜科盐角草属的无叶茎肉质化真盐生植物,亦称为海芦笋,原产美洲盐沼地[5],在中国东南沿海地区也已引种成功并规模化栽培[6]。素有“海人参”和“植物海鲜”之美誉,是一种利用海水灌溉种植的保健、无公害的绿色时令蔬菜[7],其色泽如翡翠、口感脆嫩,具有独特鲜美的海鲜风味,成为消费者的新宠。海蓬子富含膳食纤维、维生素等营养成分和黄酮类、甾醇、皂苷等生理活性物质[8],药用和保健价值高,具有抗癌、降血糖、减肥和防治便秘等功效[9-11]。日、美等一些国家将海蓬子作为高档保健蔬菜食用,相继开发了降血脂减肥茶和生物盐等产品。
海蓬子嫩尖组织中含微量皂苷,能显著降低血管壁上的胆固醇。有研究发现,海蓬子的50%乙醇提取物能使营养性肥胖ICR小鼠减肥,并具有降血脂和降血糖作用[12-13]。但目前国内外对海蓬子生理活性的研究才刚刚起步,有关其皂苷活性成分研究鲜见报道。为此,本研究采用响应面分析法对海蓬子皂苷的提取工艺条件进行优化,对其皂苷结构作了初步鉴定,并通过在体外建立酶反应体系,考察该成分对α-葡萄糖苷酶和胰脂肪酶的抑制效果,以评价海蓬子皂苷的降血糖和调血脂活性,从而探讨海蓬子开发成高血糖人群或肥胖症人群日常保健食品的可行性。
1 材料与方法
1.1 材料与试剂
海蓬子嫩茎由汕头市南澳试验站提供,洗净后于60 ℃烘干,粉碎过40目筛。再用石油醚浸泡除色素,得海蓬子固体粉末,密封保存,备用。
齐墩果酸标准品 中国食品药品检定研究院;对硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,PNPG) 德国西德伊默克公司;猪胰脂肪酶、α-葡萄糖苷酶 美国Sigma公司;阿卡波糖 拜耳医药保健有限公司;NaH2PO4•2H2O、Na2HPO4•12H2O、乙醇等试剂均为国产分析纯。
1.2 仪器与设备
NJL07-5超声波细胞粉碎机 南京杰全微波设备有限公司;Universal 320R台式冷冻离心机 德国Hettich公司;低温冷冻干燥机 上海比朗仪器有限公司;HH-2型恒温水浴锅 国华电器有限公司;DBS-100电脑全自动部分收集器 上海沪西分析仪器厂;2100型UV-2100分光光度计 龙尼柯(上海)仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;真空干燥箱 上海一恒科学仪器有限公司;高速万能粉碎机 天津市泰斯特仪器有限公司。
1.3 方法
1.3.1 海蓬子皂苷的提取工艺
海蓬子干粉→60%乙醇水溶液超声提取→提取液离心→减压浓缩→乙醚萃取分离脱脂→上清液浓缩至干→甲醇溶解定容至25 mL→稀释后显色测定含量
1.3.2 皂苷含量的测定
采用香草醛比色法。以齐墩果酸为标准物,试剂的配制和标准曲线绘制等参照文献[14]进行。经测定得到标准曲线方程为y=0.005 5x-0.095 2,相关系数R2=0.999 9。
1.3.3 海蓬子皂苷提取单因素试验
分别以不同的乙醇体积分数、料液比、提取时间为单因素进行试验,考察各因素对海蓬子皂苷提取量的影响。
1.3.4 响应面优化试验
在单因素试验基础上,选取料液比、提取温度、提取时间作为Box-Behnken设计的自变量,海蓬子提取量为响应值进行响应面优化组合,因素水平设计见表1。

表1 Box-Behnken试验因素水平编码表Table1 Coded levels for independent variables used in Box-Behnken design
1.3.5 海蓬子皂苷的纯化
在以乙醇为溶剂提取皂苷过程中,海蓬子中一些极性与之相近的物质也随之被提取出来,导致皂苷提取物纯度低、色泽差[15]。因此,采用大孔吸附树脂对皂苷粗提物进行纯化,纯化后的皂苷提取物作为生物活性试验的试样。
大孔树脂洗脱的洗脱条件为依次用蒸馏水、0.2%碱液和水洗至中性,然后再用30%乙醇及60%乙醇进行洗脱,收集60%乙醇洗脱液,浓缩后冷冻干燥得到样品。
经大孔吸附树脂纯化后,海蓬子皂苷提取物纯度由7.403%提高至52.8%,得率为44.7%。
1.3.6 皂苷结构的初步鉴定
将通过大孔吸附树脂处理后的皂苷提取物,用乙酸乙酯-甲醇溶剂梯度洗脱纯化后进行结构鉴定。
1.3.6.1 皂苷显色反应
氯仿-浓硫酸反应:样品溶于氯仿中,加入浓硫酸后,氯仿层呈红色或蓝色,硫酸层则呈绿色荧光。
Liebermann-Burchard反应:将试样溶于氯仿中,加入浓硫酸-乙酐(1∶20,V/V)数滴,观察颜色变化。甾体皂苷呈蓝绿色,三萜皂苷呈红或紫色,可利用此反应区分甾体皂苷与三萜皂苷[16]。
1.3.6.2 红外光谱分析
取少许海蓬子皂苷纯化样品,用KBr压片,同时做空白对照,用红外光谱仪在4 000~500 cm-1波数范围扫描并记录图谱。
1.3.7 海蓬子皂苷体外抑制α-糖苷酶活性实验
1.3.7.1 α-葡萄糖苷酶活力测定
参照王斯慧等的方法[17]进行。将α-葡萄糖苷酶(0.5U/mL,0.6 mL)在37 ℃水浴中孵育10 min,加入底物PNPG(20 mmol/L,1 mL)以启动反应。体系于37 ℃反应20 min后,加入1 mL 0.5 mol/L Na2CO3溶液终止反应,然后于405 nm波长处测定在酶的作用下从PNPG中释放出的对硝基酚的量。酶活力单位定义为:在37 ℃、pH 6.8条件下,1 min内水解PNPG释放1 μmol对硝基酚所需的酶量。
1.3.7.2 皂苷提取物抑制α-葡萄糖苷酶活性的测定
参照上述方法,在反应体系中加入不同浓度的 抑制剂溶液1 mL,阳性对照为阿卡波糖,空白对照为不加抑制剂(以蒸馏水补足),其他与抑制剂管操作相同背景,对照为对应浓度的抑制剂溶液,不加酶液(以蒸馏水补足)。其他与抑制剂管操作相同,其反应体系如表2所示,反应终止后用蒸馏水稀释定容至10 mL,于405 nm波长处测其吸光度,并计算抑制率。酶抑制实验重复3次,每次3个复管。
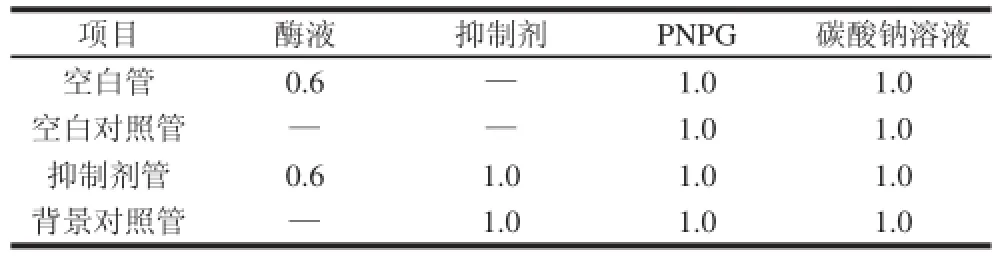
表 22 α-葡萄糖苷酶的抑制体系Table2 Inhibitory system ofα -glucosiiddaasseemL

式中:I2为抑制率/%;A1、A2、A3、A4分别为波长405 nm处,空白管、空白对照管、抑制剂管和背景对照管的吸光度。
1.3.8 海蓬子皂苷体外抑制胰脂肪酶活性实验
1.3.8.1 胰脂肪酶活性测定
按照霍世欣等[18]方法进行测定。其中,脂肪酶活力单位定义为在pH 7.5、温度40 ℃条件下,每分钟催化脂肪水解生成1 μmol脂肪酸的酶量,定义为一个酶活力单位。
1.3.8.2 对胰脂肪酶抑制作用的测定
按上述脂肪酶酶活测定方法操作,并加入定量脂肪酶抑制剂(皂苷提取物)后,测定其剩余酶活,重复实验3次,按以下公式即可计算出胰脂肪酶抑制率。
抑制剂对α-葡萄糖苷酶的抑制率计算:
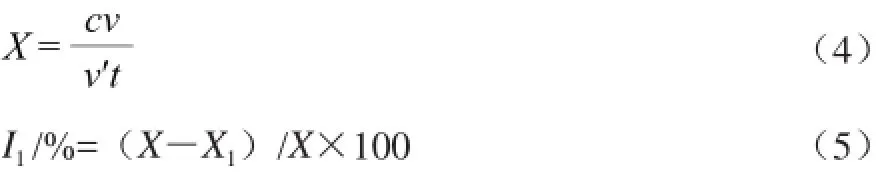
式中:X为胰脂肪酶活力/(U/mL);c为脂肪酸浓度/(μmol/mL);v为脂肪酸溶液体积/mL;v’为酶液用量/mL;t为作用时间/min;I1为抑制率/%;X1为抑制后的胰脂肪酶活力/(U/mL)。
2 结果与分析
2.1 海蓬子皂苷提取的单因素试验
2.1.1 乙醇体积分数对皂苷提取量的影响
准确称取海蓬子干粉5 g,在超声时间30 min、料液比1∶20条件下,加入不同体积分数的乙醇溶液提取皂苷,结果见图1。当乙醇体积分数60%时,皂苷提取量达到最大值,继续增大乙醇的体积分数,皂苷提取量反而下降。

图1 乙醇体积分数对皂苷提取量的影响Fig.1 Effect of ethanol concentration on extraction efficiency of saponin
2.1.2 超声时间对皂苷提取量的影响
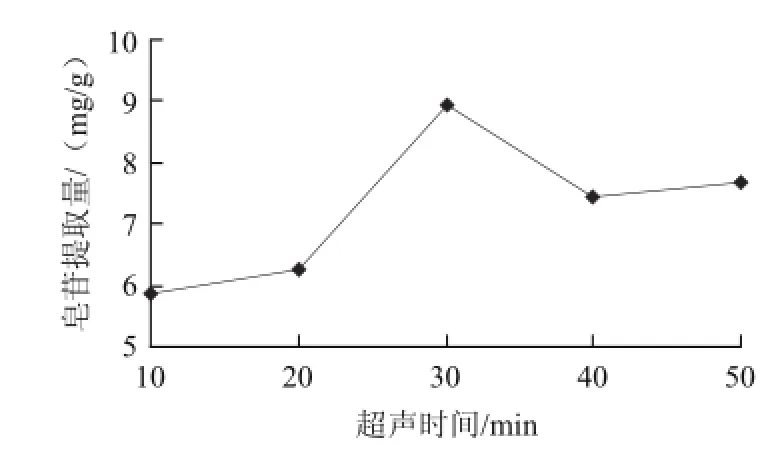
图2 超声时间对皂苷提取量的影响Fig.2 Effect of ultrasonification time on extraction efficiency of saponin
在料液比1∶20、乙醇体积分数60%条件下,考察不同提取时间对皂苷提取量的影响,结果如图2所示。可知皂苷提取量随提取时间的延长而提高,提取30 min后达到最大值,而继续延长提取时间,皂苷提取量反而下降,这可能因提取时间长,部分皂苷被氧化所致。而在超声时间超过40 min后,皂苷提取量又有略微上升,这有可能由于提取时间过长使某些杂质(如色素等)溶出增多,在测定皂苷含量时造成干扰所致。考虑到超声时间过长有可能破坏其中皂苷的结构并使杂质过多 溶出,因此,提取时间不宜过长。
2.1.3 料液比对皂苷提取量的影响
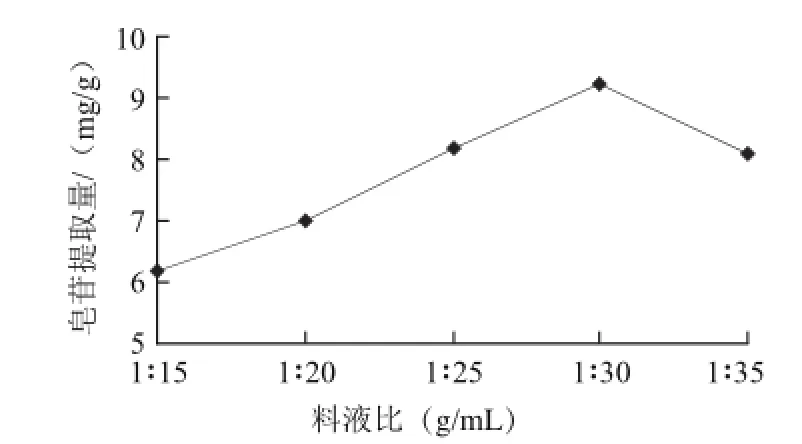
图3 料液比对皂苷提取量的影响Fig.3 Effect of material-to-liquid ratio on extraction efficiency of saponin
在乙醇体积分数60%,超声时间30 min的条件下,考察不同料液比对皂苷提取量的影响,结果见图3。可看出皂苷提取量随提取液使用量的增加而增大,当料液比达1∶30时,提取量达到峰值;料液比1∶35时,皂苷提取量下降,与料液比1∶25时相近。由于溶剂用量过大,会造成后续处理困难和成本提高,杂质的溶出也会增多,因此,综合考虑经济因素和后续工艺的简化,液料比不大于30∶1为宜。
2.2 海蓬子皂苷最优提取工艺条件的确定
应用Box-Behnken试验设计,以料液比、乙醇体积分数、超声时间作为响应面设计的因素,皂苷提取量为响应值,采用三因素三水平的响应面分析方法优化海蓬子皂苷的提取工艺条件,结果见表3~5。
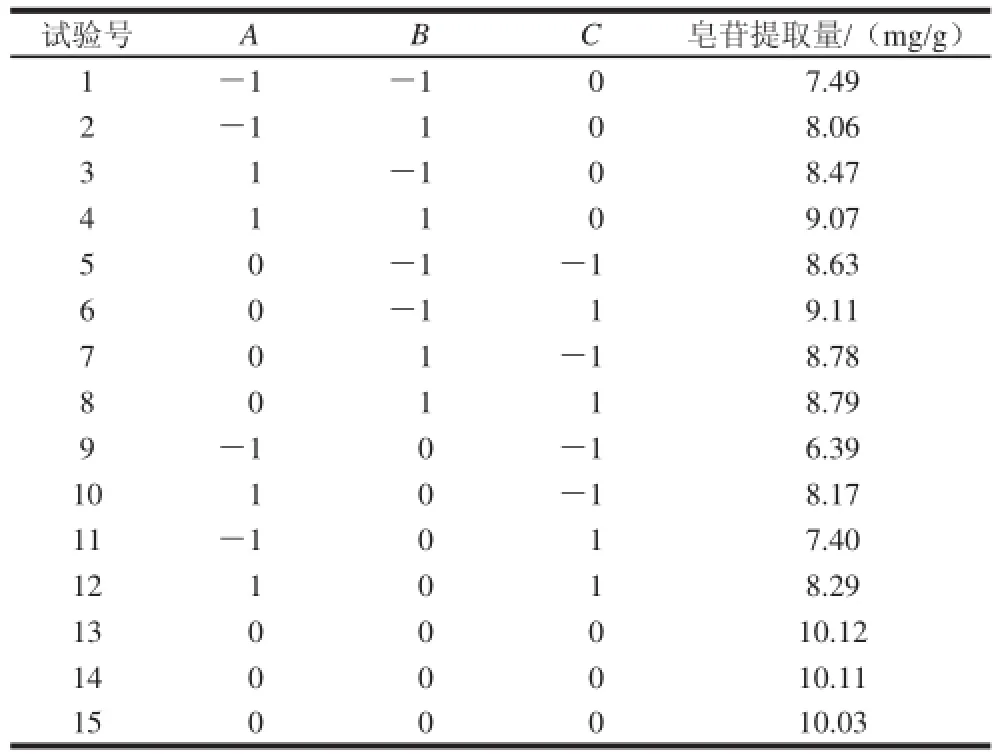
表3 Box-Behnken试验设计方案及结果Table3 The Box-Behnken experimental design and results for response surface analysis
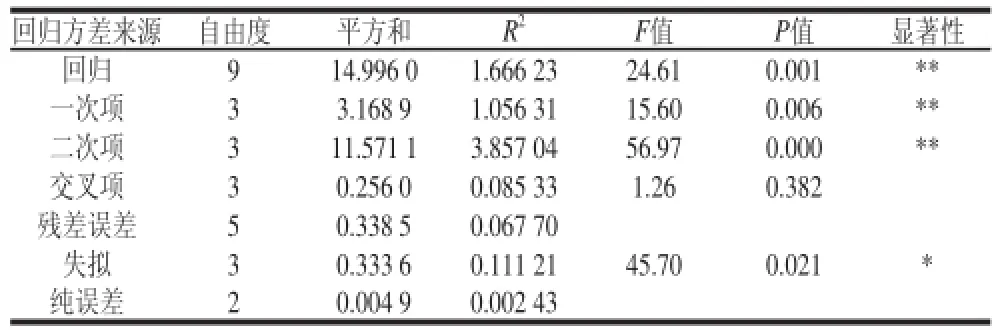
表4 方差分析Table4 Analysis of variance for the fitted regression equation
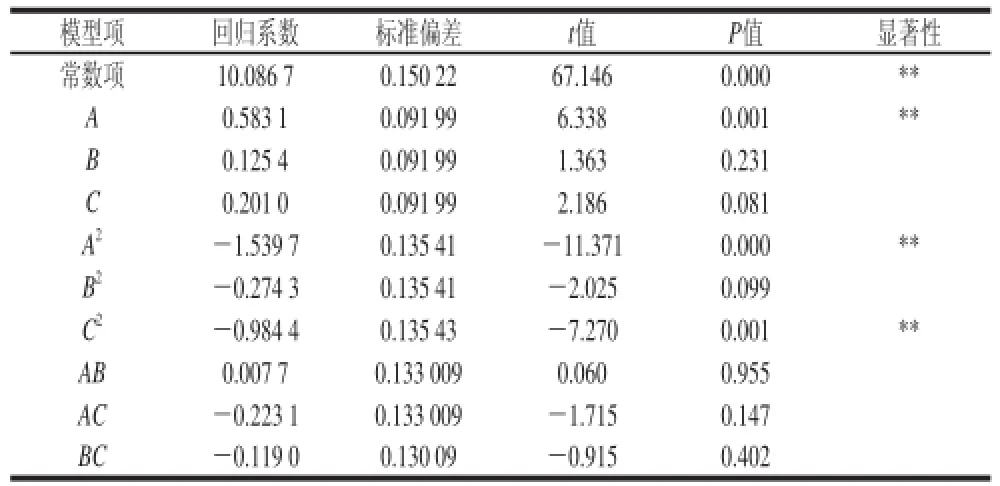
表5 回归方程系数检验Table5 Regression coefficients and theirsignificance in the quadratic model
对所得数据采用SAS(statistics analysis system)进行回归分析。从表4的回归方程方差分析结果可知,用上述回归方程描述各因素与响应值之间的关系时,其因变量和全体自变量之间的线性关系显著(R2=97.79%),模型的显著水平P<0.01,此时二次回归方差模型是极显著的,方程对试验拟合较好,说明试验方法是可靠的。各因素经回归拟合后得回归方程:Y=10.086 7+0.583 1A+0.125 4B+0.201 0C-1.539 7A2-0.274 3B2-0.984 4C2+0.007 7AB-0.223 1AC-0.119 0BC。
由回归方程系数显著性检验(表5)可知,因素A对皂苷提取量线性效应极显著,因素A2、AC显著,说明实验因子对响应值的影响不是简单的线性关系。另外,回归方程中二次项的系数为负值,表明回归方程所对应的抛物线开口向下,存在最大值。同时,根据实验数据绘出Y值随A、B、C变化的关系图,如图4所示。在实验区域内有最高点,即实验结果Y在实验区域内有最大值。由回归模型的响应面图可以看出,皂苷提取量随着各两因素的增加先呈上升趋势,当各两因素达到某一水平时,皂苷提取量增加缓慢,随后下降。
综合以上实验结果,依据响应面试验分析得到海蓬子皂苷的最佳提取工艺条件为料液比1∶27、乙醇体积分数62%、超声时间30 min。在此工艺条件下进行验证实验,所得海蓬子皂苷的提取量为10.14 mg/g原料,与模型所得理论值10.160 9 mg/g原料相近,偏差较小。表明回归方程能较真实地反映各因素对海蓬子皂苷提取量的影响,Box-Behnken设计所得到的模型拟合程度高,准确有效,用于优化筛选海蓬子皂苷提取工艺可行。


图4 各因素交互作用对提取效果影响的等高线图及响应面Fig.4 Response surface and contour plots for the interactive effects of extraction parameters on extraction efficiency of saponin
2.3 皂苷的鉴定
2.3.1 显色反应
样品在氯仿-浓硫酸显色反应中,氯仿层呈红色,硫酸层出现绿色荧光色,符合皂苷化合物的颜色反应。样品的乙酸酐-浓硫酸反应呈红色,表明该样品皂苷可能为三萜类皂苷。
2.3.2 红外光谱分析
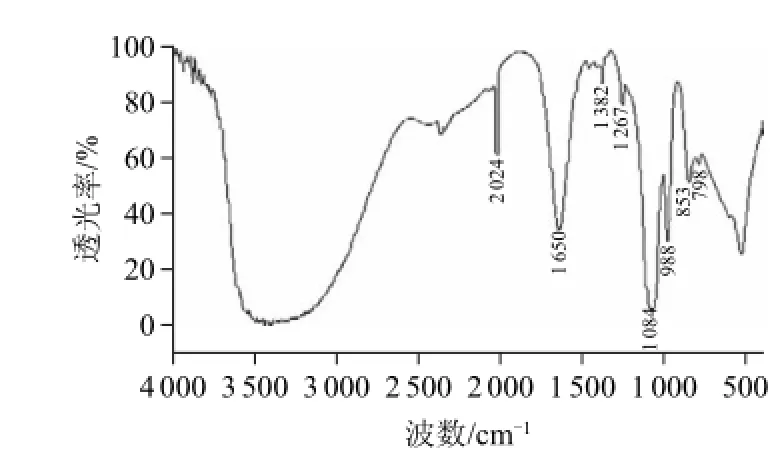
图5 海蓬子皂苷红外光谱图Fig.5 IR spectrum of saponin from Salicornia herbacea
从图5可看出,2 024 cm-1处为C≡C键的伸缩振动;1 650 cm-1处为苯环的C=C键伸缩振动;1 382、1 267 cm-1分别为C—O键振动吸收峰和O—H键面内弯曲振动的吸收,为羧基(—COOH)的特征峰,表明化合物中含有羧酸;1 084 cm-1处为C—OH键的伸缩振动峰;988 cm-1处为β-D-吡喃糖苷的特征峰[19],可以推断其含有糖类化合物;853 cm-1和798 cm-1处为C—H键面外弯曲振动,为芳香化合物重要特征峰[20]。此外,在1 355~1 392 cm-1和1 245~1 330 cm-1处各有一个吸收峰,由此可推测海蓬子皂苷为四环三萜类皂苷[21]。
2.4 皂苷提取物体外对α-糖苷酶活的抑制作用

图6 皂苷对α-糖苷酶的抑制曲线Fig.6 Inhibitory effect of saponin from Salicornia herbacea on α-glycosidase
由图6可以看出,海蓬子皂苷提取物对α-葡萄糖苷酶具有明显抑制作用,其抑制率随质量浓度的上升而增大,呈剂量效应。在其在质量浓度为2 mg/mL时,抑制率达到68.20%。而阳性对照阿卡波糖为α-葡萄糖苷酶的抑制剂,是临床上常用的治疗糖尿病药物,其质量浓度仅为1.50 mg/mL时,对α-葡萄糖苷酶的抑制率即高达92.30%。本实验结果提示,海蓬子皂苷可能具有阿卡波糖样的降血糖机制,值得进一步深入研究。
2.5 皂苷提取物对胰脂肪酶的抑制活性
由图7可见,海蓬子皂苷提取物对胰脂肪酶最大抑制率为84.28%,半抑制浓度(half maximal(50%)inhibitory concentration,IC50)为1.01 mg/mL。
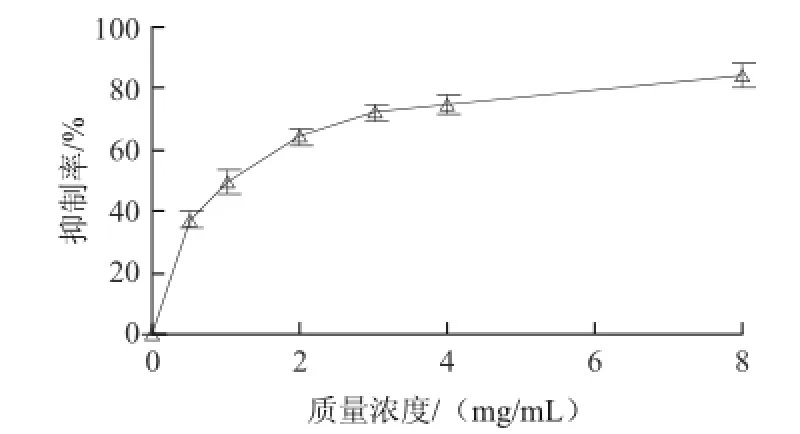
图7 皂苷对胰脂肪酶的抑制作用Fig.7 Inhibitory effect of saponin from Salicornia herbacea on pancreatic lipase
3 讨论与结论
3.1 响应面分析法由一组数学和统计学方法组成,可用于确定各因素及其交互作用在加工过程中对非独立变量的影响,精确地表述因素和响应值之间的关系,是一种优化反应条件和加工工艺参数的有效方法,由于其合理的设计和优良的结果,已被广泛应用。该方法能克服正交设计只能处理离散的水平值,而无法找出整个区域上因素的最佳组合和相应值的最优值的缺陷。本实验表明,运用该方法研究海蓬子皂苷提取工艺参数,求得的回归方程精度高,能实现多目标同步优化,结果较为准确可靠,具有实用价值。
3.2 α-葡萄糖苷酶在机体代谢中起着非常重要的作用,人体对淀粉等多糖类食物的最终消化和吸收都依赖它。而α-葡萄糖苷酶抑制剂可以竞争性抑制位于小肠内各种α-葡萄糖苷酶,使葡萄糖的生成和吸收减缓,从而降低餐后血糖峰值,调节血糖水平[22-23],是临床治疗糖尿病的一类药物。因此,从植物中寻找和筛选α-葡萄糖苷酶抑制剂一直是降糖研究的热点。结果表明,海蓬子皂苷提取物能有效抑制α-葡萄糖苷酶活性,且呈剂量依赖关系,提示海蓬子皂苷可能具有阿卡波糖样的降血糖作用机制。
3.3 胰脂肪酶是水解膳食脂肪的关键酶,可水解50%~70%的食物脂肪。通过抑制胰脂肪酶活性可以减少人体对饮食中脂肪的水解和吸收,控制高血脂,对治疗肥胖症及预防其并发症具有良好效果[24-25]。因此,开发和应用胰脂肪酶抑制剂作为减肥药物备受关注。本实验表明,海蓬子皂苷提取物是胰脂肪酶的高效抑制剂,其抑制率高达84.28%,IC50为1.01 mg/mL,应用价值极高。
综上所述,采用响应面分析法优化海蓬子皂苷的提取条件合理可行;海蓬子皂苷是对α-葡萄糖苷酶和胰脂肪酶有抑制活性的天然化合物,深入探讨其作用机制及构效关系,对相关功能食品和药物的研发有潜在意义。
[1] 樊文娜, 王成章, 史鹏飞, 等. 苜蓿皂甙的研究应用进展[J]. 草业科学, 2008, 25(11): 65-69.
[2] 郑杰, 李婧, 武强, 等. 植物皂甙类成分降血糖研究概况[J]. 食品科学, 2009, 30(3): 292-295.
[3] 王海南. 人参皂苷药理研究进展[J]. 中国临床药理学与治疗学, 2006, 11(11): 1201-1206.
[4] 李佳, 王成章, 严学兵, 等. 植物皂苷生物活性研究进展[J]. 草业科学, 2012, 29(3): 488-494.
[5] 刘晓庚, 夏养国, 汪峰, 等. 海蓬子种子中脂肪酸组成成分分析[J].食品科学, 2005, 26(2): 182-185.
[6] 洪立洲, 丁海荣, 杨智青, 等. 盐生植物海蓬子的研究进展及前景展望[J]. 江西农业学报, 2008, 20(7): 46-48.
[7] 叶颜春. 海蓬子的开发利用及栽培[J]. 特种经济动植物, 2004(7): 26-27.
[8] 陈美珍, 陈伟洲, 宋彩霞. 海蓬子营养成分分析与急性毒性评价[J].营养学报, 2010, 32(3): 286-289.
[9] LEE K Y, LEE M H, CHANG I Y, et al. Macrophage activation by polysaccharide fraction isolated from Salicornia herbacea[J]. Journal of Ethnopharmacology, 2006, 103: 372-378.
[10] 余晓红, 申玉香, 陈洪兴, 等. 海蓬子提取物抑制酪氨酸合成酶活性的研究[J]. 食品科学, 2010, 31(21): 131-133.
[11] CHUNG Y C, CHUN H K, YANG J Y, et al. Tungtungmadic acid anovel antioxidant from Salicornia herbacea[J]. Archives of Pharmacal Research, 2005, 28: 1122-1126.
[12] KIM C S, SONG T G. Ecological studies on the halophyte communities at western and southern coasts in Korea[J]. Korean Journal of Ecology, 1983, 6: 167-176.
[13] HYUN P S, KWON K S, GYU C J, et al. Salicornia herbacea prevents high fat diet-induced hyperglycemia and hyperlipidemia in ICR mice[J]. Archives of Pharmacal Research, 2006, 29(3): 256-264.
[14] 林爱琴. 落葵提取物中皂苷含量的测定[J]. 应用化工, 2009, 38(8): 1220-1229.
[15] 张俐勤. 低热量甜味剂罗汉果的分离、分析及其生物活性评价[D].武汉: 华中农业大学, 2004.
[16] 刘湘, 汪秋安. 天然产物化学[M]. 北京: 化学工业出版社, 2005: 108.
[17] 王斯慧, 黄婉凌, 陈庆松, 等. 芦丁、槲皮素对α-葡萄糖苷酶活性抑制研究[J]. 中国酿造, 2012, 31(1): 133-135.
[18] 霍世欣, 周陶忆, 司晓晶, 等. 荷叶黄酮化合物对胰脂肪酶抑制作用的研究[J]. 天然产物研究与开发, 2008(20): 328-331.
[19] 陈长战. 三萜皂甙结构鉴定的常用方法[J]. 化学研究与应用, 1999(11): 119-124.
[20] 朱淮武. 有机分子结构波谱解析[M]. 北京: 化学工业出版社, 2005: 47-48.
[21] 庚石山. 三萜化学[M]. 北京: 化学工业出版社, 2008: 119.
[22] 刘瑞丽, 丁美萍, 徐雯, 等. α-葡萄糖苷酶抑制剂研究进展[J]. 药物生物技术, 2009, 16(4): 388-392.
[23] 顾觉奋, 陈紫娟. α-葡萄糖苷酶抑制剂的研究及应用[J]. 药学进展, 2009, 33(2): 62-67.
[24] 姜运耀, 吕国英, 李燕飞, 等. 植物来源的胰脂肪酶抑制剂研究进展[J].中国生化药物杂志, 2012, 33(2): 199-202.
[25] 刘蕊, 郑毅男. 人参(西洋参)抑制胰脂肪酶活性及其抗肥胖作用[J].人参研究, 2010(1): 14-19.
Optimization of Extraction Conditions for Saponin from Salicornia herbacea by Response Surface Method and Its Biological Activity
LIANG Bin, LI Juan, YU Jie*, CHEN Mei-zhen
(Department of Biology, College of Science, Shantou University, Shantou 515063, China)
Response surface methodology was used to optimize the extraction process for saponins from young leaves of Salicornia herbacea. The saponions extracted were structurally characterized and evaluated for inhibitory effect on α-glucosidase and pancreatic lipase in vitro. Our results indicated that the optimal extraction conditions were material-toliquid ratio of 1:27 (g/mL), ethanol concentration (V/V) of 62%, and ultrasonification time of 30 min. Under these extraction conditions, maximum yield of saponins of 10.14 mg/g was obtained. Color reaction and infrared spectral analysis showed that the basic structure of saponins from Salicornia herbacea was tetracyclic triterpene saponin. The purified saponins had a strong inhibitory effect on both α-glycosidase and pancreatic lipase in vitro in a dose-dependent manner, and the maximum inhibitory rates were 68.20% and 84.28%, respectively. These results suggest that saponins from Salicornia herbacea may have similar hypoglycemic mechanism and hypolipidemic effect to acarbose.
Salicornia herbacea; saponin; response surface methodology; α-glycosidase; pancreatic lipase
TS209
A
1002-6630(2014)02-0102-06
10.7506/spkx1002-6630-201402019
2013-08-07
广东省科技计划项目(2010B020201015);汕头市科技计划项目(2011-156)
梁彬(1988—),女,硕士研究生,研究方向为天然活性物质。E-mail:11bliang@stu.edu.cn
*通信作者:余杰(1955—),男,副教授,学士,研究方向为功能食品研究与开发。E-mail:jyu@stu.edu.cn
