响应曲面法优化浙东白鹅皮胶原蛋白提取条件
2014-01-17张玉林赵紫微潘道东
丁 琳,张玉林,杨 媛,赵紫微,潘道东*
(宁波大学海洋学院,浙江 宁波 315211)
响应曲面法优化浙东白鹅皮胶原蛋白提取条件
丁 琳,张玉林,杨 媛,赵紫微,潘道东*
(宁波大学海洋学院,浙江 宁波 315211)
以浙东白鹅皮为对象,探讨酸种类、pH值、料液比及提取时间对胶原蛋白提取率的影响,先确定酸的种类,然后在单因素试验分析的基础上,采用响应曲面优化提取工艺。结果表明:最佳提取工艺为酸种类乳酸、pH 1.9、料液比1∶50(g/mL)、提取时间60 h。在此条件下,鹅皮胶原蛋白提取率达到30.12%,与理论预测值相比相对偏差为0.13%。经紫外光谱推断为典型的Ⅰ型胶原蛋白,红外光谱分析可得出其具有完整的三螺旋结构。
鹅皮;胶原蛋白;乳酸;响应曲面
胶原又称胶原蛋白,主要存在于动物的皮、骨、牙齿、肌腱、韧带和血管中,目前已经发现了27种类型的胶原蛋白[1]。胶原是生皮中最主要的纤维蛋白,在真皮蛋白质中,胶原占85%~90%[2]。我国鹅饲养量占到世界的90%左右[3],浙东白鹅是中国著名地方良种,鹅皮中脂肪含量极高,胶原纤维层约占皮张总厚度的1/35~1/20[4],所以除脂后的鹅皮可以成为胶原蛋白的良好来源,但迄今尚未有利用鹅皮提胶原蛋白的研究。
目前酶提胶原蛋白的方法研究较多,但酶解完成后需高温灭酶,高温会引起胶原蛋白变性,如王哲平等[5]发现经40 ℃热处理后刺参胶原蛋白的一级和二级结构遭破坏;杨霞等[6]研究表明驴皮酸溶性和酶溶性胶原蛋白的热收缩温度分别是50.90 ℃和65.33 ℃。酸法能够保证整个提取过程在低温中进行,而且相对酶法更经济有效,陈丽丽等[7]优化酸提鮰鱼皮胶原蛋白后提取率达到62.05%。本研究优化酸提鹅皮胶原蛋白的方法,并用紫外光谱和傅里叶变换红外线光谱[8]分析出其胶原蛋白的类型,旨在为胶原蛋白的开发利用促进浙江养鹅业的发展提供参考。
1 材料与方法
1.1 材料与试剂
鹅皮 市售鹅剥取。
透析袋(14 000 kD);柠檬酸、乳酸、醋酸、石油醚、丙酮、乙醚、异丙醇、丁醇、氢氧化钠、氯化钠、氯胺T、高氯酸、对二甲基苯甲醛均为国产分析纯。
1.2 仪器与设备
XHF-D高速分离器 宁波新芝生物科技有限公司;恒温磁力搅拌机 上海沪西分析仪器场;台式高速冷冻离心机 长沙湘仪离心机有限公司;UV-4802紫外-可见分光光度计 尤尼坷(上海)仪器有限公司;冷冻干燥机 北京博医康仪器有限公司;精密酸度计、AL204电子天平 梅特勒-托利多仪器有限公司;TM500型数字控温电热套 海宁市华星仪器场;Bruker Tensor 27傅里叶红外光谱仪 德国Billerica公司。
1.3 方法
1.3.1 鹅皮基本成分测定
水分含量的测定:参照GB 5009.3—2010《食品中水分的测定》;灰分含量的测定:参照GB 5009.4—2010《食品中灰分的测定》;粗蛋白质含量的测定:参照GB 5009.5—2010《食品中蛋白质的测定》;粗脂肪含量的测定:参照GB/T 5009.6—2003《食品中脂肪的测定》。
1.3.2 提取工艺流程
鹅皮→修整、剪碎→脱脂→脱杂蛋白→酸提→盐析纯化→冻干
1.3.3 处理
由于胶原蛋白易变性,所以实验操作都低于10 ℃进行[9]。
脱脂:将鹅皮以1∶10(g/mL)的比例分别置于丙酮、石油醚、乙醚、10%(V/V)异丙醇、10%(V/V)丁醇5种脱脂剂中脱脂24 h,测出脱脂前后鹅皮中的脂肪含量,确定最佳的脱脂剂。脂肪残留量(残油率)按公式(1)计算:

脱杂蛋白[10]:选取上述脱脂效果最好的一组继续脱杂蛋白,在m(鹅皮)∶V(0.1 mol/L NaOH)=1∶20条件下连续搅拌6 h,再用2.5% NaCl连续搅拌6 h,处理完毕后用双蒸水洗涤2次。
盐析纯化[11]:向粗制液中加入NaCl固体并不停搅拌,使浓度达到2 mol/L,然后在4 ℃冰箱中静置过夜,离心,沉淀用酸复溶后在双蒸水中透析2~3 d。
1.3.4 提取剂的选择
在4 ℃、料液比1∶40(g/mL)、提取时间24 h条件下,选用醋酸、乳酸、柠檬酸3种酸为提取剂,考察不同酸对胶原蛋白提取率的影响。
1.3.5 胶原蛋白提取工艺的优化
1.3.5.1 单因素试验
固定4 ℃、料液比1∶40(g/mL)、提取时间24 h、pH 1.9条件,分别考察pH值(1.5、1.7、1.9、2.1、2.3、2.5)[12]、料液比(1∶20、1∶30、1∶40、1∶50、1∶60、1∶70)、提取时间(24、36、48、60、72、84 h)对胶原蛋白提取率的影响。
1.3.5.2 响应曲面试验
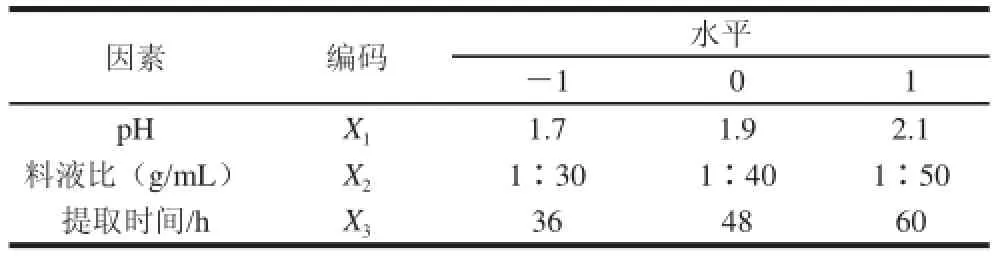
表1 Box-Behnken设计试验因素水平及编码Table1 Coded levels for independent variables used in Box-Behnken experimental dessiiggnn
采用Design-Expert 7.0软件,并依据Box-Behnken设计原理,以胶原蛋白的提取率为响应值,选取pH值、液料比、提取时间这3个因素在3个水平上进行响应曲面试验。共计17组,其中5个为中心点试验。
1.3.6 胶原蛋白提取率的计算
采用羟脯氨酸法测定胶原蛋白,参照文献[13]绘制羟脯氨酸标准曲线。
样品胶原蛋白含量的测定:准确称取样品5 mg于具塞试管中,加入3 mol/L硫酸3 mL,用电热套130 ℃水解4 h,水解完成后纯水定容到100 mL,滤纸过滤,收集滤液于锥形瓶中,取滤液4 mL用对二甲氨基苯甲醛显色,于波长558 nm处比色测定,测得3个吸光度求平均值,根据羟脯氨酸标准曲线得到水解液中的羟脯氨酸含量,再乘以14.2,得到提取物中胶原蛋白的含量[14],胶原蛋白提取率见式(2),胶原蛋白纯度见式(3)。

1.3.7 胶原蛋白的紫外光谱分析
将纯化后的的胶原蛋白样品溶于0.5 mol/L乳酸溶液中,配成1 g/L的胶原溶液。用紫外-可见分光光度计在200~400 nm近紫外光区以120 nm/min的速率扫描测试,扫描精度为1 nm。
1.3.8 胶原蛋白的红外光谱测定
称取一定量干燥的KBr和胶原蛋白冻干品混合置于玛瑙研钵中,研磨成粉末状,装样,手动压片,取出样品,放入样品室。采用傅里叶变换红外光谱仪对样品在4 000~500 cm-1波数处扫描。
2 结果与分析
2.1 鹅皮基本成分测定

表2 鹅皮基本组成成分(湿基)Table2 Proximate composition of goose skin (on a wet basis)
由表2可知,鹅皮中脂肪含量相对于其他动物皮(猪皮、鱿鱼皮等)高[15-16],脂肪会影响所提取胶原蛋白的品质,同时可能使蛋白有异味,所以除脂这个步骤比较关键;其次,鹅皮中粗蛋白含量占鹅皮干基的49.38%,胶原蛋白含量占粗蛋白的66.37%,所以鹅皮可作为胶原蛋白提取的良好原料。
2.2 脱脂处理对鹅皮脂肪残留率(残油率)的影响

表3 不同脱脂剂处理的残油率Table3 Residual fat content in goose skin degreased with different organic solvents
由表3可看出,5种脱脂剂处理鹅皮后,经乙醚处理的鹅皮残油率最低,故选择采用乙醚除脂。
2.3 酸种类对胶原蛋白提取率的影响

图1 3种酸在不同pH值条件下对胶原蛋白提取率的影响Fig.1 Effect of 3 types of acids at different pH conditions on extraction yield of collagen
根据图1,相同pH值条件下,乳酸溶液对胶原蛋白的提取效果较好,且当乳酸pH值为1.9时,提取效果最好,提取率为27.45%。另外,由于配制相同体积、相同pH值的提取液时,乳酸需要量相对比较少;可以避免价格高带来的成本损耗,进而可以适用于工业化生产。综上所述,从这3种酸中选出乳酸作为鹅皮胶原蛋白的提取剂,优化乳酸提取胶原蛋白的条件。
2.4 乳酸提取胶原蛋白的单因素试验
2.4.1 pH值对胶原蛋白提取率的影响

图2 pH值对胶原蛋白提取率的影响Fig.2 Effect of pH on extraction yield of collagen
由图2可知,4 ℃、料液比1∶40(g/mL)、提取时间24 h条件下,pH<1.5时胶原蛋白提取率较低,可能是由于胶原蛋白变性导致提取率下降。随着乳酸pH值的增大,胶原蛋白提取率呈现逐渐增大后减小的趋势,因此确定最佳pH值为1.9,此时提取率为27.47%。
2.4.2 料液比对胶原蛋白提取率的影响

图3 料液比对胶原蛋自提取率的影响Fig.3 Effect of solid-to-liquid ratio on extraction yield of collagen
由图3可知,4 ℃、pH 1.9、提取时间24h条件下,料液比与胶原蛋白提取率呈正相关,当料液比小于1∶40(g/mL)时,胶原蛋白提取率升高趋于平缓,故从工业化生产的考虑选择料液比为1∶40较为合适,此时,胶原蛋白提取率为27.44%。
2.4.3 提取时间对胶原蛋白提取率的影响
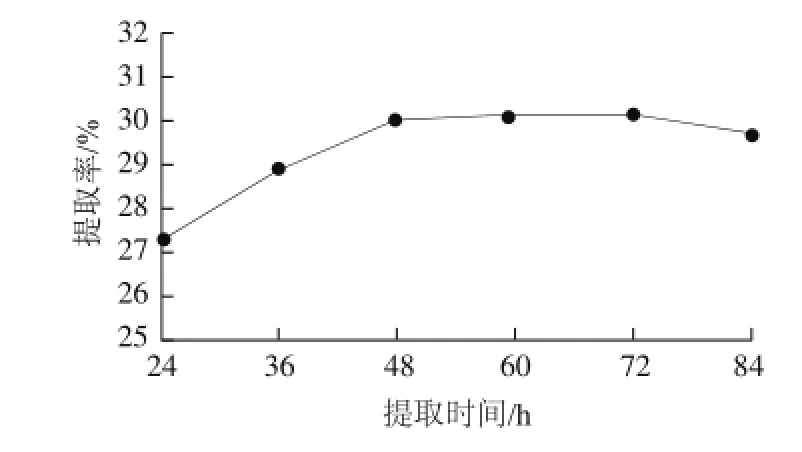
图4 提取时间对胶原蛋白提取率的影响Fig.4 Effect of extraction time on extraction yield of collagen
由图4可知,在4 ℃、pH 1.9、料液比1∶40条件下,在24~48 h内,随着提取时间的延长,胶原蛋白的提取率明显增加,而48 h后随着提取时间的延长,胶原蛋白提取率升高趋势平缓,72 h后出现略微下降[17]。所以从经济和实际考虑,选定提取时间48 h较为合适,此时胶原蛋白提取率为30.06%。
2.5 胶原蛋白最佳提取工艺条件的确定
2.5.1 回归模型的建立及方差分析
在单因素试验基础上,根据Box-Behnken原理,以胶原蛋白提取率为响应值,设计三因素三水平的响应曲面分析试验,数据采用Design-Expert 7.0软件进行分析。
通过Design-Expert 7.0数据分析软件对表4中响应值与各因素进行回归拟合后,得到胶原蛋白提取率Y对乳酸溶液pH值(X1)、料液比(X2)和提取时间(X3)编码值的二次多项回归方程为:


表4 鹅皮胶原蛋白提取工艺响应曲面试验设计及结果Table4 The experimental design and results for response surface analysis
回归模型各项系数的显著性检验结果和方程的方差分析结果见表5。
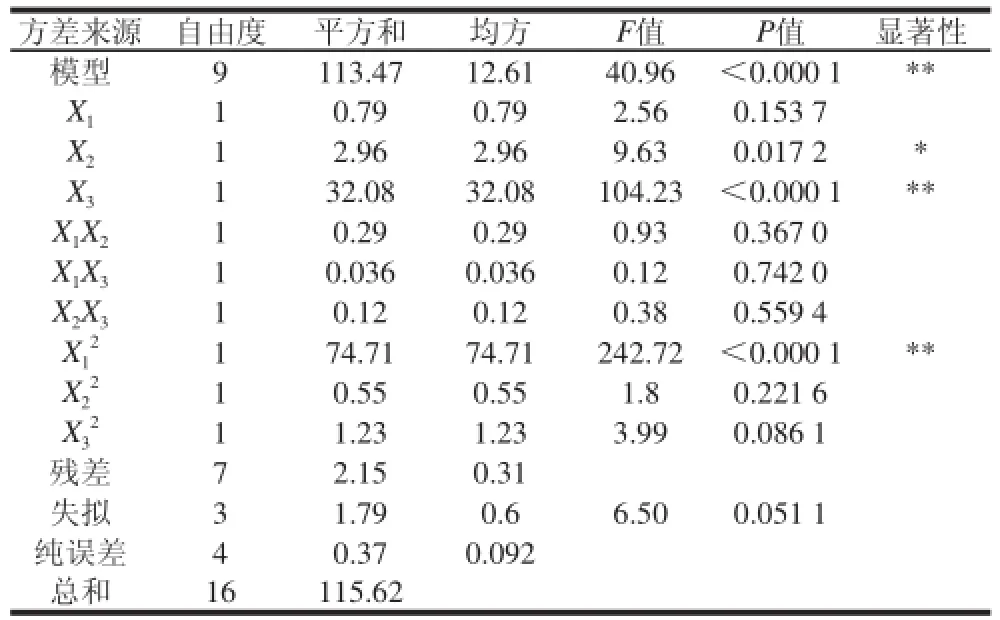
表5 回归方程各项系数的显著性检验和方差分析Table5 Significance test and analysis of variance for the terms in the regression model
R2=0.981,相关系数接近于1,表明该模型与实际实验拟合较好[18],自变量与响应值之间线性关系显著,可以用于鹅皮胶原蛋白提取实验的理论预测。根据表5,模型中X2项显著差异;极显著差异,其余项差异均不显著;3个因素对胶原蛋白提取率的影响依次为X3>X2>X1,即提取时间>料液比>pH值。
2.5.2 胶原蛋白提取工艺的响应面分析及优化
由图5~7可知,在此试验条件下,主因素对提取率影响大小顺序为:提取时间(X3)>液料比(X2)>pH值(X1)。且随着料液比中提取液用量的增大和提取时间的延长,胶原蛋白的提取率均有提高;而随着乳酸pH值的增大,胶原蛋白提取率呈现先增大后减小的变化,当乳酸pH 1.9时,胶原蛋白的提取率较高。
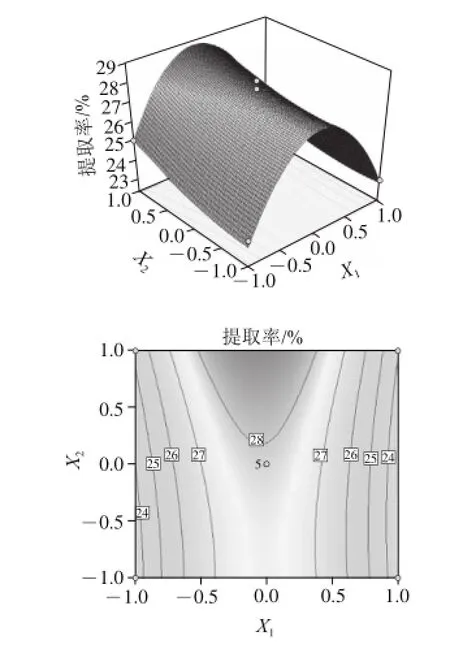
图5 5 Y = = F(X1, , X2)响应面立体分析图及相应等高图Fig.5 Response surface and contour plots of Y = = F(X1, , X2)

图6 6 Y Y = F F(X1, , X3)响应面立体分析图及相应等高图Fig.6 Response surface and contour plots of Y Y = F F(X1, , X3)
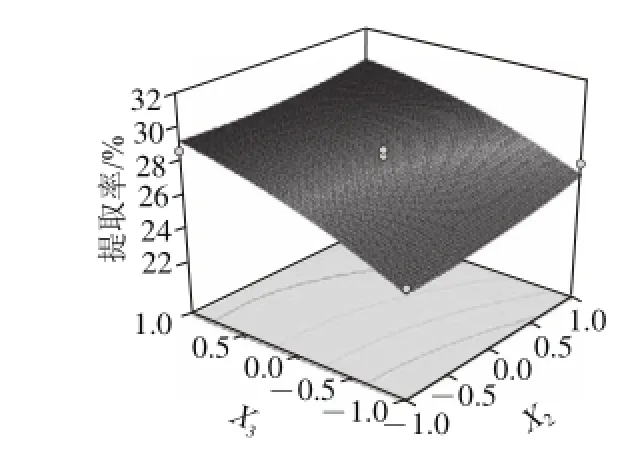

图7 7 Y Y = = F(X2, , X3)响应面立体分析图相应等高图Fig.7 Response surface and contour plots of Y Y = = F(X2, , X3)
2.5.3 胶原蛋白最佳提取工艺条件的验证实验
利用Design-Expert 7.0软件分析得到胶原蛋白的最佳提取条件为乳酸溶液pH 1.88、料液比1∶50(g/mL)、提取时间60 h,此时提取率可达30.16%。为验证响应面法的可靠性,采用上述最优条件来提取胶原蛋白,选定提取条件pH 1.9、料液比1∶50(g/mL)、提取时间60 h,实验重复3次,实际测得的提取率为30.12%,与理论预测值相对偏差为0.13%。因此采用响应面分析方法得到的优化条件准确可靠,具有实用价值。
2.6 胶原蛋白的紫外光谱分析结果
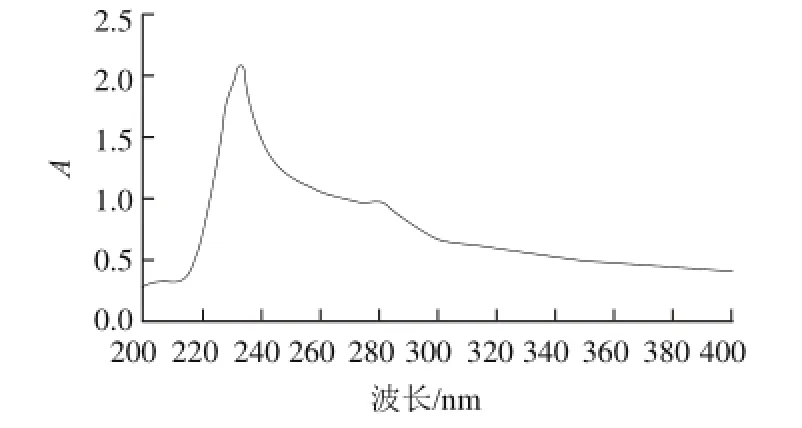
图8 鹅皮乳酸溶性胶原蛋白的紫外光谱图Fig.8 Ultraviolet absorption spectrum of lactic acid-soluble collagen from goose skin
通常,胶原蛋白的特征峰在230 nm波长附近[18],这主要是由肽键C=O的n→π跃迁所贡献;蛋白质中酪氨酸、苯丙氨酸的最大紫外吸收波长分别为283 nm和251 nm。从图8可看出,乳酸浸提所得到的胶原蛋白特征吸收波长位于230 nm波长处附近,符合胶原蛋白的特性;在283 nm波长处略有吸收说明该胶原蛋白有少量芳香族氨基酸(酪氨酸等),而在251 nm波长处很少吸收,说明所提鹅皮胶原蛋白中苯丙氨酸含量较少。综上,可以初步推断所提取的蛋白质为典型Ⅰ型胶原蛋白[19-21]。
2.7 胶原蛋白的红外光谱检测结果
从图9可以看出,本方法所得胶原蛋白在3 417 cm-1处有吸收峰,是因为N—H键伸缩振动产生的酰胺A带;而在1 654.9 cm-1处存在的吸收峰是酰胺Ⅰ带的C=O键伸缩振动,表明有羰基存在;1 546 cm-1处的吸收峰是酰胺Ⅱ带的N—H键弯曲振动;1 200~1 400 cm-1光谱内的吸收峰是其他蛋白所没有的;1 240 cm-1为N—H键弯曲引起的酰胺Ⅲ带的特征频率。由此可说明此胶原蛋白存在完整的三股螺旋结构[22-23]。
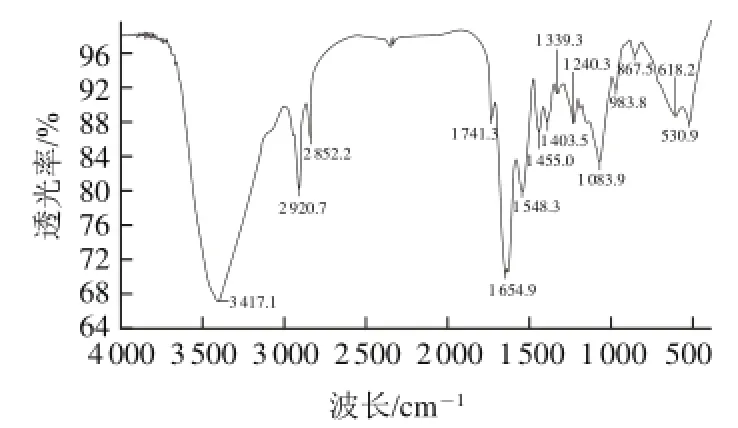
图9 乳酸法提取鹅皮胶原蛋白的红外光谱图Fig.9 Infrared spectrum of lactic acid-soluble collagen from goose skin
3 结 论
本实验确定了酸提鹅皮胶原蛋白的最佳工艺:预处理中选用乙醚脱脂效果最好;醋酸、乳酸、柠檬酸3种酸中乳酸浸提效果最好,这与Skierka等[24]研究结果是一致的;pH 1.9、料液比1∶50(g/mL)、提取时间60 h条件下胶原蛋白提取率达到30.12%,与理论预测值相对偏差为0.13%,纯度为92.01%。经紫外光谱测定推断此胶原蛋白为典型的Ⅰ型胶原蛋白;红外光谱检测得出其具有完整的三螺旋结构。乳酸提取法生产工艺简单[25],提取的胶原蛋白有较高的纯度,且较好的保持了其结构和生理活性,适于工业化推广。
[1] GOMEZ-GUILLEN M C, GIMENEZ B, LOPEZ-CABALLERO M E, et al. Functional and bioactive properties of collagen and gelatin from alternative sources: a review[J]. Food Hydrocolloids, 2011, 25: 1813-1827.
[2] 蒋挺大. 胶原与胶原蛋白[M]. 北京: 化学工业出版社, 2006: 98-102.
[3] 韩国省, 赵聘. 我国家禽养殖现状与发展趋势研究[J]. 河南农业, 2012(3): 18-20.
[4] 俞从正, 王永和, 罗卫平, 等. 鹅皮组织结构的研究[J]. 中国皮革, 1992, 21(7): 15-17.
[5] 王哲平, 刘淇, 曹荣, 等. 温度对刺参胶原蛋白结构和分子量变化的影响[J]. 渔业科学进展, 2011, 32(6): 80-84.
[6] 杨霞, 王珊珊, 赵芙钗, 等. 驴皮中胶原蛋白的提取及其特性[J]. 精细化工, 2011, 28(9): 883-886.
[7] 陈丽丽, 赵利, 刘华, 等. 有机酸提取鮰鱼皮胶原蛋白的工艺研究[J].食品机械, 2010, 26(5): 118-121.
[8] 陈璎洁. 蛋壳膜中提取出的胶原蛋白的表征[J]. 明胶科学与技术, 2009, 29(3): 131-136.
[9] 刘苏锐, 王坤余, 琚海燕. 猪皮Ⅰ型胶原蛋白的提取及其结构表征[J]. 中国皮革, 2007, 36(7): 43-46.
[10] 吴缇, 陈舜胜. 选择不同提取剂制备斑点叉尾鲴鱼皮胶原蛋白的研究[J]. 食品科学, 2008, 29(9): 321-324.
[11] LIU Dalong, LI Liang, REGENSTEIN J M, et al. Extraction and characterisation of pepsin-solubilised collagen from fins, scales, skins, bones and swim bladders of bighead carp (Hypophthalmichthys nobilis)[J]. Food Chemistry, 2012, 133: 1441-1448.
[12] 周彦钢, 贾建萍, 孙丽华. 淡水鱼皮胶原蛋白粉的成分分析[J]. 食品工业科技, 2007(7): 192-194.
[13] 蓝蔚青, 王川, 李燕, 等. 猪皮中羟脯氨酸含量的测定[J]. 中国食物与营养, 2006(6): 38-40.
[14] LIN Y K, LIU Dengcheng. Effects of pepsin digestion at different temperatures and times on properties of telopeptide-poor collagen from bird feet[J]. Food Chemistry, 2006, 94: 621-625.
[15] 王燕, 付万冬, 吴亮亮, 等. 鱿鱼皮胶原蛋白前处理的条件优化[J].饲料工业, 2011, 32(7): 18-20.
[16] 杜敏, 南庆贤. 猪皮胶原蛋白的制备及在食品中的应用[J]. 食品科学, 1994, 15(7): 36-40.
[17] 朱文学, 邱园, 肖枫, 等. 响应面法优化黄河鲤鱼鱼鳞酸溶性胶原蛋白提取工艺[J]. 食品科学, 2013, 24(20): 94-98.
[18] SIN H N, YUSOF S, HAMID N S A, et al. Optimization of enzymatic clarification of sapodilla juice using response surface methodology[J]. Journal of Food Engineering, 2006, 73(4): 313-319.
[19] 赵苍碧, 黄玉东, 李艳辉. 从牛腱中提取胶原蛋白的研究[J]. 哈尔滨工业大学学报, 2004, 36(4): 516-5l9.
[20] RAO K P, ALAMELU S. Effect of crosslinking agent on the release of an aqueous marker from liposomes sequestered in collagen and chitosan gels[J]. Member Science, 1992, 71: 161-163.
[21] 刘丽莉, 马美湖, 杨协力. 牛骨Ⅰ型胶原蛋白提取及结构表征[J]. 食品科学, 2010, 32(2): 87-91.
[22] 叶易春, 但卫华, 曾睿, 等. 酶法提取牛腱胶原的研究[J]. 中国皮革, 2005, 34(7): 4-7.
[23] 钟朝辉, 李春美, 顾海峰, 等. 温度对鱼鳞胶原蛋白二级结构的影响[J].光谱学与光谱分析,2007, 27(10): 970-976.
[24] SKIERKA E, SADOWSKA M. The influence of different acids and pepsin on the extractability of collagen from the skin of Baltic cod (Gadus morhua)[J]. Food Chemistry, 2007, 105: 1302-1306.
[25] MUYONGA J H, COLEB C G B, DUODU K G, et al. Characterization of acid soluble collagen from skins of young and adult Nile perch (Lates niloticus)[J]. Food Chemistry, 2004, 85(1): 81-89.
Optimization of Extraction Conditions for Collagen from Zhedong White Goose Skin by Response Surface Methodology
DING Lin, ZHANG Yu-lin, YANG Yuan, ZHAO Zi-wei, PAN Dao-dong*
(School of Marine Sciences, Ningbo University, Ningbo 315211, China)
The objective of this study was to optimize the acidic extraction of collagen from Zhedong white goose (a famous local breed of Chinese geese for meat production) skin. Acid type, pH, solid-to-liquid ratio and extraction time were considered in this study. Lactic acid was selected as optimal extraction solvent. One-factor-at-a-time method and response surface methodology were designed for the optimization of extraction conditions. The maximum extraction yield of collagen was experimentally observed as 30.12% under the optimized conditions: pH 1.9, solid-to-liquid ratio (g/mL) of 1:50 and extraction time of 60 h, showing a relative deviation of 0.13% compared with the predicted value. The sample obtained was identified as type Ⅰ collagen by ultraviolet spectroscopy. Meanwhile, intact triple helix structure was also identified by infrared spectroscopy.
goose skin; collagen; lactic acid; response surface methodology
TS201.2
A
1002-6630(2014)02-0056-06
10.7506/spkx1002-6630-201402011
2013-03-06
国家水禽产业技术体系基金项目(CARS-43-17);宁波市创新团队项目(2012B82017);宁波市人事局人才基金项目(ZX2012000380);浙江省重大科技计划项目(2012C12016-1)
丁琳(1990—),女,硕士研究生,研究方向为食品加工与贮藏工程。E-mail:yjsdinglin@163.com
*通信作者:潘道东(1964—),男,教授,博士,研究方向为畜产品加工。E-mail:daodongpan@163.com
