PEG模拟干旱胁迫对亚麻种子萌发及幼苗生长的影响
2014-01-16刘风侯勤正
刘风,侯勤正
(1.甘肃省农业科学院,甘肃 兰州 730070;2.西北师范大学,甘肃 兰州 730070)
PEG模拟干旱胁迫对亚麻种子萌发及幼苗生长的影响
刘风1,侯勤正2
(1.甘肃省农业科学院,甘肃 兰州 730070;2.西北师范大学,甘肃 兰州 730070)
采用不同PEG浓度模拟干旱条件,对亚麻品种陇亚8号种子萌发及幼苗进行胁迫。结果表明,在较低PEG浓度下(20%),亚麻种子萌发率、幼苗茎叶鲜重、主根长度、幼苗色素浓度显著下降,叶片MDA积累量显著升高,侧根数目增多,叶片内可溶性糖含量增加;随着PEG浓度增加,亚麻种子萌发率、幼苗茎叶鲜重下降趋缓,叶片MDA积累量上升趋缓,主根长度、色素浓度下降,侧根明显增多,叶片可溶性糖含量提高。
PEG干旱胁迫;种子萌发;幼苗生长;亚麻
亚麻(Linum usitatissium L.)属亚麻科,是古老且分布很广的重要纺织纤维和油料作物,其种子是食用油和蛋白质的重要来源[1]。目前,全球亚麻种植面积在53万hm2左右,主要分布在俄罗斯、中国、法国等。随着全球经济一体化步伐的加快,麻业种植业面临前所未有的发展机遇,我国亚麻种植面积和加工能力已位居世界第2位,亚麻生产将成为我国农业重要支柱产业之一[2]。甘肃省是我国重要的亚麻种植基地,但种植区域主要局限在陇南、天水等较为湿润地区,干旱是影响其扩大种植的重要影响因素之一[3]。近年来亚麻育种以及逆境胁迫下幼苗生长生理研究报导较多[4~7],但干旱胁迫下亚麻种子萌发及幼苗生长的生理生化变化却鲜有报道。聚乙二醇(PEG)胁迫是研究作物种子萌发抗旱性的一种简便、有效的方法[8],我们以陇亚8号为指示作物品种,通过不同浓度PEG溶液模拟干旱条件,研究水分胁迫对亚麻种子萌发率以及亚麻幼苗叶片鲜重、丙二醛(MDA)含量以及色素含量等指标变化,旨在了解亚麻在种子萌发及幼苗生长对干旱胁迫的响应,为亚麻抗性育种提供参考。
1 材料与方法
1.1 供试材料
指示亚麻品种为陇亚8号,由甘肃省陇南市种子公司提供。供试聚乙二醇(PEG)为PEG-6000。
1.2 试验方法
试验设3个PEG浓度梯度。处理1(CK)为双蒸水,处理2为20%PEG溶液,处理3为25%PEG溶液,处理4为30%PEG溶液。3次重复,每重复的种子用量为50粒。将滤纸浸透不同溶液,放置在直径为90 mm的培养皿中。精选供试亚麻种子,先用1 g/kg HgCl2溶液消毒15 min,再用50%H2SO4溶液处理1 h,然后用双蒸水漂洗3次后置于培养皿中的滤纸上,将培养皿置于24℃恒温箱中,光照、黑暗12 h/12 h培养。自培养之日起,每日为对照组加双蒸水3 mL,各处理按试验方案加不同浓度的PEG溶液3 mL,每4 d换1次滤纸。
1.3 测定与统计方法
从种子置床之日起观察。以胚根与种子等长作为发芽标准,首粒种子发芽之日作为该处理的发芽始期,以后每天定时记录发芽种子数,连续3 d不再有种子发芽时作为发芽结束期,统计种子萌发率。发芽率是正常发芽的种子数与供试种子总数的百分比,计算公式为:

式中GR为种子发芽率(%),SN1为供试种子发芽粒数,SN0为供试种子总粒数。
发芽始期10 d后,随机从培养皿中取出10粒发芽种子,测量主根长度、侧根数量、茎叶总鲜重、叶片MDA含量及叶片色素含量。主根长度为正常幼苗的胚根长度,测量时取出幼苗,在试验台上用游标卡尺测量胚根基部至顶部的直线距离。茎叶总鲜重为正常幼苗的全部地上部分总鲜重,测量时将幼苗去除根部,用0.0001 g电子天平测量鲜茎叶总质量。
叶片MDA含量采用硫代巴比妥法计算,公式为:

式中A532、 A600和A450分布表示3,5,5-三甲基恶唑-2,4-二酮在532 nm、600 nm和450 nm下的光吸收度。
可溶性糖含量采用硫代巴比妥法计算,公式为

式中SS表示可溶性糖含量,A450表示可溶性糖与TBA反应产物在450 nm下的光吸收度。
色素采用乙醇浸提法提取,用分光光度法测定,按Lichtenthaler公式计算其含量。

式中Ca、Cb、Ct、Cx-c分别表示叶绿素a、叶绿素b、总叶绿素及类胡萝卜素含量,A665、A649和A470分别表示色素提取液在665 nm、649 nm和470 nm下的光吸收度。
试验所有指标均测定3次,结果取3次平均值。
2 结果与分析
2.1 干旱胁迫对种子萌发的影响
通过图1可以看出,PEG模拟干旱条件下,亚麻种子萌发率显著下降。PEG浓度为20%时,亚麻种子萌发率相对CK下降明显,说明亚麻种子萌发对干旱条件较为敏感。而PEG浓度为25%~30%时,亚麻种子萌发率下降幅度减缓,这一方面可能因为20%~30%区间的PEG浓度对亚麻种子萌发率影响不大,另一方面可能因为亚麻种子随着干旱胁迫程度的加大,其抗干旱能力也得到提高,这种抗干旱能力的提高显然是亚麻种子对干旱胁迫条件的有效适应。

图1 PEG模拟干旱胁迫对种子萌发率的影响
2.2 干旱胁迫对幼苗总鲜重的影响
茎叶鲜重可以体现幼苗光合能力的高低,是其生产能力的体现。从图2可以看出,在干旱胁迫下,亚麻幼苗茎叶鲜重显著下降,并且随着胁迫程度加大,幼苗鲜重下降趋势相对减缓。说明亚麻幼苗在生长过程中对干旱胁迫敏感度较高。在干旱条件下,植物会通过降低幼苗生产能力为代价来应对干旱胁迫,较小的幼苗为适应干旱胁迫,其蒸腾能力同时也会下降,这种蒸腾量的降低有利于其个体水平适合度的提高。

图2 PEG模拟干旱胁迫对茎叶总鲜重的影响
2.3 干旱胁迫对丙二醛(MDA)含量的影响
丙二醛含量与植物细胞膜透性之间极显著相关,当植物遭受渗透胁迫,造成生理性缺水时,植物体内丙二醛大量积累,因此植物体内丙二醛含量在一定程度上反映了植株体内的水分状况,进而成为植株缺水的重要参考指标。通过图3可以看出,当PEG胁迫浓度为20%时,亚麻幼苗叶片内MDA积累量相对CK显著增加,而在PEG浓度由20%增加到30%时,亚麻幼苗MDA积累量上升趋缓。这说明PEG浓度为20%条件下,亚麻幼苗相对双蒸水处理缺水严重,处于较为严重缺水状态,当PEG浓度增加时,亚麻缺水响应不够明显。

图3 PEG模拟干旱胁迫对MDA含量的影响
2.4 干旱胁迫对主根长的影响
根系大小代表其吸水能力高低,因此根系大小对水分条件也较为敏感。通常认为,在一定程度(即较低程度)干旱胁迫下,植物会通过增加根系大小以应对这种干旱条件,这是对干旱的有效适应,而在较高程度干旱胁迫下(超出根系对干旱胁迫的应答能力范围)根系大小则会下降。图4表明,在PEG浓度为20%~30%时,亚麻主根长度随着PEG浓度加大而急剧下降,说明亚麻幼苗根系对干旱胁迫敏感,较低浓度(20%)的PEG胁迫即已超出其对干旱胁迫的应答能力。但另一方面,随着PEG浓度加大,亚麻幼苗侧根数目增多(图5),这说明亚麻在高强度干旱胁迫下(PEG浓度>20%)会通过增加其侧根数目来减缓干旱对根系系统的损伤。
2.5 干旱胁迫对色素含量的影响
叶片叶绿素含量与光合作用密切相关,是作物有机营养的基础。植物缺水会抑制叶绿素的生物合成,严重缺水会加速原有叶绿素的分解。从图6可以看出,随着PEG浓度增加,亚麻幼苗色素浓度呈显著下降趋势,这说明干旱胁迫使亚麻叶片的色素含量降低,进而可能降低亚麻叶片光合能力。

图4 PEG模拟干旱胁迫对主根长的影响

图5 PEG模拟干旱胁迫对侧根数目的影响
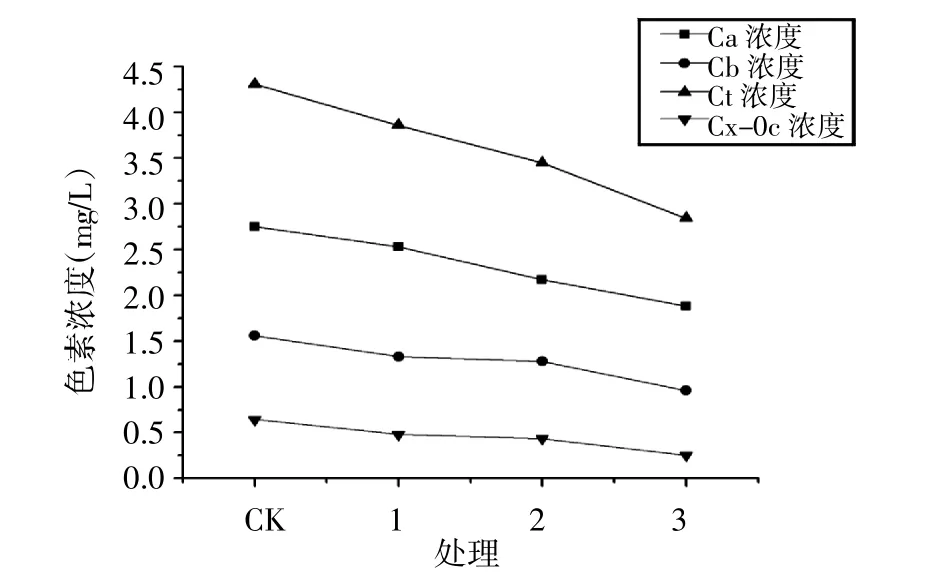
图6 PEG模拟干旱胁迫对色素含量的影响
2.6 干旱胁迫对可溶性糖的影响
可溶性糖是干旱胁迫诱导的小分子溶质之一,可参与渗透调节。逆境下植物会通过增加体内可溶性糖含量以降低植株体内的渗透势,以利于植物体在干旱逆境中维持体内正常的所需水分,保证植物植株各种代谢的正常进行,进而提高植物的抗逆性。从图7可以看出,随着PEG浓度增加,亚麻叶片内可溶性糖含量迅速增加,表明在干旱胁迫下,亚麻会通过增加体内可溶性糖含量来增强其抗旱能力。

图7 PEG模拟干旱胁迫对可溶性糖的影响
3 小结与讨论
1)干旱胁迫对亚麻种子萌发以及幼苗生长影响较大。在较低PEG浓度下(20%),亚麻种子萌发率、幼苗茎叶鲜重、主根长度、幼苗色素浓度显著下降,叶片MDA积累量显著升高,侧根数目增多,叶片内可溶性糖含量增加。随着PEG浓度增加,亚麻种子萌发率、幼苗茎叶鲜重下降趋缓,叶片MDA积累量上升趋缓,主根长度、色素浓度下降,侧根明显增多,叶片可溶性糖含量增加。
2)PEG浓度为20%的干旱胁迫下,干旱已对亚麻种子萌发和幼苗生长产生了较大影响,而随着干旱胁迫程度增加,亚麻对干旱胁迫的响应减弱,其耐受程度增加。随着PEG浓度加大,亚麻会通过增加侧根数目以及增加叶片可溶性糖含量以应对逆境,进而提高了其应对干旱胁迫的能力。
[1]SALAJ J,PETROVSKU B,OBMT B,et al.Histologicalstudyofembryo-likestructuresinitiatedfrom hypocotyl segments of flax(Linum usitatissimum L.)[J]. Plant CelI Rep,2005,24:590-595.
[2]王玉富.我国亚麻生物技术的研究现状及发展[J].中国麻业,2005,27(2):60-65.
[3]张运晖,赵瑛,罗俊杰.甘肃胡麻产业发展浅议[J].甘肃农业科技,2013(7):54-55.
[4]王玉富,周思君,刘燕,等.亚麻转基因植株的再生及生根培养的研究[J].中国麻业,2000,22(3):25-27.
[5]JAIN P,RASHID A.Stimulation of shoot regeneration on Linum hypocotyls segments by thidiazuron and its response to light and calcium[J].Biologia Plantarum,2001,44:611-633.
[6]徐云远,牛炳韬,贾敬芬.卫星搭载亚麻后代中PEG和NaC1抗性系的初步筛选[J].西北植物学报,2000,20(2):159-163.
[7]李文婷,姜丽,计巧灵,等.盐胁迫下两个亚麻品种幼苗的生理生化特性[J].生物技术,2009,19(2):26-29.
[8]胡新元,周义龙.PEG胁迫对胡麻种子萌发的影响[J].甘肃农业科技,2011(7):22-23.
(本文责编:陈伟)
Effects of PEG-simulated Drought Stress on Seed Germination and Seedling Growth of Linum usitatissium L.
LIU Feng1,HOU Qin-zheng2
(1.GansuAcademy of Agricultural Sciences,Lanzhou Gansu 730070,China;2.Northwest Normal University,Lanzhou Gansu 730070,China)
Three PEG-6000 concentrations(20%,25%and 30%)simulated drought stress were used in this study to test its influence on the seed germination and seedling growth characters of Linum usitatissium L.(Longya-8).The results showed that the seed germination rate declined rapidly at the 20%PEG concentration,and as well as the seedling total weight of stems and leaves,taproot length and the pigment concentrations,and the MDA concentration increased rapidly,indicating a serious adverse effect of drought stress at 20%PEG concentration to Linum usitatissium L.seed germination and seedling growth.Along with the rising PEG concentration,the lateral root numbers and the soluble sugar contents increased.The results indicated that Linum usitatissium L.may enhance its drought resisting ability by increasing the lateral root numbers and leaf soluble sugar contents at drought stress.
PEG drought stress;Seed germination;Seedling growth;Linum usitatissium
S563.2
A
1001-1463(2014)08-0025-04
10.3969/j.issn.1001-1463.2014.08.010
2014-05-07
国家自然科学基金(31360044)部分内容
刘风(1986—),女,甘肃宁县人,主要从事农业科研管理工作。联系电话:(0931)7611511。
侯勤正(1984—),男,山东菏泽人,副教授,主要从事植物病理学研究工作。E-mail:hou_qzh@163.com
