γ-氨基丁酸对低氧胁迫下甜瓜幼苗抗氧化酶活性及表达的影响
2014-01-16李敬蕊杨丽文王春燕高洪波吴晓蕾
李敬蕊,杨丽文,王春燕,高洪波,吴晓蕾
(河北农业大学园艺学院,河北 保定 071001)
γ-氨基丁酸对低氧胁迫下甜瓜幼苗抗氧化酶活性及表达的影响
李敬蕊,杨丽文,王春燕,高洪波*,吴晓蕾
(河北农业大学园艺学院,河北 保定 071001)
采用营养液水培方法,研究低氧胁迫下外源GABA对甜瓜幼苗抗氧化酶(SOD、POD、CAT和APX)活性和同工酶表达的影响,采用实时荧光定量PCR方法检测幼苗根系抗氧化酶的基因表达特性。结果表明,低氧胁迫处理下,幼苗根系和叶片抗氧化酶活性和同工酶表达均高于对照,且根系CmSOD、CmPOD1、CmPOD2、CmCAT、CmAPX基因均上调表达;低氧胁迫下外源GABA处理显著提高幼苗根系和叶片SOD、CAT和APX活性以及同工酶表达,且根系CmSOD、CmCAT、CmAPX基因相对表达量在0.5~1 d迅速提高并达到最大值,且增加幅度高于低氧胁迫处理。由此可知,GABA通过促进根系抗氧化酶基因快速大量表达,提高抗氧化酶活性和同工酶的表达量,从而缓解低氧胁迫对甜瓜幼苗的伤害。
γ-氨基丁酸;低氧胁迫;甜瓜;抗氧化酶活性;同工酶表达;基因表达
甜瓜(Cucumis melo)具有植株生长速度快、供应时期长、产量高、效益好等优点,已成为我国设施栽培的主要蔬菜作物之一。但是,甜瓜根系好氧性强,在土壤栽培条件下,由于土壤紧实、水分管理不当等因素造成低氧胁迫;在无土栽培过程中,营养液溶氧浓度低、消耗快、植株根垫的形成等因素也会造成根际供氧不足[1]。低氧胁迫下甜瓜根系三羧酸循环和电子传递受阻,细胞质pH降低,导致有氧呼吸减弱,无氧呼吸增强[2],植物体内活性氧含量增加,进而影响蛋白质、脂类、核酸等的功能,造成细胞非程序性死亡,从而导致甜瓜产量和品质下降。因此,栽培过程中土壤的通气状况以及营养液中的溶氧量已成为限制甜瓜产量和品质进一步提高的主要因素[3]。
γ-氨基丁酸(GABA)是一种广泛存在于各种植物和植物体各个部位的自由态四碳非蛋白质氨基酸,对增强植物体抵抗非生物胁迫[4-5]能力发挥重要作用,且植物抗性的提高与体内活性氧代谢关系极为密切。研究证明,水分胁迫下外源添加GABA可减少烟草叶片的ROS含量[6];外源GABA可通过提高玉米幼苗SOD、POD和CAT活性增强幼苗对盐胁迫的抗性;加入GABA后,通过调节大麦体内活性氧代谢,从而减缓H+和Al3+共同胁迫对大麦造成的伤害[7]。本文前期研究证明GABA增强植株抗盐[8]和抗低氧能力[9]均与体内活性氧代谢密切相关。但是,以往对逆境胁迫下外源GABA功能研究主要集中于活性氧含量和抗氧化酶活性测定,而对抗氧化酶活性、相关同工酶和酶基因表达同步研究较少。为此,本试验通过准确控制营养液溶氧量,同步研究外源GABA对低氧胁迫下甜瓜幼苗抗氧化酶活性和同工酶表达以及抗氧化酶基因表达的影响,从活性氧代谢角度深入探讨GABA提高植物低氧胁迫生理机制,为通过外源施用GABA提高植物耐低氧性提供理论依据。
1 材料与方法
1.1 材料与试验设计
试验于2012年在河北农业大学智能温室中进行。供试甜瓜品种为新疆西域集团种业有限责任公司提供的耐低氧性较弱的甜瓜“西域一号(Xiyu No.1)”。
种子经过温汤浸种消毒、催芽后,播于装有石英砂的塑料盆中,育苗期温室昼夜温度保持27~30℃/16~18℃。待子叶展开后视天气情况和植株生长情况每1~2 d浇灌1次1/2倍Hoagland营养液。当幼苗第2片真叶展平时,定植于装有1倍Hoagland营养液的水培槽中培养,用气泵正常通气。待幼苗长至四叶一心时,选取长势整齐一致的健壮幼苗80株,按照每组20株分别定植于装有18 L Hoagland营养液的塑料盆(0.6 m×0.4 m)中,进行如下处理:①对照(CK):正常通气(30 min·h-1),用气泵维持营养液溶氧浓度(DO)为8.0 mg·L-1;②正常通气+GABA处理(GA):处理当天,在正常通气的营养液中添加5 mmol·L-1GABA(Sigma公司提供);③低氧胁迫处理(HY):向营养液中通入纯净的N2,用在线溶氧分析仪(Pisco DO500型,德国)控制营养液DO值为(2±0.2)mg·L-1;④低氧胁迫+ GABA处理(HG):处理当天,在低氧胁迫的营养液中添加5 mmol·L-1GABA。
前期试验表明HG处理的甜瓜根系根长、鲜质量和干质量等生长指标显著高于低氧胁迫处理[10]。本试验于处理后4 d选取幼苗生长点下第2片完全展开的叶片及根系测定植株抗氧化酶(SOD、POD、CAT和APX)活性,并采用垂直平板聚丙烯酰胺凝胶电泳(PAGE)进行同工酶分析;于处理后0、0.5、1、2、3、4、6 d选取各处理幼苗根系,采用实时荧光定量PCR测定根系抗氧化酶基因(CmSOD、CmPOD1、CmPOD2、CmCAT、CmAPX)的表达,试验设3次重复。
1.2 测定项目与方法
1.2.1 抗氧化酶活性测定
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性分别采用Giannopoliti等[11]、曾韶西等[12]、Dhindsa等[13]和Nakano等[14]方法测定。
1.2.2 抗氧化酶同工酶酶液制备、电泳及染色
称取1.0 g各处理甜瓜幼苗的根(叶片),冰浴条件下,加入2 mL酶提取液(pH 8.0磷酸缓冲液,0.1 mol·L-1Tris-HCL),将组织研磨成匀浆状,13 000 r·min-1,4℃,离心20 min,保留上清液,上清液即为电泳样品。
采用PAGE进行各种同工酶的电泳,POD和CAT同工酶分离胶浓度为7.5%,SOD和APX同工酶分离胶浓度为10%,浓缩胶浓度均为3%。染色:超氧化物歧化酶(SOD)同工酶采用氮蓝四唑(NBT)法[15]染色、过氧化物酶(POD)同工酶采用联苯胺溶液染色法[16]染色、过氧化氢酶(CAT)同工酶采用淀粉染色法[16]染色、抗坏血酸过氧化物酶(APX)同工酶采用Mittler等方法染色[17]。
1.2.3 RNA提取及实时荧光定量PCR(real-time qPCR)分析
甜瓜根系总RNA采用TaKaRa公司的RNAiso Plus(TotalRNA提取试剂)说明书提取,之后反转录成cDNA备用。根据qPCR设计原则设计并筛选出特异性最好的引物(见表1)。首先依据天根试剂盒(SuperReal PreMix SYBR Green)说明书要求确定实时荧光定量反应体系为25 μL:cDNA模版,2 μL;正、反向引物(10 μmol·L-1)各0.75 μL;2×Super⁃Real PreMix,12.5 μL;最后加9 μL RNase-free ddH2O补充至25 μL。其次,根据引物的扩增条件设计qPCR反应条件:95℃15 min,预变性;95℃15 s变性;X℃(各对引物具体退火温度如表1所示)20 s,退火;72℃30 s,延伸;40个循环。再次,分析各样品溶解曲线,确定引物的特异性扩增。重复3次,以Actin为内参基因。最后,利用Microsoft Excel 2003软件进行数据处理并将结果(2-△△Ct)转化成线性关系,进行统计学分析。
1.3 数据处理与分析
应用Microsoft Excel 2003和SAS 8.1软件(SAS Institute,Cary,NC)进行数据处理、制图,在5%水平下采用Duncan多重比较法进行方差分析。

表1 引物设计Table 1 Primers design
2 结果与分析
2.1 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗抗氧化酶活性及同工酶表达的影响
2.1.1 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗SOD活性及同工酶表达的影响
图1A表明,培养4 d后,甜瓜幼苗根系SOD活性由高到低依次为:低氧胁迫+GABA(HG)、低氧胁迫(HY)、正常通气+GABA(GA)、对照(CK),其中低氧胁迫+GABA与低氧胁迫处理的甜瓜幼苗根系的SOD活性均显著高于正常通气+GABA(GA)和对照处理。
4个处理的甜瓜幼苗叶片SOD活性均显著低于根系,且不同处理间差异较大,其中低氧胁迫下GABA处理的SOD活性最高,其次为低氧处理,对照的SOD活性最低;4个处理间SOD活性差异达显著水平。
对处理4 d后的甜瓜幼苗根系与叶片SOD同工酶表达进行电泳检测(见图1B),分离出两条特异的、较清晰的SOD同工酶谱带S1和S2,其中S2谱带表达明显强于S1,并且S2在根系中的表达明显高于叶片。通过对SOD同工酶谱带进一步分析表明:在4个处理下根系与叶片的SOD同工酶表达与酶活性相一致,其中低氧胁迫下GABA处理的SOD同工酶表达明显强于低氧胁迫处理;在不同处理下根系SOD同工酶的表达量明显高于叶片。

图1 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗SOD活性(A)及同工酶表达(B、C)的影响Fig.1 Exogenous GABA application induced the changes of SOD activity(A)and isozymes expression(B,C)in melon seedlings under hypoxia stress
2.1.2 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗POD活性及同工酶表达的影响
从图2A可知,正常通气+GABA(GA)处理的幼苗根系POD活性低于对照(CK),差异达显著水平,而叶片POD活性与对照未达到显著差异水平;低氧胁迫(HY)处理的根系和叶片的POD活性显著高于对照(CK);低氧胁迫+GABA(HG)处理的根系和叶片的POD活性均显著低于低氧处理。不同处理下甜瓜幼苗根系的POD活性均显著高于叶片。
图2B表明,在甜瓜根系和叶片中都得到P1、P2、P3和P4四条POD同工酶条带,且处理间差异较明显。低氧胁迫处理的甜瓜幼苗根系和叶片的POD同工酶表达明显强于对照(CK);低氧胁迫+ GABA(HG)处理的根系和叶片的POD同工酶表达均明显弱于低氧处理。而且不同处理的叶片POD同工酶表达均明显强于根系。根系与叶片POD同工酶表达与酶活性相一致。
2.1.3 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗CAT活性及同工酶表达的影响
图3A表明,正常通气+GABA(GA)处理的幼苗根系和叶片CAT活性与对照(CK)均未达到显著差异水平;低氧胁迫(HY)处理的根系和叶片CAT活性显著高于对照(CK);低氧胁迫+GABA(HG)处理的根系和叶片CAT活性进一步提高,分别较低氧胁迫(HY)处理提高11.2%、22.2%,均达显著水平。不同处理下甜瓜幼苗根系CAT活性均显著低于叶片。
对甜瓜幼苗的根系和叶片CAT同工酶表达进行电泳检测,如图3B所示,在叶片和根系中均可以看到1条特异谱带。根系与叶片CAT同工酶表达与酶活性一致。低氧胁迫(HY)处理的幼苗根系和叶片CAT同工酶表达明显强于对照(CK),低氧胁迫+GABA(HG)处理的根系和叶片CAT同工酶表达明显强于其他处理。不同处理的根系CAT同工酶表达量明显低于叶片。
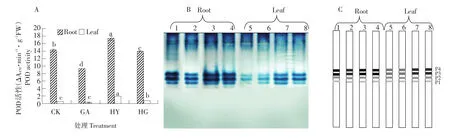
图2 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗POD活性(A)及同工酶表达(B、C)的影响Fig.2 Exogenous GABA application induced the changes of POD activity(A)and isozymes expression(B,C) in melon seedlings under hypoxia stress

图3 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗CAT活性(A)及同工酶表达(B、C)的影响Fig.3 Exogenous GABA application induced the changes of CAT activity(A)and isozymes expression(B,C)in melon seedlings under hypoxia stress
2.1.4 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗APX活性及同工酶表达的影响
由图4A可知,正常通气+GABA(GA)处理的幼苗根系和叶片APX活性与对照(CK)未达到差异显著水平;低氧胁迫处理的根系和叶片APX活性均显著高于对照(CK);低氧胁迫+GABA(HG)处理的根系和叶片APX活性显著高于低氧胁迫(HY)处理,分别较低氧胁迫(HY)处理提高11.1%、23.6%。不同处理的甜瓜幼苗根系APX活性均显著高于叶片。
甜瓜幼苗根系和叶片APX同工酶电泳检测显示(见图4B):甜瓜幼苗根系和叶片中APX同工酶条带数有明显差异,在根系中有3条特异、较清晰的APX同工酶条带。叶片中出现两条新的条带(A1和A2)。低氧胁迫下添加GABA处理的甜瓜幼苗根系和叶片APX同工酶表达最强,其次为低氧胁迫处理,两个处理明显强于对照,对照APX同工酶表达最弱。不同处理的根系APX同工酶表达均明显强于叶片。根系与叶片APX同工酶表达与APX酶活性一致。
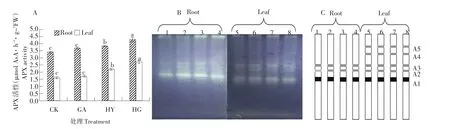
图4 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗APX活性(A)及同工酶表达(B、C)的影响Fig.4 Exogenous GABA application induced the changes of APX activity(A)and isozymes expression(B,C)in melon seedlings under hypoxia stress
2.2 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗根系抗氧化酶基因相对表达量的影响
2.2.1 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗根系CmSOD基因相对表达量的影响
结果如图5所示。

图5 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗根系CmSOD基因相对表达量的影响Fig.5 Exogenous GABA application induced the changes of relative expression of CmSOD in melon roots under hypoxia stress
图5表明,在处理的0~6 d中,对照(CK)处理的甜瓜根系CmSOD基因相对表达量无显著性差异;正常通气+GABA(GA)处理的根系CmSOD基因相对表达量与对照未达到显著性差异水平;低氧胁迫(HY)处理的根系CmSOD基因相对表达量在处理0~4 d显著高于对照(CK),并在处理第2天时达到最大值,相对表达量为对照的4.05倍;低氧胁迫下外源GABA处理CmSOD基因相对表达量呈先上升后下降趋势,在处理第1天时CmSOD相对表达量达到最大值,较低氧胁迫处理提前1 d,且上调表达量为低氧胁迫(HY)处理的1.73倍。
2.2.2 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗根系CmPOD1基因相对表达量的影响
由图6可知,在处理0~6 d中,对照(CK)处理甜瓜幼苗根系CmPOD1基因相对表达量无显著变化;正常通气条件下外源GABA处理的根系CmPOD1基因相对表达量在处理0.5 d和3~4 d显著低于对照。低氧胁迫处理的甜瓜幼苗根系CmPOD1基因相对表达量呈先上升后下降趋势,在整个处理过程中均高于其他处理,并在处理2 d时达到最大值,为CK的4.12倍;低氧胁迫+GABA(GA)处理的甜瓜幼苗根系CmPOD1基因相对表达量在0.5 d达最大值。

图6 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗根系CmPOD1基因相对表达量的影响Fig.6 Exogenous GABA application induced the changes of relative expression of CmPOD1in melon roots under hypoxia stress
2.2.3 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗根系CmPOD2基因相对表达量的影响
由图7可知,在处理的整个过程中对照(CK)的甜瓜幼苗根系CmPOD2基因相对表达量变化不大;正常通气+GABA(GA)处理第1天,甜瓜根系CmPOD2基因的相对表达量达到最大值,之后呈下降趋势,并在处理3~6 d低于对照;低氧胁迫处理的甜瓜幼苗根系CmPOD2基因相对表达量在0~4 d均显著高于对照,在第1天达到最大值,为对照的3.62倍;低氧胁迫加入外源GABA处理甜瓜CmPOD2基因的相对表达量也呈现先上升后下降趋势,在处理第0.5天达到最高,为低氧胁迫的1.23倍,差异显著,而在处理1~6 dCmPOD2基因相对表达量均显著低于低氧胁迫处理。
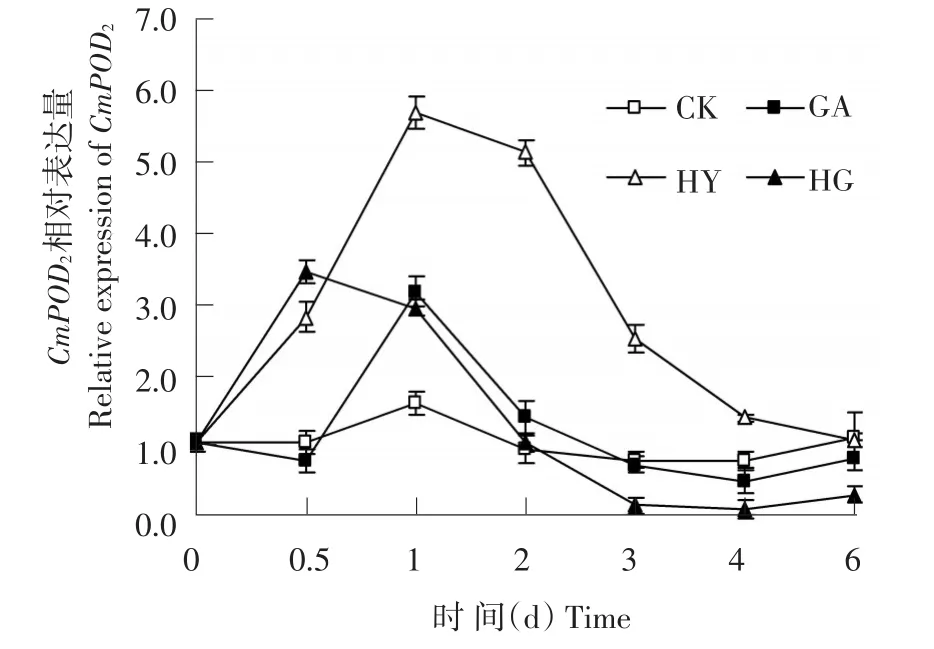
图7 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗根系CmPOD2基因相对表达量的影响Fig.7 Exogenous GABA application induced the changes of relative expression ofCmPOD2in melon roots under hypoxia stress
2.2.4 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗根系CmCAT基因相对表达量的影响
如图8所示,在处理的整个过程中,对照(CK)的甜瓜幼苗根系的CmCAT基因相对表达量无显著变化;正常通气条件下添加外源GABA处理的甜瓜幼苗根系CmCAT基因相对表达量在处理2~6 d均高于对照,并达到显著水平;低氧胁迫(HY)处理的甜瓜幼苗根系CmCAT基因相对表达量呈现先上升后下降趋势,在处理第3天达到最大值,为对照(CK)的2.92倍;低氧胁迫+GABA(HY)处理的甜瓜幼苗根系CmCAT基因相对表达量也呈先上升后下降趋势,并在处理第1天达到最大值,较低氧胁迫处理提前2 d。

图8 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗根系CmCAT基因相对表达量的影响Fig.8 Exogenous GABA application induced the changes of relative expression ofCmCATin melon roots under hypoxia stress
2.2.5 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗根系CmAPX基因相对表达量的影响
由图9可知,在处理的整个过程中,对照(CK)甜瓜幼苗根系CmAPX基因相对表达量变化较小;正常通气+GABA(GA)处理CmAPX相对表达量呈现先上升后下降趋势,在整个处理过程中CmAPX相对表达量均显著高于对照,并在第0.5天时达到最大值,为对照的2.58倍;低氧胁迫(HY)处理的甜瓜幼苗根系CmAPX基因相对表达量先呈现上升趋势,在处理第3天时达到最大值,然后逐渐降低;低氧胁迫下GABA处理CmAPX基因在0.5~1 d时显著高于低氧胁迫处理,并在第0.5天时达到最大值,为低氧胁迫的3.34倍。
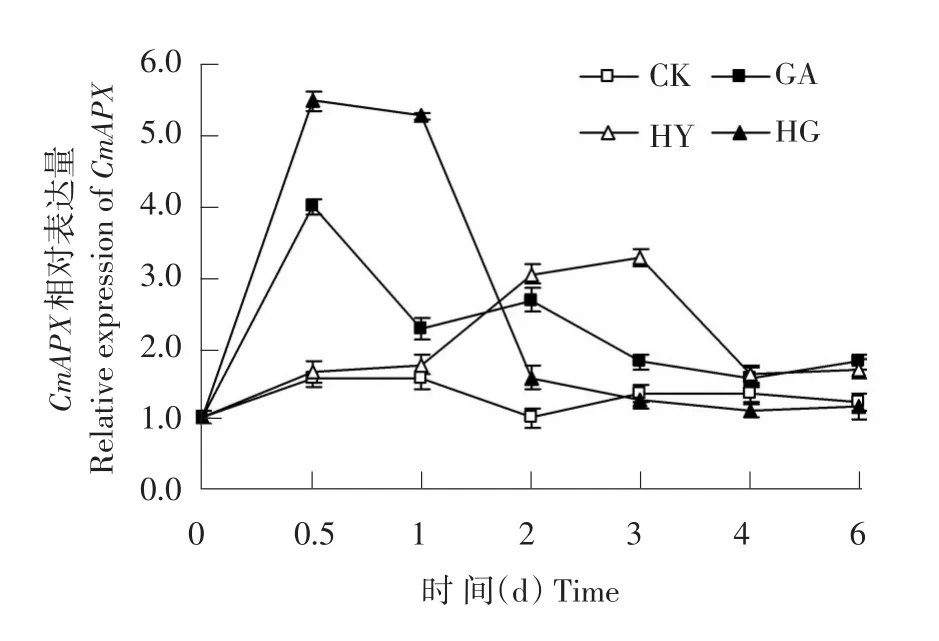
图9 外源γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗根系CmAPX基因相对表达量的影响Fig.9 Exogenous GABA application induced the changes of relative expression ofCmAPXin melon roots under hypoxia stress
3 讨论与结论
低氧胁迫使植物叶绿体和线粒体的电子传递链断裂,无法合成ATP,造成细胞内能荷低、还原力增高,植物体内活性氧产生与清除的动态平衡遭到破坏,使细胞中产生大量活性氧(ROS)[18],导致核酸、蛋白质等生物大分子及膜系统过氧化反应,损伤植物细胞。为减轻低氧逆境伤害,植物会通过体内低氧信号转导系统,使细胞对氧浓度降低作出快速感应,通过启动或调节相关酶基因表达、调节特异蛋白合成适应不利环境,其中植物细胞内酶促和非酶促活性氧自由基清除系统能有效清除这些有害过氧化物[19]:SOD可将在低氧胁迫下产生的O2-歧化为H2O2和O2,由此产生的H2O2可在POD和CAT的作用下分解为对植物生长无害的H2O和O2,阻止膜质过氧化进程[20];在APX作用下植物体内抗氧化物质AsA也可将H2O2清除[21]。
陆晓民等研究表明,低氧胁迫下,植物根系、叶片SOD、POD等抗氧化酶活性升高,使过氧化氢等活性氧含量降低,从而缓解低氧胁迫对黄瓜[22]、八棱海棠[23]等植物的伤害。进一步研究证明,活性氧代谢与品种耐低氧性密切相关,低氧胁迫下,耐性较强的黄瓜品种“绿霸春4号”抗氧化酶活性高于抗低氧能力较弱的品种“中农8号”[24]。本试验结果表明,与对照处理相比,低氧胁迫下,甜瓜根系CmSOD、CmPOD1、CmPOD2、CmCAT和CmAPX基因均上调表达,且在0~4 d表现比较明显;同时,低氧胁迫后4 d,甜瓜幼苗根系和叶片抗氧化酶(SOD、POD、CAT、APX)活性明显增加,且抗氧化酶同工酶表达明显加强,表现为同工酶图谱中的一条或多条条带宽度增加或条带亮度增加,甜瓜根系抗氧化酶基因表达与抗氧化酶活性、同工酶表达一致。表明低氧胁迫诱导甜瓜体内抗氧化酶相关基因的上调表达,通过启动细胞内酶促和非酶促活性氧自由基清除系统,诱导抗氧化酶活性和同工酶表达增强,从而增强幼苗对低氧的耐性。植物不同部位抗氧化酶活性存在差异,其中根系SOD、POD和APX活性明显高于叶片,而叶片CAT活性明显高于根系。
GABA在各种植物及植物的各个器官中广泛存在,是细胞游离氨基酸库的重要组成成分,Shelp等研究表明,GABA在植物体内信号传递过程中起“第二信使”的作用,可以通过参与活性氧代谢、调节胞质pH等途径增强植物对逆境胁迫的抗性[25]。Ludewig等研究表明,低氧等逆境胁迫下植物体内GABA含量可增加几倍至几十倍,而GABA支路受阻会削弱线粒体的呼吸作用,使拟南芥突变体清除H2O2自由基的能力减弱,导致活性氧大量积累[26]。低氧胁迫下,O2缺乏,正常有氧呼吸受到抑制,植物将启动无氧呼吸代谢,从而导致植物细胞质酸化[27],谷氨酸脱羧酶的活性被激活,细胞内GABA合成加快,此过程需要消耗大量H+。因此,可以缓解低氧胁迫对植物造成的伤害。进一步研究证明外源GABA作为一种小分子氨基酸态氮,可被甜瓜根系直接吸收,而且低氧胁迫下幼苗根系对GABA吸收速率显著高于正常通气下添加GABA处理的甜瓜吸收速率[28]。Ricardo等研究表明,低氧胁迫下,GABA促进葡萄VvCAT2基因表达,而VvAPX、VvGLPX、VvSOD、VvCAT1基因下调表达[29]。本试验结果表明,低氧胁迫+GABA(HG)处理的甜瓜根系CmSOD、CmCAT、CmAPX基因相对表达量在0.5~1 d时间段内达到最大值,并显著高于低氧胁迫处理,而且在时间上优先于低氧胁迫1~2.5 d;幼苗SOD、CAT、APX活性及同工酶表达均明显高于低氧处理,与CmSOD、CmCAT、CmAPX基因变化水平一致。表明低氧胁迫下添加外源GABA可通过促使根系抗氧化酶基因表达水平上调,从而使幼苗SOD、CAT、APX活性和同工酶表达增强。而低氧胁迫下加入外源GABA处理甜瓜根系CmPOD1、CmPOD2基因相对表达量低于低氧胁迫处理的甜瓜根系,POD活性、同工酶表达与甜瓜根系CmPOD1和CmPOD2基因表达一致,均明显低于低氧胁迫处理,推测可能是由于CAT、APX与POD均以H2O2作为底物,三者存在竞争关系,但是CAT、APX与H2O2的结合效率高于POD[20],底物浓度降低可能导致POD活性降低。
综上所述,甜瓜幼苗根系CmSOD、CmPOD1、CmPOD2、CmCAT、CmAPX基因表达变化与SOD、POD、CAT、APX活性和同工酶表达变化一致。低氧胁迫下,甜瓜幼苗根系CmSOD、CmPOD1、CmPOD2、CmCAT、CmAPX基因表达水平上调,根系和叶片的SOD、POD、CAT和APX活性、同工酶表达增强;低氧胁迫下,外源添加GABA可以在转录水平上调控甜瓜抗氧化酶基因表达,根系CmSOD、CmCAT、CmAPX基因表达显著高于低氧胁迫处理,而且其相对表达量在0.5~1 d时达到最高,在时间上优先于低氧胁迫1~2.5 d,有效减缓低氧胁迫对甜瓜幼苗的伤害。
[1]Biais B,Beauvoit B,Allwood J W,et al.Metabolic acclimation to hypoxia revealed by metabolite gradients in melon fruit[J].Plant Physiology,2010,167(3):242-245.
[2]孙艳军,郭世荣,胡晓辉,等.根际低氧逆境对网纹甜瓜幼苗生长及根系呼吸代谢途径的影响[J].植物生态学报,2006,30(1): 112-117.
[3]郭世荣,橘昌司,李谦盛.营养液温度和溶解氧浓度对黄瓜植株氮化合物含量的影响[J].植物生理与分子生物学学报, 2003,29(6):593-596.
[4]Yang R,Guo Q,Gu Z.GABA shunt and polyamine degradation pathway onγ-aminobutyric acid accumulation in germinating fa⁃va bean(Vicia fabaL.)under hypoxia[J].Food Chemistry,2013, 136(1):152-159.
[5]Kim D W,Shibato J,Agrawal G K,et al.Gene transcription in the leaves of rice undergoing salt-induced morphological changes (Oryza sativaL.)[J].Molecules Cells,2007,24(1):45-59.
[6]Liu C,Zhao L,Yu G.The dominant glutamic acid metabolic flux to produceγ-amino butyric acid over proline inNicotiana tabacumleaves under water stress relates to its significant role in antioxi⁃dant activity[J].Integrative Plant Biology,2011,53(8):608-618.
[7]Song H,Xu X,Wang H,et al.Exogenous gamma-aminobutyric acid alleviates oxidative damage caused by aluminium and proton stresses on barley seedlings[J].Science of Food and Agriculture, 2010,90(9):1410-1416.
[8]罗黄颖,高洪波,夏庆平,等.γ-氨基丁酸对盐胁迫下番茄活性氧代谢及叶绿素荧光参数的影响[J].中国农业科学,2011,44 (4):753-761.
[9]高洪波,郭世荣.外源γ-氨基丁酸对营养液低氧胁迫下网纹甜瓜幼苗抗氧化酶活性和活性氧含量的影响[J].植物生理与分子生物学学报,2004,30(6):651-659.
[10]宋锁玲,李敬蕊,高洪波,等.γ-氨基丁酸对低氧胁迫下甜瓜幼苗氮代谢及矿质元素含量的影响[J].园艺学报,2012,39(4): 695-704.
[11]Giannopolitis C N,Ries S K.Purification and quantitative rela⁃tionship with water-soluble protein in seedling[J].Plant Physiolo⁃gy,1977,59:315-318.
[12]曾韶西,王以柔,刘鸿先.低温光照下与黄瓜子叶叶绿素降低有关的酶促反应[J].植物生理学报,1991,17(2):177-182.
[13]Dhindsa R S,Plumb-dhindsa P,Thorpe T A.Leaf senescence cor⁃related with increase levels of membrane permeability and lipid peroxidation and decrease levels dismutase and catalase[J].Exper⁃imental Botany,1982,32:91-101.
[14]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascor⁃bate specific peroxidase in spinach chloroplasts[J].Plant Cell Physiology,1981,22:867-880.
[15]胡能书,万贤同.同工酶技术及其应用[M].长沙:湖南科技出版社,1985.
[16]邹琦.植物生理学指导[M].北京:中国农业出版社,2000.
[17]Mittler R,Zilinskas B A.Detection of APX activity in native gels by inhibition of the ascorbate dependent reduction of NBT[J].An⁃alytical Biochemistry,1993,212(2):540-546.
[18]Blokhima O B,Virolainen E,Fagetstedt K V,et al.Antioxidant status of anoxia-tolerant and intolerant plant species under anox⁃ia and reaetation[J].Physiologia Plantanm,2000,109:396-403.
[19]Blokhina O,Virolainen E,Fagerstedt K V.Antioxidants,oxidative damage and oxygen deprivation stress:A review[J].Annals of Bot⁃any,2003,91(1):179-194.
[20]Biemelt S,Keetman U,Albrecht G.Re-aeration following hypox⁃ia or anoxia leads to activation of the antioxidative defense system in roots of wheat seedlings[J].Plant Physiology,1998,116(2):651-658.
[21]Asada K.Ascorbate peroxidase-a hydrogen peroxide-scavenging enzymeinplants[J].PhysiologiaPlantarum,1992,85(7):235-241.
[22]陆晓民,孙锦,郭世荣,等.油菜素内酯对低氧胁迫黄瓜幼苗根系线粒体抗氧化系统及其细胞超微结构的影响[J].园艺学报, 2012,39(5):888-896.
[23]白团辉,马锋旺,李翠英,等.水杨酸对根际低氧胁迫八棱海棠幼苗活性氧代谢的影响[J].园艺学报,2008,35(2):163-168.
[24]李璟,胡晓辉,郭世荣,等.外源亚精胺对根际低氧胁迫下黄瓜幼苗根系多胺含量和抗氧化酶活性的影响[J].植物生态学报, 2006,30(1):118-123.
[25]Shelp B J,Mullen R T,Waller J C.Compartmentation of GABA metabolism raises intriguing quertions[J].Trends in Plant Sci⁃ence,2012,17(2):57-59.
[26]Ludewig F,Hüser A,Fromm H,et al.Mutants of GABA transami⁃nase(POP2)suppress the severe phenotype ofsuccinic semialde⁃hyde dehydrogenase(ssadh)mutants inArabidopsis[J].PloS ONE, 2008,3(10):3383-3394.
[27]Crawford L A,Bown A W,Breitkreuz K E,et al.The synthesis ofγ-aminobutyric acid in response to treatments reducing cytosolic pH[J].Plant Physiology,1994,104:865-871.
[28]夏庆平,高洪波,李敬蕊.γ-氨基丁酸(GABA)对低氧胁迫下甜瓜幼苗光合作用和叶绿素荧光参数的影响[J].应用生态学报, 2011,22(4):999-1006.
[29]Ricardo V,Francisca P,Sebastián R,et al.Hypoxia induces H2O2production and activates antioxidant defence system in grapevine buds through mediation of H2O2and ethylene[J].Experimental Botany,2012,63(11):4123-4131.
Effectofγ-aminobutyricacidonactivitiesandexpressionof antioxdative enzyme in melon seedlings under hypoxia stress
/LI Jingrui, YANG Liwen,WANG Chunyan,GAO Hongbo,WU Xiaolei
(School of Horticulture,Agricultural University of Hebei,Baoding Hebei 071001,China)
This paper investigated the effects of exogenous γ-aminobutyric acid on antioxdative enzyme(SOD,POD,CAT and APX)activities and isozyme expression of melon seedlings under hypoxia stress with hydroponics culture.Meanwhile the characteristics of antioxdative enzyme gene expression of melon seedlings roots were detected by the real-time fluorescent quantitative(RT-PCR).The results showed that the antioxdative enzyme activities and isozyme expression in melon seedlings roots and leaves were higher under hypoxia stress than those under normoxic treatment(control)as well as the gene expression ofCmSOD,CmPOD1,CmPOD2,CmCAT,CmAPXin melon roots were up-regulated.Exogenous GABA application under hypoxia stress could significantly increased the activities and isozyme expression of SOD,CAT and APX in seedlings roots and leaves.Futhermore,the gene expression levels ofCmSOD,CmCAT,CmAPXin roots rapid increased and reached the maximum value after 0.5-1 d with GABA application under hypoxia stress,that increasing extent higher than hypoxia stress treatment.The results suggested that exogenous GABA alleviated the harm of hypoxia tolerance in melon seedlings by promoting rapidly and largely antioxdative enzyme gene expression as well as increasing antioxdative enzyme activities and isozyme expression in melon seedlings.
γ-aminobutyric acid;hypoxia stress;melon;antioxdative enzyme activity;isozyme expression;gene expression
S642.2
A
1005-9369(2014)11-0028-09
2014-06-19
国家自然科学基金项目(30900994)
李敬蕊(1979-),女,讲师,硕士研究生,研究方向为设施园艺植物栽培与育种。E-mail:yyljr@hebau.edu.cn *通讯作者:高洪波,教授,硕士生导师,研究方向为设施园艺与无土栽培。E-mail:gaohb@hebau.edu.cn
时间2014-11-21 16:39:22[URL]http://www.cnki.net/kcms/detail/23.1391.S.20141121.1639.007.html
李敬蕊,杨丽文,王春燕,等.γ-氨基丁酸对低氧胁迫下甜瓜幼苗抗氧化酶活性及表达的影响[J].东北农业大学学报,2014,45 (11):28-36.
Li Jingrui,Yang Liwen,Wang Chunyan,et al.Effect ofγ-aminobutyric acid on activities and expression of antioxdative enzyme in melon seedlings under hypoxia stress[J].Journal of Northeast Agricultural University,2014,45(11):28-36.(in Chinese with English abstract)
