烟草根际放线菌的分离及酶活性和功能基因检测
2014-01-14曹毅陆宁陈兴江郭玉双夏海乾商胜华
曹毅,陆宁,陈兴江,郭玉双,夏海乾,商胜华
(贵州省烟草科学研究院,贵阳 550081)
烟草根际放线菌的分离及酶活性和功能基因检测
曹毅,陆宁,陈兴江,郭玉双,夏海乾,商胜华*
(贵州省烟草科学研究院,贵阳 550081)
从云南、贵州、河南等地采集29份烟草健田土壤样品,采用4种土壤预处理方法及4种培养基分离得到607株放线菌。利用平板透明圈法对42株代表性放线菌进行了蛋白酶、几丁质酶、纤维素酶和淀粉酶活性检测;采用特异性引物扩增法,筛选其聚酮合酶(PKS-Ⅰ、PKS-Ⅱ)基因和非核糖体多肽合成酶(NRPS)基因。对4株菌进行16S rDNA初步分类鉴定。结果表明,供试42株放线菌中四种酶活性的初筛阳性率为54.8%~90.5%;其中4株放线菌含三种化合物合成基因,16S rRNA序列测定4株菌均属链霉菌。
烟草;根际;放线菌;酶活性;化合物合成基因
放线菌可产生抗生素、酶及其抑制剂等多种生物活性物质,目前使用的抗生素中2/3来源于放线菌,在农林生产和临床医药上具有很大应用价值[1-2]。土壤是放线菌的天然栖居场所,从中挖掘有生物活性的放线菌资源是研究重点。植物根系在生长过程中向根际区域释放多种分泌物,植物根际土壤与主体土壤不同,研究表明,根际区域微生物在数量上要比非根际区域微生物多19~32倍[3],根际放线菌产生抗菌物质和其他活性物质的比例也显著高于非根际土壤来源的放线菌[4],因此从植物根际土壤中分离放线菌有重要意义。
目前对植物根际放线菌系统研究不多,主要集中在药用植物及一些特殊生境植物[5-6],本研究选择烟草根际土壤作为对象,运用选择性分离方法从我国主要烟草种植区健康烟田的根际土壤中分离放线菌,结合产酶活性检测和重要次生代谢产物合成基因筛选,获得有应用开发潜力菌株,并对有价值的菌株进行分子生物学初步鉴定,为植物根际放线菌深入研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 土壤样品
2012 年从云南、贵州、河南等地健康烟田烟草根际采集土样29份。每份样品分别取5~20 cm深5个穴的土壤混合,置于无菌封口袋,运抵实验室后于室温下自然风干3周后,进行放线菌纯培养分离。
1.1.2 主要试剂和仪器
溶菌酶、蛋白酶K购自sigma公司,DNA Marker及PCR相关试剂购自宝生物工程(大连)有限公司,引物合成及其余试剂购自上海生工生物工程技术服务有限公司;PCR仪、电泳仪、凝胶成像仪购自Bio-Rad公司。
1.1.3 供试培养基
采用四种分离培养基:几丁质培养基(Chitinagar)、腐植酸培养基(HV)、脯氨酸琼脂培养基(WA)和改良淀粉脯氨酸琼脂培养基(MSG)。所有培养基灭菌后均加入萘啶酮酸25 mg·mL-1,重铬酸钾50 mg·mL-1,放线菌酮25 mg·mL-1以抑制细菌和真菌的生长;酶活性检测基础培养基:KH2PO40.3 g、K2HPO40.7g、Mg2SO40.5 g、FeSO40.01g,蒸馏水1 000 mL,pH 7.0。
1.2 放线菌分离方法
采用1%酚液、0.05%SDS溶液[7]、10 mmol·L-1MOPS(含0.1%未灭菌脱脂牛奶)[4]和CaCO3[8]对土样进行预处理,处理后的土样采用稀释法涂布平板,28℃培养,7、14、21、28 d观察并挑取不同形态、颜色的放线菌菌落备用。
1.3 放线菌产酶活性检测
参见文献[9-10]方法检测代表性放线菌的蛋白酶、淀粉酶、纤维素酶和几丁质酶活性。
1.4 活性化合物合成基因阳性菌的筛选
菌株基因组DNA的小量提取提取采用Li等[11]的方法进行。PKSⅠ、PKSⅡ、NRPS基因检测的引物和扩增条件参照文献[12-13]进行。扩增产物用1.0%的琼脂糖凝胶电泳检测。
1.516 S rRNA基因序列测定
采用细菌16S rRNA序列通用引物(27f:5' AGAGTTTGATCCTGGCTCAG 3';1492r:5'GGTTA CCTTGTTACGACTT-3')扩增放线菌16S rRNA序列,扩增产物经琼脂糖凝胶电泳检测后送交北京诺赛基因组中心有限公司进行测序。
2 结果与分析
2.1 放线菌分离结果
从云南、贵州、河南等我国主要烟草种植区采集健康烟田根际土壤29份,采用4种土壤预处理方法和4种分离培养基,经过纯化及去重复后获得607株放线菌。本研究借鉴部分分离土壤放线菌方法对烟草根际土壤放线菌进行筛选分离,就土壤预处理方法比较而言,CaCO3法共分离出217株放线菌,占分离菌株的35.7%;酚液处理分离出120株放线菌,占分离菌株的19.8%;MOPS法分离出109株放线菌,占分离菌株的18.0%;SDS法分离出161株放线菌,占分离菌株的26.5%。从所使用的培养基来看,WA、CA、HV、MSG筛选得到的放线菌分别为199、161、164、83株。
2.2 产酶活性菌株筛选
根据分离菌株在培养基上的培养特征,各菌株进行初步归类,挑选42株代表性菌株采用平板透明圈法进行蛋白酶、淀粉酶、纤维素酶和几丁质酶4种酶活性进行检测(见表1)。结果表明,供试的42株放线菌中,有27株(64.3%)具有蛋白酶活性,23株(54.8%)具有几丁质酶活性,38株(90.5%)具有淀粉酶活性,36株(85.7%)具有纤维素酶活性;有18株菌同时产3种酶,11株菌同时产4种酶。
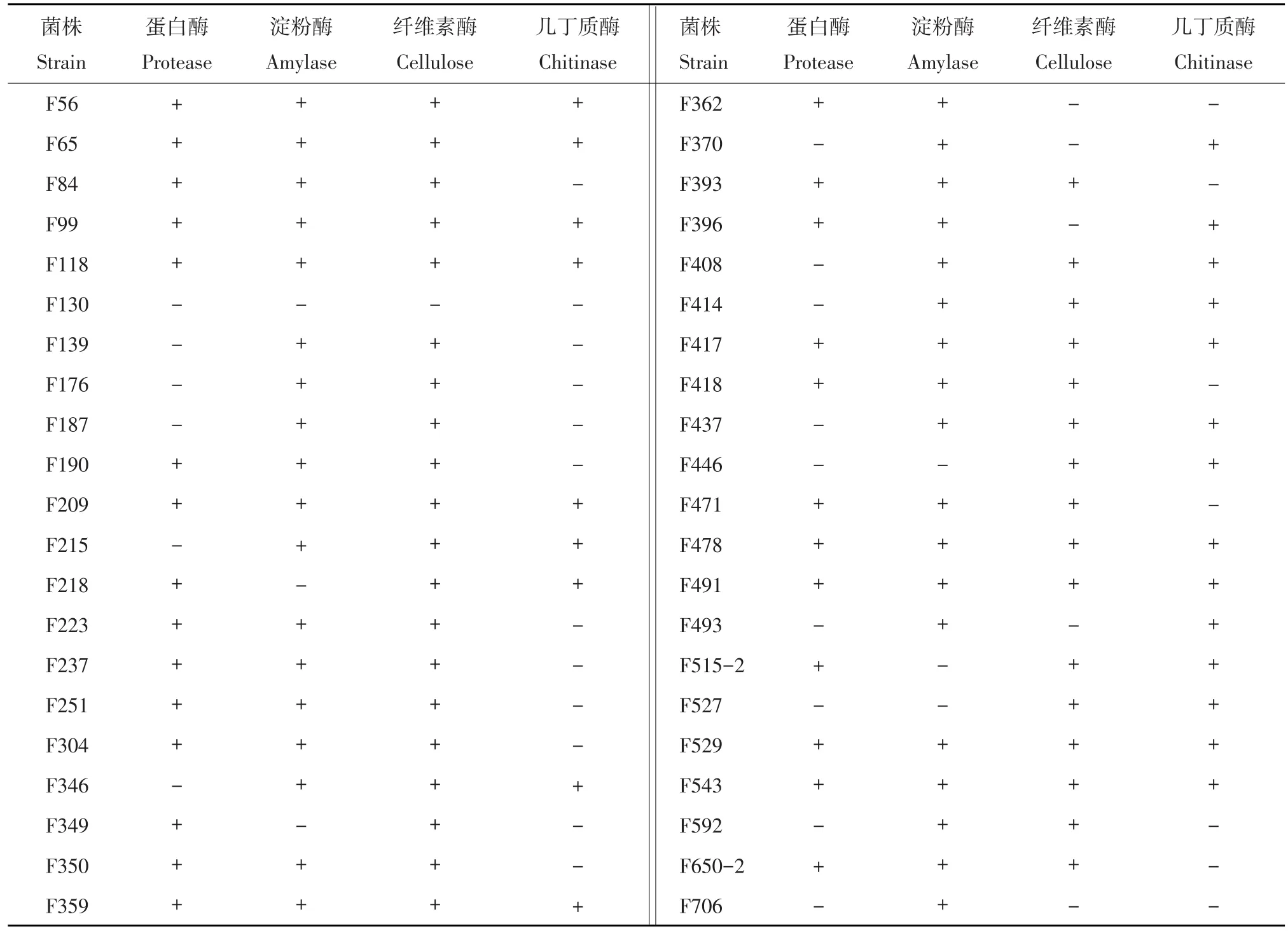
表1 酶活性检测结果Table 1 Results of enzyme screening experiment
2.3 化合物合成基因筛选
3种化合物合成基因的筛选结果见图1、2。42个菌株中,NRPS基因筛选呈阳性的占到73.8%(31株),PKS-Ⅱ基因筛选呈阳性的菌株占66.7%(28株),PKS-Ⅰ基因的阳性扩增率为21.4%(9株),3类化合物合成基因筛选呈阳性的菌株有4株,占总数的9.5%。这些结果显示,前2种基因的阳性菌在所选择的42株菌中广泛存在。

图1 3种化合物合成基因筛选的电泳Fig.1 PCR products of three genes
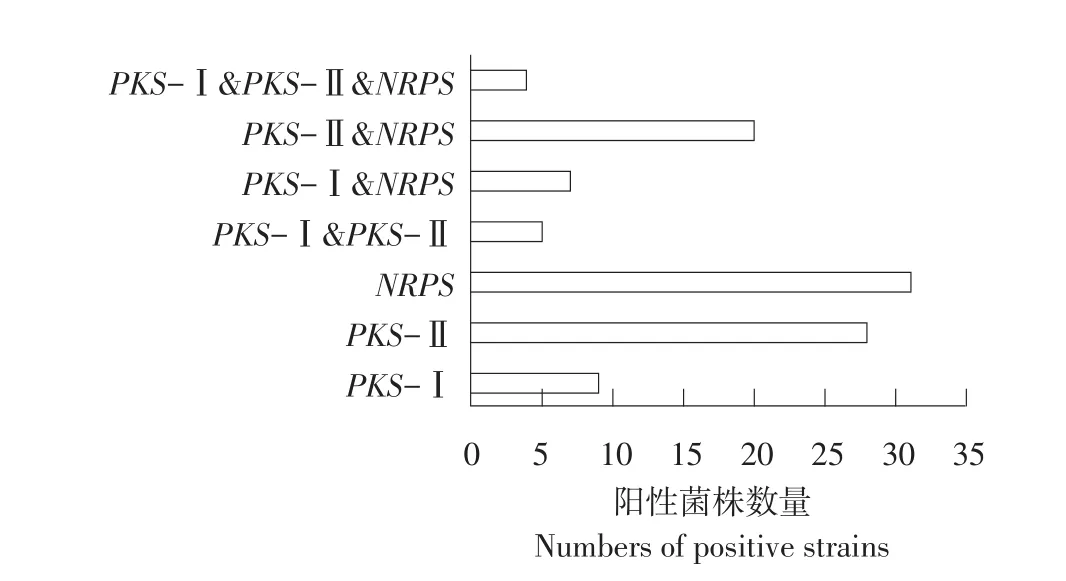
图2 PKS-Ⅰ,PKS-Ⅱ和NRPS基因筛选阳性菌株数量Fig.2 Numbers of isolates shown positive results in PKS-Ⅰ,PKS-Ⅱand NRPS genes screening
2.4 菌株的分子生物学初步鉴定
对3种化合物合成基因筛选均为阳性的4株菌进行16S rRNA测序,用Blast程序从Genebank等公共数据库中进行相似性搜索,调出相似性最高的相关菌株的16S rRNA序列,通过分析,构建系统发育树。
结果表明,4株菌均为链霉菌,其中菌株F370与暗灰链霉菌(Streptomycescanus)发育关系最近,F176与教酒链霉菌(Streptomyces chartreusis)发育关系最近;F478与芬氏链霉菌(Streptomycesfinlayi)发育关系最近,F471与灰平链霉菌(Streptomyces gris⁃eoplanus)发育关系最近。结果见图3。

图3 研究菌株及其从Genebank中调集的相关种以16S rRNA基因序列构建的系统进化树Fig.3 Phylogenetic tree showing the relationships among reference strains and the isolates based on 16S rRNA gene sequences.
3 讨论与结论
在烟草根际微生态环境中生长的微生物,受烟草根系分泌物的影响,可能产生从非根际放线菌中未曾挖掘和发现的活性物质。目前,系统研究烟草根际来源放线菌的研究不多,本研究采用
4种土壤预处理方法及4种选择性分离培养基组合从我国主要植烟区的烟田根际土壤中分离、纯化得到607株放线菌,从初步形态分类看,分离得到的放线菌种类较多,表明烟草根际放线菌具有多样性,是值得深入研究和挖掘的微生物资源。
酶制剂由于其高效、专一特点,在工业、农业领域具有广泛用途,微生物是目前酶工业中主要材料和反应器。不同来源放线菌是筛选和获取酶重要资源之一,本研究筛选放线菌的蛋白酶、几丁质酶菌株在农业生物防治领域具有潜在应用价值,淀粉酶、纤维素酶在工业生产中具有应用价值。供试的11株菌(26.1%)同时具有4种酶活性,从初筛结果来看,烟草根际放线菌具有广泛酶活性。
生物活性物质合成基因筛选,可作为快速评估细胞产生某类代谢物的可能性及在基因水平产生生物活性物质的能力,国外已将其作为发现新药先导物的一种有效手段[14-16]。聚酮类化合物(polyketide)和非核糖体肽类(non-ribosomal pep⁃tides)是自然界中存在的两类重要天然产物。目前已知的聚酮化合物超过1 000种,大多具有抗病原生物、抗病毒、抗肿瘤等活性,其形成的药物几乎已用于所有疾病的治疗且已广泛应用于医药、农业、畜牧业和工业[17];非核糖体肽(NRPs)是微生物通过非核糖体途径、由非蛋白质组成氨基酸参与及多种肽链后修饰作用合成的具有广泛生物活性化合物。本研究对烟草根际放线菌产两类化合物的关键合成酶基因进行筛选,获得了4株同时产含3种化合物合成基因的链霉菌,可为进一步研究开发提供材料。
[1]Bérdy J.Bioactive microbial metabolites,a personal review[J].J Antibiot,2005,58:1-26.
[2]高爱丽,王相晶,向文胜,等.吸水链霉菌新种的筛选和鉴定[J].东北农业大学学报,2007,38:361-364.
[3]Bodelier P L E,Wijlhuizen A G,Blom C W P M,et al.Effects of photoperiod on growth of and denitrification by Pseudomonas chlo⁃roraphisin the root zone of Glyceriamaχima,studied in a gnotobiot⁃ic microcosm[J].Plant Soil,1997,190:91-103.
[4]Basil A J,Strap J L,Knotek-Smith H M,et al.Studies on the mi⁃crobial populations of the rhizosphere of big sagebrush(Artemis⁃ia tridentata)[J].JIndMicrobiolBiotechnol,2004,31(6):278-88.
[5]袁丽杰,章广玲,张玉琴,等.药用植物根际放线菌的种群多样性及生物活性初步研究[J].中国抗生素杂志,2009,34:463-466.
[6]庹利,旭格拉·哈布丁,郭琳,等.罗布泊地区沙生植物根际放线菌多样性及生物活性的研究[J].中国抗生素杂志,2012,37: 21-26.
[7]Suzuki Si,Okuda T,Komatsubara S.Selective isolation and dis⁃ tribution of sporichthya strains in soil[J].Appl Enviro Microbiol, 1999,65:1930-1935.
[8]Natsume M,Yasui K,Marumo S.Calcium ion regulates aerial my⁃celium formation in actinomycetes[J].J Antibiot(Tokyo),1989, 42:440-447.
[9]Shirling E B,Gottlieb D.Methods for characterization of Strepto⁃myces species[J].International Journal of Systematic Bacteriology, 1966,16:313-340.
[10]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[11]Li WJ,Xu P,Schumann P,et al.Georgeniaruanii sp.nov.,anovel actinobacterium isolated from forest soil in Yunnan(China),and emended description of the genus Georgenia[J].Int J Syst Evol Mi⁃crobioy,2007,57:1424-1428.
[12]Ketela M M,Virpi S,Halo L,et al.An efficient approach for screening minimal PKS genes from Streptomyces[J].FEMS Micro⁃biolLett,1999,180:1-6.
[13]Ayuso-Sacido A,Genilloud O.New PCR primers for the screen⁃ing of NRPS and PKS-I systems in actinomycetes:Detection and distribution of these biosynthetic gene sequences in major taxo⁃nomic groups[J].MicrobEcol,2005,49:10-24.
[14]Mikko M K,Laura H,Eveliina M,et al.Molecular evolution of aromatic polyketides and comparative sequence analysis of polyketideketosynthase and 16S ribosomal DNA genes from vari⁃ous streptomyces species[J].Appl Environ Microbiol,2002,68: 4472-4479.
[15]Liu W,Ahlert J,Gao Q,et al.Rapid PCR amplification of minimalenediynepolyketide synthase cassettes leads to a predictive fa⁃milial classification model[J].Proc Natl Acad Sci,2003,100(21): 11959-11963.
[16]Zazopoulos E,Huang K,Staffa A,et al.A genomics-guided ap⁃proach for discovering and expressing cryptic metabolic pathways [J].Nat Biotechnol.2003,21(2):187-190.
[17]陈代杰.微生物药学[M].上海:华东理工大学出版社,1999.
CAO Yi,LU Ning,CHEN Xingjiang,GUO Yushuang, XIAHaiqian,SHANG Shenghua(Guizhou Academy of Tobacco Science,Guiyang 550081,China)
Using 4 soil pretreatment method and 4 medium,we isolated 607 strains of actinomycetes from 29 tobacco rhizosphere soil samples collected from Yunnan,Guizhou and Henan.The protease, chitinase,cellulase and amylase activity of 42 representative strains were tested byclarity circle method on plate.Genes encoding typeⅠandⅡpolyketide synthases(PKS-Ⅰ,PKS-Ⅱ),nonribosomal peptide synthase (NRPS)were screened by PCR.Four isolates were preliminary classified by its 16S rRNA gene sequences. The 42 tested strains of actinomycetes showed different enzyme activities.There were four strains showed positive results for PKS(typeⅠandⅡ)and NRPS genes screening,the four strains belongs to Streptomyces according to 16S rRNA sequence analysis.
tobacco;rhizosphere;actinomycete;enzyme activity;synthesis gene of secondary metabolite
S767.5;X172
A
1005-9369(2014)02-0019-05
2012-10-24
贵州省科学技术基金(黔科合J字[2012]2257号);中国烟草总公司贵州省公司科技计划项目(200916、201022)
曹毅(1982-),男,助理研究员,硕士,研究方向为微生物、植物保护。E-mail:yicao1001@163.com
商胜华,副研究员,研究方向为植物保护。E-mail:ssh6688@sina.com
时间2014-1-17 16:42:01[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140117.1642.017.html
曹毅,陆宁,陈兴江,等.烟草根际放线菌的分离及酶活性和功能基因检测[J].东北农业大学学报,2014,45(2):19-23.
Cao Yi,Lu Ning,Chen Xingjiang,et al.Enzyme activity and functional genes detection of actinomycetes isolated from tobaccorhizosphere[J].Journal of Northeast Agricultural University,2014,45(2):19-23.(in Chinese with English abstract)
Enzyme activity and functional genes detection of actinomycetes isolated from tobaccorhizosphere
