植物和微生物合成2-苯乙醇的研究进展
2014-01-13黄友和杨尚彤周志强刘玉姮姜兴涛
黄友和, 杨尚彤, 周志强, 熊 娟, 陈 洪, 刘玉姮, 姜兴涛,*
(1.波顿(上海)香料科技有限公司,上海 201201;2.深圳波顿香料有限公司,广东深圳 518051)
植物和微生物合成2-苯乙醇的研究进展
黄友和1, 杨尚彤1, 周志强1, 熊 娟1, 陈 洪1, 刘玉姮2, 姜兴涛2,*
(1.波顿(上海)香料科技有限公司,上海 201201;2.深圳波顿香料有限公司,广东深圳 518051)
2-苯乙醇是一种有广泛用途的香味物质,对其他香味在食品、烟草和化妆品等日化产品有增效作用.介绍了目前2-苯乙醇在植物和微生物中的代谢机理和最新研究进展,并对其研究前景进行了展望.
2-苯乙醇;植物;微生物
2-苯乙醇是一种具有类似玫瑰花香的挥发性无色液体.自然界中2-苯乙醇主要存在于裸子植物和被子植物及其提取的精油中.全球2-苯乙醇年产量近万吨,基本采用化学合成法生产.2011年Hua Dongliang等[1]提到化学合成的2-苯乙醇国际市场价格为5美元/kg,近期未见关于天然2-苯乙醇的市场价格的报道,2002年其价格已高达1 000美元/kg以上.单纯的植物提取法已无法满足人们对天然2-苯乙醇的需求,研究合成2-苯乙醇产量较高的植物及微生物的代谢机理,提高2-苯乙醇的产量已经成为研究热点.
1 植物转化合成2-苯乙醇的研究现状
目前对植物中2-苯乙醇合成机制的研究尚处于起步阶段,且主要集中在美国、日本等国家.
1.1 2-苯乙醇在番茄中的合成途径研究
Tieman等[2]通过同位素示踪法(即用13C标记苯丙氨酸)确定了在番茄中2-苯乙醇的合成途径:首先,AADC(芳香族氨基酸脱羧酶)催化苯丙氨酸转化为苯乙胺;其次,MAO(单胺氧化酶)催化苯乙胺生成苯乙醛;最后,经PAR(苯乙醛还原酶)催化转化为2-苯乙醇.在整个反应过程中,关键酶包括AADC、MAO和PAR.Tieman等[3]又确定了番茄里的两种酶:LePAR1和LePAR2.他们将这两种酶的cDNA分别在矮牵牛花中构建表达,发现转基因后的矮牵牛花中2-苯乙醇的含量都有明显地提高.
1.2 2-苯乙醇在玫瑰中的合成途径研究
Sakai等[4]发现在玫瑰花中由L-苯丙氨酸合成2-苯乙醇有两个关键酶:依赖 5-磷酸吡哆醛的AADC和PAR.AADC催化L-苯丙氨酸合成苯乙醛是催化D-苯丙氨酸的9倍,PAR对多种挥发性醛类物质有专一性.在有氧的情况下,AADC在水解L-苯丙氨酸后,经过脱羧和氧化,生成了苯乙醛和NH3,而后苯乙醛由PAR催化转化生成2-苯乙醇,NADPH(还原型辅酶Ⅱ)和NADH(还原型辅酶Ⅰ)都能在玫瑰中做PAR的辅助因子.
Chen Xiaomin等[5]对突厥蔷薇细胞内纯化的rose-PAR和通过cDNA从大肠杆菌表达的重组PAR做详细的研究,包括分子特性、专一性和对辅助因子的偏好性.结果推断出来的重组氨基酸序列分别与番茄PAR1和PAR2有77%和75%相似性.花瓣中PAR含量要明显高于花萼和叶子,在花瓣展开的时候含量最高.重组-PAR和rose-PAR在催化苯乙醛合成2-苯乙醇时更偏爱辅助因子NADPH.然而,rose-PAR对苯乙醛的催化活性是重组PAR的10 倍,且它们的最适底物也不同,其原因可能是在大肠杆菌翻译后缺乏修饰作用.
虽然已有报道植物细胞合成2-苯乙醇是通过莽草酸途径,并且通过同位素标记法知道苯乙醛是合成2-苯乙醇过程中的前体和中间体,但有关植物合成2-苯乙醇的完整途径的报道较少.Yang Ziyin 等[6]采用化学合成稳定的[2,3,4,5,6-13C5]莽草酸为前体物质,通过同位素标记法在离体并具有生物活性的玫瑰细胞原生质体上,推测出从莽草酸到2-苯乙醇在玫瑰细胞中的合成路径.
2 微生物转化合成2-苯乙醇代谢途径的研究情况
对微生物转化合成2-苯乙醇的研究早已成熟,但目前一般都是通过艾氏途径调控2-苯乙醇的合成.艾氏途径是L-苯丙氨酸通过转氨基作用生成苯丙酮酸,继而经过脱羧酶和氧化脱氢酶作用生成2-苯乙醇[1](如图1).
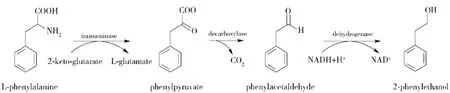
图1 艾氏途径转化L-苯丙氨酸生成苯乙醇Fig.1 Ehrlich pathway for2-PE production from L-Phe
3 国内外提高微生物产2-苯乙醇的方法
2-苯乙醇对微生物的毒性是制约其高产量的关键因素[1],在其质量浓度为2.0~3.0 g/L时,能抑制多种细菌及真菌的生长.为提高2-苯乙醇产量,
目前广泛采用的较为有效的方法有菌种的突变筛选,发酵培养基和发酵条件的优化以及原位萃取技术.
3.1 菌种的突变筛选、发酵培养基及发酵条件优化
2008年,崔志峰等[7]通过对酿酒酵母用紫外诱变等方法进行诱变育种,获得了其中一株CWY132210菌株,其耐受性较原始菌株提高50%,产量提高了9.1%.2009年Eshkol等[8]选育出2-苯乙醇耐受性菌株,通过摇瓶发酵生产出4.5 g/L 2-苯乙醇.2010年王航等[9]从8株酿酒酵母中初筛到一株菌株FD0419,通过诱变和原生质体融合,最终筛得菌株R-UV3.2-苯乙醇产量达2.51 g·L-1,比出发菌株提高69.6%.2013年Celińska等[10]第一次报道解脂耶罗维亚酵母具有产2-苯乙醇的能力,并且在没有优化培养基的情况下发酵 Y.lipolytica NCYC3825,产2-苯乙醇达2 g/L.2004年Etschmann 等[11]为提高 K.marxianus CBS 600产2-苯乙醇产量,采用遗传算法,通过改变13种培养基成分和培养温度,经过98次平行实验,最终生产2-苯乙醇质量浓度为5.6 g/L,较没优化前提高了87.0%.2007 年Garavaglia等[12]以葡萄汁为培养基培养马克斯克鲁维酵母,通过23因子设计,得出在温度37℃,pH 值7.0,L-苯丙氨酸质量浓度为3.0 g/L时,2-苯乙醇产率最高.2007年梅建凤等[13]以S.cerevisiae BD为出发菌株,经响应面优化后,产物2-苯乙醇质量浓度可达4.815 g/L.2011年Rong Shaofeng等[14]选取可氧化降解乙醇的活性干酵母,以L-苯丙氨酸为底物,以乙醇为唯一碳源进行发酵生产2-苯乙醇,发酵结束后产物2-苯乙醇质量浓度可达到2.4 g/L.另外,优化的培养温度和PH值也能提高2-苯乙醇的含量.
3.2 原位萃取技术
2-苯乙醇像其他醇类物质一样对微生物细胞有一定的毒性,王航等[15]研究了在不同浓度2-苯乙醇作用下,酿酒酵母R-UV3生理生化特性的变化规律.结果发现当2-苯乙醇质量浓度从2.4 g/L到3.0 g/L时,酵母的分解代谢能力、细胞膜渗透性、aro10基因表达水平等生理生化特性都发生较为显著的变化.所以在生产2-苯乙醇过程中,须考虑2-苯乙醇的毒性,才能达到2-苯乙醇高产的目的.为此,国内外研究人员采用了原位分离技术.
3.2.1 有机相-水相萃取技术
早期的研究都以油醇为有机萃取剂,如Stark等[16]在2002年以油醇作萃取剂,采用两相补料分批培养技术,发酵S.cerevisiae Giv2009,结果发现2-苯乙醇在油醇相中的含量达24 g/L,总产量可达12.6 g/L.Etschmann等[17]在2006年用K.marxianus CBS600发酵2-苯乙醇,为消除终产物2-苯乙醇对细胞生长的毒性,在培养过程中用聚丙二醇1200作为提取剂,可使有机相中的2-苯乙醇产量提高到26.5 g/L.梅建凤等[18]研究了生物转化2-苯乙醇在水/有机溶剂两相体系中合成工艺,实验结果说明,油酸是两相体系的最佳萃取溶剂,但油酸可能会导致反应体系的溶氧降低,所以可以考虑在加入油酸的同时,适当的增加体系中的通氧速率.同时,有机萃取有几个缺点:1)萃取剂如油酸的沸点高,在286℃(100 mm Hg),2-苯乙醇的沸点是220℃,在真空蒸馏时可能会发生反应;2)萃取剂的香味会影响到产物的香气;3)发酵产生的乳化液给产品的分离带来麻烦.
3.2.2 固相-水相吸附技术
虽然有机相-水相萃取技术效果明显,但是也伴随着黏度大、产品不易分离和毒性大等缺点,因此,有人采用固相-水相吸附技术从水相中吸附2-苯乙醇以提高其产量.Mei Jianfeng等[19]用大孔吸附树脂D101吸附2-苯乙醇,最终产量达到6.2 g/L,其中大孔树脂吸附量为3.0 g/L.Hua Dongliang等[20]用大孔吸附树脂HZ818,得到6.6 g/L 2-苯乙醇,摩尔转化率为74.4%,比没加入时提高了66.2%.关昂等[21]用大孔吸附树脂FD0816得到了12.8 g/L 的2-苯乙醇,较原先提高了232%.Wang Hang 等[22]采用原位分离技术显著提高了2-苯乙醇的产率.实验结果表明,大孔树脂FD101可以使2-苯乙醇的产率达到20.1 g/L.Gao Fang等[23]用Hytrel® 8206(热塑性聚酯)得到13.7 g/L的2-苯乙醇,在这基础上采用半连续装置可使2-苯乙醇产率达到20.4 g/L,其中,1.4 g/L在水相,97.0 g/L在聚合物相中.大孔树脂结构稳定,无挥发性气味,价格低廉,且在萃取过程中不会影响产品的质量,因此,在发酵体系中添加大孔树脂,能大大提高2-苯乙醇的产率,在工艺路线中也简单易行,在工业生产天然2-苯乙醇中有良好的应用前景.
4 结论和展望
不论植物合成还是微生物发酵合成2-苯乙醇均可视为天然产品,直接应用于食品和日用化妆品中.与化学合成法相比,生物合成具有毒性小,环境污染少,产品纯净等优点.
在植物方面,某些关键性的酶(如AADCs和PAR)的相关基因的发现和研究为调控2-苯乙醇在植物体内的合成奠定了基础.
在微生物方面,我国生产L-苯丙氨酸已进入产业化规模,为微生物发酵合成天然2-苯乙醇提供了基础.目前发酵2-苯乙醇工艺所需要解决的技术问题是产物抑制效应.为提高了生物合成2-苯乙醇的产量,一方面可以通过筛选 2-苯乙醇高耐受性菌株,另一方面可以通过补料分批发酵和原位分离技术来降低发酵液中2-苯乙醇的产物抑制作用.因此,若能将原位分离技术与高产量菌株和高效发酵工艺有效结合,将有望实现微生物转化合成2-苯乙醇的工业化生产.
[1] Hua Dongliang,Xu Ping.Recent advances in biotechnological production of 2-phenylethanol[J].Biotechnology Advances,2011.29(6):654-660.
[2] Tieman D,Taylor M,Schauer N,et al.Tomato aromatic amino acid decarboxylases participate in synthesis of the flavor volatiles 2-phenylethanol and 2-phenylacetaldehyde[J]. Proc Natl Acad SciU SA,2006.103(21):8287-8292.
[3] Tieman DM,Loucas H M,Kim JY,etal.Tomato phenylacetaldehyde reductases catalyze the last step in the synthesis of the aroma volatile 2-phenylethanol[J].Phytochemistry,2007,68(21):2660-2669.
[4] Sakai M,Hirata H,Sayama H,et al.Production of 2-phenylethanol in roses as the dominant floral scent compound from L-phenylalanine by two key enzymes,a PLP-dependent decarboxylase and a phenylacetaldehyde reductase[J].Biosci Biotechnol Biochem,2007,71(10): 2408-2419.
[5] Chen Xiaomin,KobayashiH,SakaiM,etal.Functional characterization of rose phenylacetaldehyde reductase (PAR),an enzyme involved in the biosynthesis of the scent compound 2-phenylethanol[J].J Plant Physiol, 2011.168(2):88-95.
[6] Yang Ziyin,Sakai M,Sayama H,et al.Elucidation of the biochemical pathway of2-phenylethanol from shikimic acid using isolated protoplasts of rose flowers[J].JPlant Physiol,2009,166(8):887-891.
[7] 崔志峰,车智博,杨霄,等.2-苯乙醇耐受性高产酵母菌株的选育[J].浙江工业大学学报,2008,36(4):427-430.
[8] Eshkol N,Sendovski M,Bahalul M,et al.Production of 2-phenylethanol from L-phenylalanine by a stress tolerant Saccharomyces cerevisiaestrain[J].Journal of Applied Microbiology,2009,106(2):534-542.
[9] 王航,董清风,孟春,等.高产2-苯乙醇酿酒酵母的选育[J].福州大学学报,2010,38(1):153-156.
[10] Celińska E,Kubiak P,BiałasW,et al.Yarrowia lipolytica:the novel and promising2-phenylethanol producer [J].Journal of Industrial Microbiology&Biotechnology,2013,40(3-4):389-392.
[11] Etschmann M M W,Sell D,Schrader J.Medium optimization for the production of the aroma compound 2-phenylethanol using a genetic algorithm[J].Journal of Molecular Catalysis B:Enzymatic,2004,29(1-6): 187-193.
[12] Garavaglia J,Flôres SH,Pizzolato TM,et al.Bioconversion of l-phenylalanine into 2-phenylethanol by Kluyveromyces marxianus in grape must cultures[J]. World Journal of Microbiology and Biotechnology,2007, 23(9):1273-1279.
[13] 梅建凤,闵航,吕镇梅.利用酵母细胞生物催化合成2-苯乙醇[J].催化学报,2007,28(11):993-998.
[14] Rong Shaofeng,Ding Baomei,Zhang Xiaoli,et al.Enhanced biotransformation of2-phenylethanolwith ethanol oxidation in a solid-liquid two-phase system by active dry yeast[J].Current Microbiology,2011,63(5):503-509.
[15] 王航,孟春,石贤爱,等.2-苯乙醇对酿酒酵母生理生化特性影响[J].微生物学通报,2012,39(6):749-755.
[16] Stark D,Münch T,Sonnleitner B,et al.Extractive bioconversion of 2-phenylethanol from L-phenylalanine by Saccharomyces cerevisiae[J].Biotechnol Prog,2002, 18(3):514-523.
[17] Etschmann M M W,Schrader J.An aqueous-organic two-phase bioprocess for efficient production of the natural aroma chemicals 2-phenylethanol and 2-phenylethylacetate with yeast[J].Applied Microbiology and Biotechnology,2006,71(4):440-443.
[18] 梅建凤,陈虹,王鸿,等.水-有机溶剂两相体系中生物转化合成2-苯乙醇[J].化学反应工程与工艺, 2009,25(1):69-73.
[19] Mei Jianfeng,Min Hang,LüZhenmei.Enhanced biotransformation of l-phenylalanine to 2-phenylethanol using an in situ product adsorption technique[J]. Process Biochemistry,2009,44(8):886-890.
[20] Hua Dongliang,Lin Shan,Li Yuanfang,et al.Enhanced 2-phenylethanol production from L-phenylalanine viain situproduct adsorption[J].Biocatalysis and Biotransformation,2010,28(4):259-266.
[21] 关昂,王航,孟春,等.原位转移技术用于酵母合成2-苯乙醇[J].过程工程学报,2009,9(1):128-132.
[22] Wang Hang,Dong Qingfeng,Guan Ang,et al.Synergistic inhibition effect of 2-phenylethanol and ethanol on bioproduction of natural2-phenylethanol by Saccharomyces cerevisiae and process enhancement[J].Journal of Bioscience and Bioengineering,2011,112(1):26-31.
[23] Gao Fang,Daugulis A J.Bioproduction of the aroma compound 2-phenylethanol in a solid-liquid two-phase partitioning bioreactor system by Kluyveromycesmarxianus[J].Biotechnol Bioeng,2009,104(2):332-339.
Study on Synthesis of 2-Phenylethanol by M icrobes and Plants
HUANG Youhe1, YANG Shangtong1, ZHOU Zhiqiang1, XIONG Juan1, CHEN Hong1,
LIU Yuheng2, JIANG Xingtao2,*
(1.Boton(Shanghai)Flavors and Fragrances Technology Co.Ltd.,Shanghai201201,China; 2.Shenzhen Boton Flavors and Fragrances Co.Ltd.,Shenzhen 518051,China)
2-phenylethanol is an important flavour and fragrance compound,which has positive synergy effects for other aroma components in food,cosmetic,tobacco,and daily chemicals.The metabolism mechanism and latest research of2-phenylethanol in microbes and plantswere reviewed in this paper.
2-phenylethanol;plants;microbes
TS202
10.3969/j.issn.2095-6002.2014.04.008
2095-6002(2014)04-0041-04
(责任编辑:叶红波)
黄友和,杨尚彤,周志强,等.植物和微生物合成2-苯乙醇的研究进展.食品科学技术学报,2014,32(4):41-44. HUANG Youhe,YANG Shangtong,ZHOU Zhiqiang,et al.Study on synthesis of 2-phenylethanol by microbes and plants. Journal of Food Science and Technology,2014,32(4):41-44.
2013-05-27
黄友和,男,工程师,硕士,主要从事生物香料的研究与开发工作;*姜兴涛,男,高级工程师,主要从事天然风味化学成分的研究与开发工作.通讯作者.
