黄芪多糖对奶牛口蹄疫疫苗免疫抗体水平的影响
2014-01-10申义君周金伟沈留红余树民彭广能曹随忠
申义君,王 斌,周金伟,沈留红,余树民,彭广能,曹随忠
四川农业大学动物医学院 动物疫病与人类健康四川省重点实验室,雅安 625014
黄芪(Radix astragali)是传统补气中药,具有补气益卫、托毒生肌、补虚升阳之功效。黄芪多糖(Astragalus polysaccharide,APS)是黄芪中含量最多,免疫活性最强的水溶性复合植物多糖[5,6]。现代药理研究证明APS 具有增强免疫力,有效的增强细胞和体液免疫反应,对疫苗有辅助增效的作用[5-7]。目前APS 作为免疫增强剂在鸡和小鼠方面的应用研究较多,张训海等[8]研究发现APS 能增强机体的体液免疫,显著提高新城疫抗体效价。关于APS 是否能提高奶牛对口蹄疫疫苗应答能力,目前还鲜见报道。本试验通过对奶牛日粮中添加APS 探讨APS 对奶牛口蹄疫疫苗免疫抗体水平的影响,以期为天然免疫增强剂的开发和应用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 试验药品
APS 购自爱迪森(北京)生物科技有限公司(批号:1208041,纯度:每1 g 含黄芪多糖以葡萄糖计为564 mg;每1 g 黄芪多糖粉相当于原生药7 g),为黄色精细粉末。口蹄疫病毒O 型、亚洲I 型二价灭活苗购自新疆天康畜牧生物技术股份有限公司(生产批号:2012007)。
1.1.2 试验动物
年龄、胎次和体重相近的健康荷斯坦奶牛40头,由四川雅安荥经县新世纪生态乳业有限公司提供。
1.1.3 仪器与试剂
Varioskan Flash 全波长多功能酶标仪(美国),超纯水仪(型号MILLPAK20,美国),8 道移液枪。口蹄疫亚洲Ⅰ型抗体液相阻断ELISA 检测试剂盒(批号:2012111302);口蹄疫O 型抗体液相阻断ELISA 检测试剂盒(批号:2012111601),以上试剂盒均购自中国农业科学院兰州兽医研究所。
1.2 方法
1.2.1 动物分组与处理
(3)结果:将脱氧乌头碱水溶液加热不同时间的样品进行HPLC检测,色谱图进行对比,筛选出变化较为明显的色谱图(图6)进行分析。
将40 头年龄、胎次和体重相近的健康荷斯坦奶牛随机分为4 组(每组10 头),分别为空白对照组、APS 低剂量(5 g/头·d)、中剂量(10 g/头·d)、高剂量(15 g/头·d)组。在常规饲养的基础上,3个试验组分别将5、10、15 g 剂量的APS 粉拌入精料饲喂,每天1 次,连续给药7 d;空白对照组按照同样方法饲喂。给药第4 d 所有奶牛进行口蹄疫免疫,每头注射疫苗2 mL。
1.2.2 饲养管理
各组试验奶牛的饲养管理条件相同,在开放式固定槽位栓系饲养,统一定时定量定质饲喂,自由饮水。
1.2.3 血样采集
分别于给药第0、4、18、32、46 d 和104 d 上午9∶00~10∶00 对所有试验奶牛进行尾根静脉采血,分离血清,-20 ℃保存待检。
1.2.4 抗体检测及方法
采用液相阻断ELISA 试剂盒分别检测第0、4、18、32、46 和104 d 时血清中口蹄疫抗体水平。具体检测方法和步骤参照试剂盒说明书进行。严格按照试剂盒检测方法和步骤进行具体步骤如下:1.包被ELISA 板,充分混匀湿盒中室温过夜;2.抗原抗体反应,血清1∶4 开始做2 倍连续稀释至1∶512,同时稀释阴阳性对照血清,之后每孔中加入稀释好的抗原,震荡混匀,封板,4 ℃过夜;3.洗涤ELISA 板后将抗原抗体反应中对应各孔中的血清病毒混合物按次序转移至ELISA 板上,37 ℃温育1 h;4.洗涤ELISA板,将稀释好的豚鼠抗口蹄疫病毒血清加入到ELISA 板中,37 ℃温育1 h;5.洗涤ELISA 板,将稀释好的兔抗豚鼠酶结合物加入到ELISA 板中37 ℃温育1 h;6.洗涤ELISA 板,加入底物37 ℃温育15 min 后加入终止液,立即在492 nm 波长下读取吸光值。
1.2.5 检测结果的判定
严格按液相阻断ELISA 试剂盒说明书进行。被检血清稀释孔D492nm的吸光值大于临界值的孔为阴性孔,小于或等于临界值的孔为阳性孔,阳性孔在D492nm的吸光值等于临界值所对应的稀释度为该份血清的抗体滴度。若临界值在两个滴度之间,抗体滴度则取中间值;抗体效价≥1∶l28,保护率99%以上;抗体效价在1∶22~1∶90,保护率50%;抗体效价≤1∶16,不保护。
1.3 数据统计
试验数据采用SPSS19.0 软件应用one-way ANOVA 选择LSD 法进行统计处理,结果用均值±标准差(D)表示,以P<0.05 作为差异显著性判断标准。
2 结果与分析
2.1 黄芪多糖对亚洲Ⅰ型口蹄疫抗体水平的影响
试验初期各喂药组与对照组亚洲Ⅰ型口蹄疫抗体水平差异不显著(P >0.05);接种疫苗后各组奶牛口蹄疫的抗体水平均增高,各组的保护率均达到99%。对照组抗体水平先达到峰值,而此时喂药组抗体水平仍有上升趋势,较晚到达峰值。各喂药组的抗体水平相对与对照组抗体水平下降趋势较缓和,且试验第25 d 时各喂药组亚洲Ⅰ型抗体水平已高于对照组。试验第32~104 d 各喂药组亚洲Ⅰ型口蹄疫抗体效价显著的高于对照组(P<0.05),其中低剂量组高于对照组1个滴度左右,中剂量组和高剂量组高于对照组1个滴度以上;在46 d 时对照组保护率已降低到80%。结果表明,APS 能延长亚洲Ⅰ型口蹄疫的抗体效价的平台期,而在衰退期使亚洲Ⅰ型口蹄疫的抗体保持在高位水平,从而增强口蹄疫疫苗的保护力度。
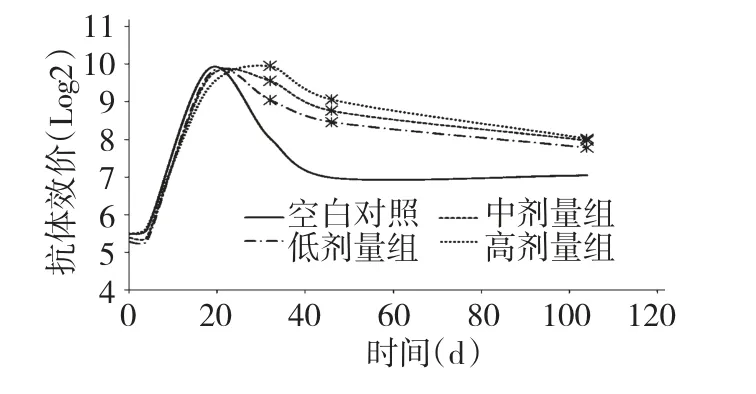
图1 APS 对血清FMD 抗体效价的影响(亚洲Ⅰ型)Fig.1 Effects of APS on serum FMD antibody titer (type Asia I)
2.2 黄芪多糖对O 型口蹄疫抗体水平的影响
试验初期各喂药组与对照组O 型口蹄疫抗体水平差异不显著(P >0.05);接种疫苗后各组奶牛O 型口蹄疫抗体水平均增高,各组的保护率都达到99%。试验第32~104 d 时,APS 中、高剂量组的O型口蹄疫的抗体效价显著高于空白对照组(P<0.05),且在此时间段内APS 中、高剂量组O 型抗体水平高于对照组一个滴度以上,而APS 低剂量组仅在第32~46 d O 型口蹄疫的抗体效价显著高于空白对照组(P<0.05)其中在第46 d 时APS 低剂量组O 型口蹄疫抗体水平高于对照组一个滴度以上。结果表明,APS 能够延长O 型口蹄疫抗体效价的平台期,有效的延缓抗体效价进入衰退期。

图3 APS 对血清FMD 抗体效价的影响(O 型)Fig.3 Effects of APS on serum FMD antibody titer (type O)
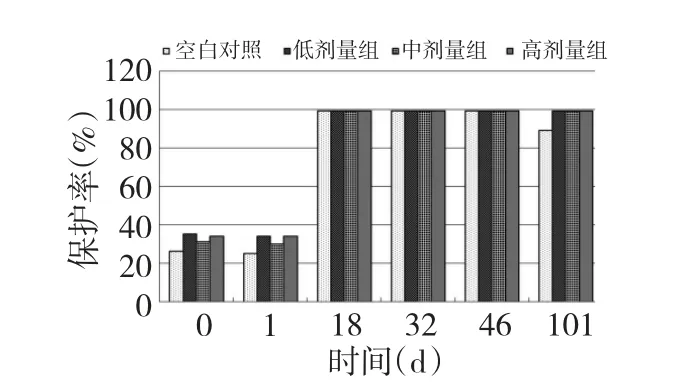
图4 APS 对FMD 保护率的影响(O 型)Fig.4 Effects of APS on protection rates against FMD (type O)
3 讨论
免疫增强剂能增强机体抗病力降低机体对有害微生物的易感性以及防止动物发生免疫抑制。大量药理及临床研究表明,多糖类化合物是良好的免疫调节剂,尤其是植物(板蓝根、玉米花粉、黄芪、香菇、海藻等)多糖具有治疗的广谱性及相对低毒性,它能激活免疫细胞,提高机体免疫功能,其作用具有多途径、多环节、多靶点等特点,适合作为免疫增强剂[3]。
APS 能促进T 细胞转化和增殖,激发T 淋巴细胞和B 淋巴细胞的功能,使脾内效应B 细胞增生,促进抗体的合成,增强体液免疫[8]。项杰等[9]发现黄芪多糖能够促进B 细胞的活化、增殖、产生抗体提高小鼠血清抗体滴度,增强宿主的体液免疫来保护宿主抵抗胞内菌的感染。邱妍等[10]通过对雏鸡应用一定剂量的黄芪多糖,能显著提高新城疫疫苗和鸡新城疫和鸡传染性支气管炎二联苗的免疫效果。王学斌等[6]研究发现黄芪多糖粉剂、黄芪多糖注射液对雏鸡均有较好的免疫增强作用,均能提高雏鸡体内新城疫抗体效价。
体液免疫是机体抗御传染病的主要因素之一,在体内可发挥多种免疫功能,是机体免疫系统的重要组成部分。抗体滴度的高低直接反应机体的体液免疫状态,是评估其免疫状况的重要指标,因此本试验采用检测抗体滴度作为评价黄芪多糖增强口蹄疫疫苗免疫效果的指标。免疫增强剂能够促进抗体的产生,延缓抗体的下降或消失。奶牛接种口蹄疫疫苗后发挥免疫作用的有T 细胞、B 细胞,这些免疫细胞受到抗原刺激后能分化增殖,发生特异性免疫应答,产生抗体。从本实验结果可以看出APS 能减缓抗体水平增高的速度,延长增高的时间、提高增幅、延缓抗体下降,延长口蹄疫抗体的平台期,在衰退期使口蹄疫的抗体保持在较高滴度水平,喂药组口蹄疫抗体滴度比对照组高1个滴度以上,且与用药的剂量有量效关系。这与张红英等[11]报道的山药多糖免疫增强作用主要是在免疫的中后期,且一直持续到试验结束结果相似。APS 除具有免疫增强作用外,还可能与试验组从免疫前4 d 就开始使用黄芪多糖,提高了机体非特异性免疫,降低了接种时的应激反应有关。因此在进行奶牛口蹄疫疫苗免疫接种前后,配合使用黄芪多糖饲喂奶牛能提高口蹄疫抗体滴度,延长抗体维持时间并且群体效价水平整齐,提高机体免疫功能,达到增强疫苗免疫的效果。
1 Wu HR(吴焕荣),Zhao QX(赵全兴),Liu FN(刘方娜),et al.Effect of different immunostimulants on the Layers with NDV vaccine.China Poultry(中国家禽),2012,34(3):60-63.
2 Zhu ZY(朱志盈),Miao DN(缪德年),Jiang FM(姜法铭),et al.Enhancement of bursin on inactivated foot-andmouth disease vaccine in piglets.Veterin Sci China (中国兽医科学),2007,37:150-154.
3 Shi YX(师永霞).Immune synergies research of APS.Gansu Agricultural University(甘肃农业大学),MSc.2008.
4 Saifuding ABL(赛福丁·阿不拉),Wang JM(王君敏),Mikeremu SYBZT(米克热木·沙衣布扎提),et al.Progress on antivirus and immune enhancement activities of polysaccharides and sulfated derivatives.Nat Prod Res Dev (天然产物研究与开发),2013,25:572-575.
5 Chen GH(陈国辉),Huang WF(黄文凤).Progress in pharmacological effects of compositions of Astragalus membranaceus.Chin J New Drugs(中国新药杂志),2008,17:1482-1485.
6 Wang XB(王学斌),Chen GY(陈功义),Wei ZY(魏战勇),et al.Comparison on effect of Astragalus plysaccnaride powders and injects on immune function and growth of chickens.China Poultry(中国家禽),2007,29(3):21-23.
7 Wei X,Zhang J,Li J,et al.Astragalus mongholicus and Polygonum multiflorum's protective function against cyclophosphamide inhibitory effect on thymus.Am J Chin Med,2004,32:669-680.
8 Zhang XH(张训海),Wang DY(王德云),HuYL(胡元亮),et al.Immunologic enhancement of Astragalus polysaccharide(APS)on the humoral immunity of chicken.Chin J Vet Sci(中国兽医学报),2009,29:312-334.
9 Xiang J(项杰),Wang YB(王育斌),Xu T(徐涛),et al.Effects of astragalus mongholicus polysaccharide on host resistance in mice infected with listeria monocytohenes.Med J Wuhan Univ(武汉大学学报,医学版),2007,28:741-743.
10 Li SP,Zhao XJ,Wang J.Synergy of A stragalus polysaccharides and probiotics (Lactobacillus and Bacillus cereus)on immunity and intestinal microbiota in chicks.Poult Sci,2009,88:519-525.
11 Zhang HY(张红英),Wang XB(王学兵),Cui BA(崔保安),et al.Effects of Chinese Yam polysaccharide on antibody and T lymphocytes subpopulations in the immune response to PRRSV killed vaccine.Acta Agriculturae Boreali-Sinica(华北农学报),2010,25:236-238.
