高效液相色谱法测定三种虫草发酵液与菌丝体核苷化合物含量
2014-01-10孙忠华肖建辉范成路徐珺阳林志平
孙忠华,肖建辉,迟 强,范成路,徐珺阳,林志平
1中国人民解放军第215 医院全军心理卫生中心睡眠调整中心,大连 116041;2遵义医学院附属医院贵州省细胞工程重点实验室,遵义 563003
虫草属真菌是我国的一种传统中药材,属于大型真菌类,在我国很多地区都有分布,其中以冬虫夏草(Cordeceps sinensis)最为名贵。然而由于天然虫草资源紧缺,且无节制的采集会破坏生态平衡,利用虫草无性型进行液态深层发酵所得菌丝体是一种良好的替代品,而且应用发酵工程的技术可以缩短虫草的生产周期,增大虫草菌丝体的产量[1,2]。目前,许多研究已经证明虫草的多种成分具有明确的药理活性,如免疫调节、抗肿瘤、抗氧化及调节肾脏和肝脏功能等[3]。虫草属真菌中的有效活性成分比较多,其中核苷类化合物是其中的一类重要成分,在真菌发酵液中,人们的兴趣多集中于菌丝体,而其多种次生代谢产物可能同时会富集于胞外,但目前未见对胞外部分核苷类化合物含量测定。另外,传统的紫外检测方法仅以样品色谱行为的保留时间作为定性指标而缺少光谱数据,从而增加了检测结果的不确定性[4]。江西虫草(Cordyceps jiangxines)、古尼虫草(Cordyceps gunni)、戴氏虫草(Cordyceps taii)是我国梁宗琦研究组在全国虫草资源调查时,发现的三个虫草属新记录[5-6]。本研究拟对虫草发酵液(包括菌丝体和胞外发酵液部分)中五种重要核苷类化合物的含量进行测定,并以保留时间和吸收光谱双指标作为定性依据,建立虫草中核苷类化合物的定量检测方法。
1 材料与方法
1.1 试剂
标准品:腺苷(批号:046K0661)、虫草素(批号:054K4053)、尿苷(批号:1181124)、肌苷(批号:080912)、鸟苷(批号:450233)(均为Sigma 产品);甲醇(色谱级,Tedia,美国);超纯水(Millipore)。
1.2 仪器与设备
全温振荡培养箱(QHZ-98A,江苏太仓华美仪器厂);旋转蒸发仪(Buchi,瑞士);数显鼓风干燥箱(GZX-9070MBE,上海博讯公司);超声破碎仪(Soniprep150,SANYO MSE,英国);Centrifuge 5804R 型冷冻高速离心机(Eppendorf,德国);Milli-Q Biocel 超纯水制备系统(Millipore,美国);超声仪(Grant XB14,英国);电子天平(精确到0.1 mg,BP121S,Sartorius,德国);LC-20A 型高效液相色谱仪(DAD detector,Shimadzu,日本)。
1.3 供试品制备
江西虫草、古尼虫草、戴氏虫草三种真菌的菌种保藏在贵州大学真菌研究室和遵义医学院贵州省细胞工程重点实验室。
样品的制备:采用液体深层发酵培养的方法制备虫草菌丝体,方法见参考文献[1,2]。将发酵产物减压抽滤,合并固体部分(菌丝体)并置于55 ℃干燥箱中烘干至恒重,收集液体部分(胞外发酵液)4℃低温储存。
胞内菌丝体部分:采用超声水提取法。将干燥的菌丝体粉碎(60 目),精确称取0.5 g 并加入10 mL 超纯水,超声粉碎0.5 h,提取液5000 rpm 离心15 min,收集上清液,重复提取一次。合并上清液并用0.22 μm 的微孔滤膜过滤,过滤后滤液用超纯水定容至25 mL 容量瓶中,4 ℃冰箱储存备用。
胞外发酵液部分:将发酵液5000 rpm 离心10 min,上清液用0.22 μm 的微孔滤膜过滤,过滤后滤液用超纯水定容至25 mL 容量瓶中,4 ℃冰箱储存备用。胞内与胞外部分的每份样品均平行测定3个样本。
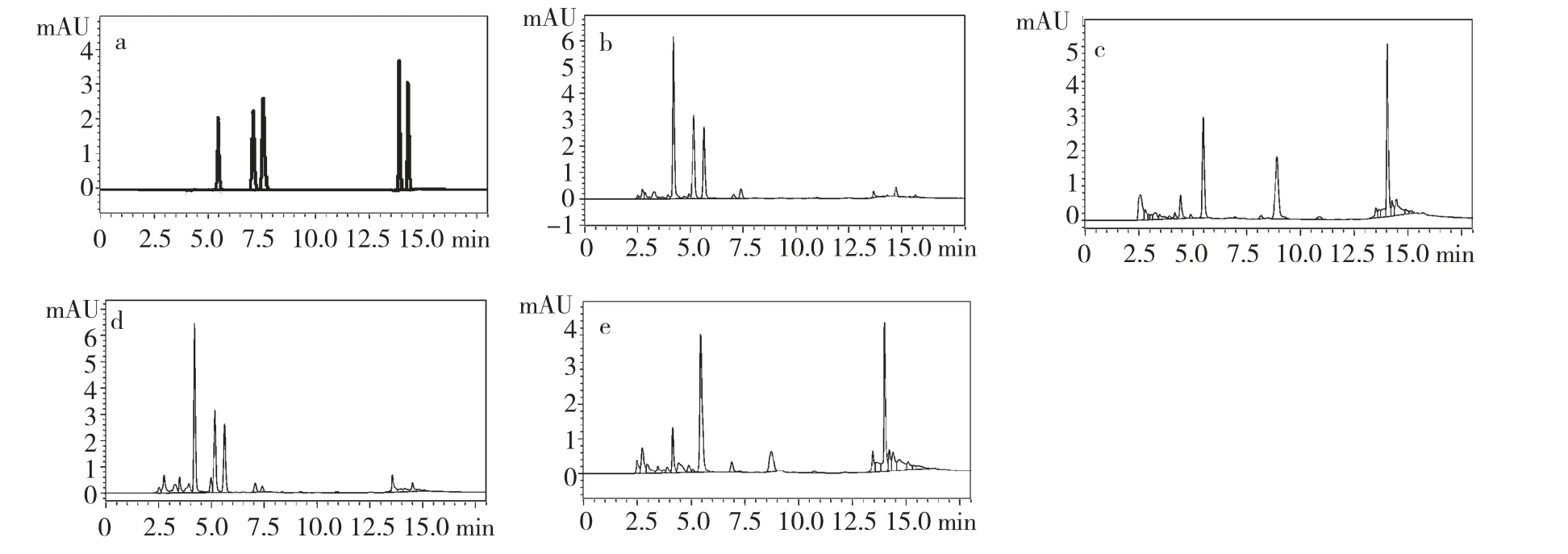
图1 混合标准品与三种虫草样品的HPLC 色谱图Fig.1 HPLC chromatograms of mixed standards and three cordyceps
1.4 色谱条件
应用Shimadzu-ODS C18色谱柱(4.6 mm ×250 mm,5 μm),色谱柱前应用Shimadzu C18保护小柱;流动相:水(A)-甲醇(B),采用梯度洗脱,0~6.5 min,8%B;6.5~7.5 min,8%~12%B;7.5~8 min,12%~35%B;8.0~15.0 min,35%B;15.0~15.03 min,35%~8%B;使用柱前超声脱气,流动相中的每一组分均用0.22 μm 微孔滤膜过滤,配制流动相用Milli-Q 超纯水;应用二极管阵列检测器(DAD),检测波长:λ=254 nm,扫描范围(λ=190~500 nm);柱温箱温度:40 ℃;流速:1.0 mL/min;进样量:20 μL。在此条件下,五种核苷类化合物分离良好且峰形较好。计算柱效,得到色谱参数理论塔板数大于2000。混合标准品的色谱图见图1-a。
1.5 HPLC-DAD 方法学考察
1.5.1 标准曲线
采用外标法。精确称取各标准品1 mg,超纯水定容至10 mL,制成混合标准品,浓度为0.1 mg/mL的标准对照液,分别取各对照液0.05 到2.5 mL 至5 mL 容量瓶中并定容,逐级稀释至浓度分别为0.001、0.005、0.01、0.02、0.05、0.1 mg/mL 的标准溶液,即每一组分分别配制6个浓度,其范围在1.0-100 μg/mL。分别进样20 μL 进行测定,并建立峰面积与组分浓度的回归方程,确定r 值,评估线性关系,确定线性范围、检测限和定量限。检测限和定量限的计算根据药典以信噪比的方法确定,即分别以基线噪声的3 倍和10 倍表示二者的值[7]。具体参见表格1。
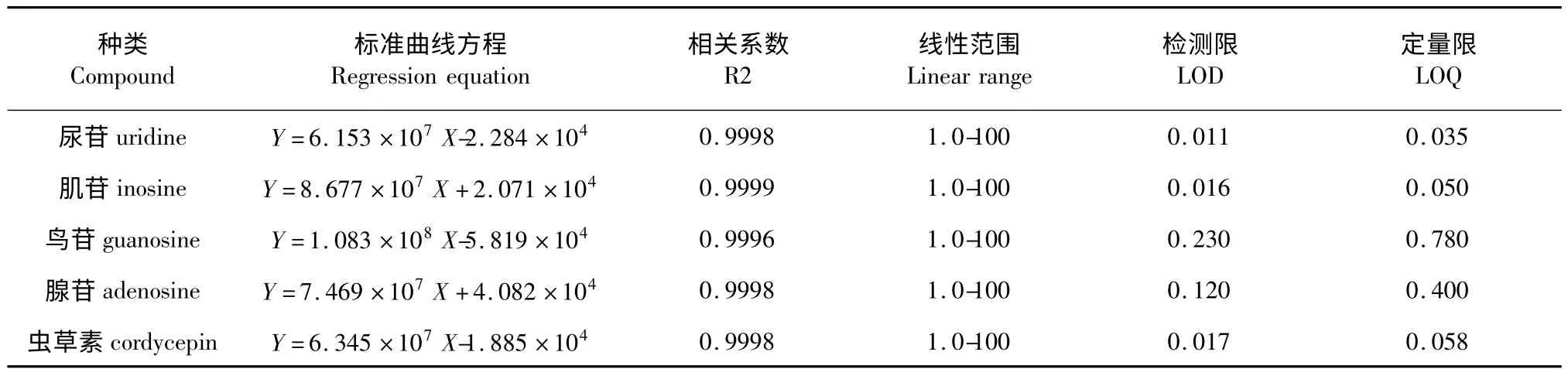
表1 五种核苷化合物的标准曲线方程及检测限和定量限Table 1 Regression equation,limit of detection(LOD)and limit of quantification(LOQ)of 5 nucleosides
1.5.2 选择性和峰纯度
根据每一个标准品的保留时间RT 和%RSD、最大吸收峰的光密度值γ,以色谱-光谱-时间三维立体图确定每一种待检测的物质,确定了以保留时间和光密度值双指标作为定性依据的可行性。利用二极管阵列检测器计算每一个目标峰的纯度指数。
1.5.3 精密度
对色谱系统的性能进行考察。取混合对照品溶液连续进样5 次,记录色谱图,计算峰面积,计算精密度。
1.5.4 稳定性
选择戴氏虫草菌丝体作为检测对象,考察样品在36 h 内各有效成分的稳定性。将样品提取液在避光及4 ℃条件下储存,在36 h 内即第0、4、8、12、24、36 h 分6 次进样测定,考察峰面积的变化。
1.5.5 重现性
按预定提取方法平行提取样品江西虫草菌丝体5份,制备供试液,并进样检测,计算平均值和%RSD。
1.5.6 加标回收率
检查提取方法与色谱条件的可靠性。取戴氏虫草菌丝体的样品3 份,分别按照样品中各个成分的含量加入一定比例(80%、100%、120%)的混合标准品(尿苷、鸟苷和腺苷),按照前述方法重新提取并进样检测,计算回收率。
1.6 供试品测定
将四个样品(三种虫草的菌丝体和戴氏虫草的胞外发酵液部分)分别按照前述2.4 项所述色谱条件进行测定,并计算其中核苷类化合物的含量。
2 实验结果
2.1 方法学考察结果
2.1.1 选择性和峰纯度
每一个标准品的保留时间RT 和%RSD 分别为尿苷(5.52 ±0.05,0.91%)、肌苷(8.21 ±0.09,1.18%)、鸟苷(8.95 ±0.10,1.19%)、腺苷(14.20±0.12,0.87%)、虫草素(14.56 ±0.08,0.61%);其最大吸收峰的波长γ 分别为262、249、253、259、260 nm。各检测峰在其保留时间范围内没有受到明显干扰,有较高的专属性。每一个检测目标峰纯度指数均大于92%。
2.1.2 精密度
计算得到的每一个标准品的峰面积的%RSD分别为1.89%、2.46%、2.00%、0.98%、1.48%,说明该色谱系统在本次操作条件下有良好的精密度。
2.1.3 稳定性
本次实验未能检测到虫草素,其中尿苷、肌苷、鸟苷、腺苷四种检测目标峰面积的% RSD 分别为3.078%,5.0%,1.606%,4.300%,说明各有效成分在36 小时之内稳定。
2.1.4 重现性
计算平均值和%RSD 分别为尿苷(3.15 ±0.53 mg/g,4.04%)、鸟苷(0.11 ±0.02 mg/g,2.84%)、腺苷(1.60 ±0.41 mg/g,2.44%),证明此方法重现性良好。
2.1.5 加标回收率
尿苷、鸟苷、腺苷三个检测指标的回收率分别为尿苷(92.04 ±1.91 %)、鸟苷(95.67 ±1.04 %)、腺苷(90.13 ±2.12%),这表明了该方法所建立的提取方法和色谱条件的可靠性比较好。
2.2 样品中的含量
结果见表格2,以戴氏虫草菌丝体和胞外发酵液比较,可见胞外部分未检测到肌苷,且其中尿苷、鸟苷和腺苷的含量均低于菌丝体部分超过10 倍的数量。其中腺苷存在于每一个样品中,戴氏虫草胞外发酵液部分、古尼虫草菌丝体与野生冬虫夏草比较其含量相当,而戴氏虫草和江西虫草菌丝体与野生冬虫夏草比较其中含量均比较高[8]。本次实验在四个样品中均未能检测到虫草菌素。戴氏(胞外与菌丝体)、古尼江西、虫草四个样品的HPLC 色谱图见图1b~e。
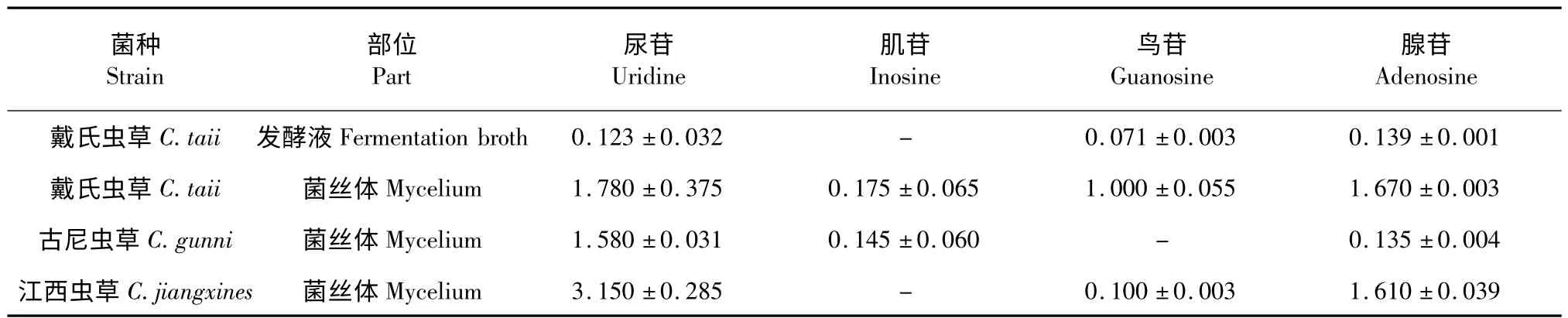
表2 各样品中核苷类化合物的种类及其含量Table 2 The sorts and contents of nucleosides in the samples
3 讨论
本实验主要考察了江西、戴氏、古尼三种虫草菌丝体和发酵液中五种核苷类化合物的含量,建立了核苷类化合物的定量检测方法,从精密度、重现性等实验结果看这一方法是可靠的。应用HPLC-DAD的检测方法,采用保留时间和吸光光谱两个指标,建立色谱-光谱双指标法有利于准确测量,优于单波长的紫外检测方法[4,8]。另外,整个检测过程仅用15 分钟就全部完成,采用梯度洗脱的方法即可实现五种核苷类化合物的完全分离,而未使用缓冲盐,这样减少了维护成本,保护了色谱柱和整个系统。
从测定结果看,胞外发酵液部分也含有一定量的核苷类化合物,虽然含量较低,但仍可以作为进一步开发的对象,如功能性食品或保健饮料等,在野外训练和军事保健中具有极大的潜在应用价值;核苷类化合物在菌丝体中的种类不是很全,但含量比较高,如腺苷的含量与野生冬虫夏草相比较高出10 倍左右[8],并且均在药物化学实验中获得分离纯化[9],相关实验表明这些化合物不排除与抗氧化等活性相关[10,11]。从核苷类化合物的种类和含量来看,这种发酵菌丝体作为冬虫夏草替代品是可行的。下一步可结合分离纯化和药理学实验进一步完善其质控指标,以期建立系统的品质评价体系和质量控制标准,为今后有目的的开发研究打下基础。
1 Xiao JH,Chen DX,Liu JW,et al.Optimization of submerged culture requirements for the production of mycelial growth and exopolysaccharide by Cordyceps jiangxiensis JXPJ 0109.J Appl Microb,2004,96:1105-1116.
2 Xiao JH,Chen DX,Wan WH,et al.Enhanced simultaneous production of mycelia and intracellular polysaccharide in submerged cultivation of Cordyceps jiangxiensis using desirability functions.Process Biochem,2006,41:1887-1893.
3 Xiao JH,Zhong JJ.Secondary metabolites from Cordyceps species and their antitumor activity studies.Recent Pat Biotechnol,2007,1:123-137.
4 Govindarajan R,Singh DP,Rawat AKS.High-performance liquid chromatographic method for the quantification of phenolics in‘Chyavanprash’a potent Ayurvedic drug.J Pharm Biomed Anal,2007,43:527-532.
5 Liang ZQ(梁宗琦),Liu AY(刘爱英),Liu ZY(刘作易).Flora Fungorum Sinicorum.Vol 32,Cordyceps(中国真菌志.第32 卷,虫草属).Beijing:Science Press,2007.31-52.
6 Quan guo Zhong Cao Yao Hui Bian(Edition 1).BeiJing:People’s Medical Publishing House,1975.132.
7 Chinese Pharmocopoeia Commission(国家药典委员会).Chinese Pharmacopoeia of the People’s Republic of China(中华人民共和国药典).Beijing:China Mecical Science Press,2005.Vol I,145.
8 Liang HH(梁洪卉),Cheng Z(程舟),Yang XL(杨晓伶),et al.Quantitative determination of nucleosides in Cordyceps sinensis by High-performance liquid chromatographic Method.J Chin Med Mater(中药材),2008,31:58-60.
9 Sun ZH(孙忠华),Xiao JH(肖建辉),Pan WD(潘卫东),et al.Study on the chemical constitutes of submerged cultivation mycelium of Cordyceps jiangxiensis.J Chin Med Mater(中药材),2010,33:1878-1881.
10 Xiao JH,Xiao DM,Sun ZH,et al.Antioxidative potential of polysaccharide fractions produced from traditional Chinese medicinal macrofungus Cordyceps jiangxiensisin vitro.Afr J Biotechnol,2010,10:6607-6615.
11 Xiao DM(肖代敏),Xiao JH(肖建辉),ZHang ZM(张志敏),et al.Antimicrobial potential of Metarhizium taii in vitro.J Chin Med Mater(中药材),2010,33:117-122.
