响应面法优化柿叶总黄酮缓释微丸的载药量
2014-01-10王兰,顾欣,赵麟,龚频
王 兰,顾 欣,赵 麟,龚 频
陕西科技大学生命科学与工程学院,西安 710021
柿叶为柿科植物柿的新鲜或干燥叶,主要生物活性成分是柿叶中的总黄酮,大量实验表明其具有明显的抗氧化、抗衰老、增强机体免疫力、抗溃疡、软化血管、降血糖和降血脂等医疗保健作用[1,2]。响应面分析法(Response Surface Methodology,RSM)是利用合理的试验设计,采用多元二次回归方程拟合各因素与响应值之间的函数关系,通过对回归方程的分析以寻求最佳工艺参数,解决多变量的一种统计方法。
目前,国内研究主要集中于柿叶总黄酮的提取纯化方面,而对于柿叶总黄酮的新剂型还研究甚少。例如董江涛等[3]采用响应曲面法优化微波辅助提取柿叶中总黄酮的工艺,刘登勇等[4]利用响应面法优化柿叶总黄酮的超声波辅助提取条件,蒋橙华等则用微波-超声协同辅助提取柿叶中的总黄酮,并且应用响应面法对影响提取率的各因素进行分析拟合以优化工艺参数,李燕等[5]应用AB-8 型大孔树脂分离纯化柿叶总黄酮。在剂型研究方面,周文亮研制了注射用柿叶总黄酮粉针并考察其安全性,陈惠杰等制备了柿叶总黄酮醇质体,至今还尚未见柿叶总黄酮缓释微丸的相关报道。
为了克服传统剂型给药次数较多和血药浓度波动较大的不足,笔者拟制备柿叶总黄酮缓释微丸;本文将以单因素试验为基础,以缓释微丸的载药量为响应值,采用响应面法分析法优化柿叶总黄酮缓释微丸的载药量。
1 材料与方法
1.1 材料
柿叶总黄酮(自制,黄酮的含量为55%~60%),海藻酸钠(西安中信精细化工有限公司),氯化钙(天津市大陆化学试剂厂),壳聚糖(上海三爱思试剂有限公司),乙酸(上海建信化工有限公司试剂厂),氢氧化钠(西安化学试剂厂),无水乙醇(西安化学试剂厂),亚硝酸钠(北京化学试剂厂);硝酸铝(上海新中化学厂);氯化钙(天津市大陆化学试剂厂)。
1.2 主要仪器
HH-S4 型电热恒温水浴锅(北京科伟永兴仪器有限公司);BS224S 型电子天平(北京利多斯仪器系统有限公司);SP-752(PC)型紫外-可见分光光度计(上海光谱仪器有限公司);真空冷冻干燥机(常州品正干燥设备有限公司);78-1 型磁力搅拌器(国华电器有限公司);TGL-16M 高速台式冷冻离心机(长沙湘仪仪器有限公司)。
1.3 实验方法
1.3.1 柿叶总黄酮缓释微丸的制备
首先配制海藻酸钠溶液,然后加入柿叶中总黄酮的提取物,使其完全溶解于海藻酸钠溶液中。再分别配制氯化钙溶液和壳聚糖的乙酸液,将上述的氯化钙溶液缓慢加入壳聚糖乙酸液中,边加边搅拌直至混合均匀。最后将海藻酸钠-柿叶总黄酮复合液滴入。在磁力搅拌器中加热搅拌反应,待反应完全后,收集微丸,洗涤后干燥。
1.3.2 载药量的测定
称取适量的柿叶总黄酮缓释微丸,在研钵中研细,置于70%乙醇溶液中浸泡过夜,再将溶液pH 调至6.8 左右,在磁力搅拌器作用下搅拌3 h,使药物充分溶出,然后以3000 rpm 的转速离心10 min 取上清液于510 nm 处测定吸光度[6]。最后按照以下公式计算出载药量。

1.3.3 单因素试验
1.3.3.1 海藻酸钠浓度的选择
固定壳聚糖浓度为2%,氯化钙浓度为3%,投药量为20%,搅拌转速为500 rpm,反应温度为40℃,搅拌时间为30 min,选择海藻酸钠浓度分别为1%、1.5%、2%、2.5%、3%,考察海藻酸钠浓度对柿叶总黄酮缓释微丸载药量的影响。
1.3.3.2 壳聚糖浓度的选择
固定海藻酸钠浓度为2.5%,氯化钙浓度为3%,投药量为20%,搅拌转速为500 rpm,反应温度为40 ℃,搅拌时间为30 min,选择壳聚糖浓度依次为1%、1.5%、2%、2.5%、3%,考察壳聚糖浓度对柿叶总黄酮缓释微丸载药量的影响。
1.3.3.3 氯化钙浓度的选择
固定海藻酸钠浓度为2.5%,壳聚糖浓度为2%,投药量为20%搅拌转速为500 rpm,反应温度为40 ℃,搅拌时间为30 min,选择氯化钙浓度分别为1%、2%、3%、4%、5%,考察氯化钙浓度对柿叶总黄酮缓释微丸载药量的影响。
1.3.3.4 投药量的选择
本文以柿叶中总黄酮的提取物为主药,固定海藻酸钠浓度为2.5%,壳聚糖浓度为2%,氯化钙浓度为3%,搅拌转速为500 rpm,反应温度为40 ℃,搅拌时间为30 min,选择投药量依次为10%、20%、30%、40%、50%,考察投药量对柿叶总黄酮缓释微丸载药量的影响。
1.3.3.5 搅拌转速的选择
固定海藻酸钠浓度为2.5%,壳聚糖浓度为2%,氯化钙浓度为3%,投药量为20%,反应温度为40 ℃,搅拌时间为30 min,选择磁力搅拌的转速分别为100、300、500、700、900 rpm,考察搅拌转速对柿叶总黄酮缓释微丸载药量的影响。
1.3.3.6 反应温度的选择
固定海藻酸钠浓度为2.5%,壳聚糖浓度为2%,氯化钙浓度为3%,投药量为20%,搅拌速度为500 rpm,搅拌时间为30 min,选择反应温度依次为30、40、50、60、70 ℃,考察反应温度对柿叶总黄酮缓释微丸载药量的影响。
1.3.3.7 反应时间的选择
固定海藻酸钠浓度为2.5%,壳聚糖浓度为2%,氯化钙浓度为3%,投药量为20%,搅拌速度为500 rpm,反应温度为40 ℃,选择反应时间分别为15、30、45、60、75 min,考察反应时间对柿叶总黄酮缓释微丸载药量的影响。
1.3.4 响应面优化载药量[7,8]
根据Box-Benhnken 的中心组合试验设计原理,结合单因素试验结果,在确定其余因素的情况下,最终选取海藻酸钠浓度(A)、壳聚糖浓度(B)、投药量(C)和反应温度(D)这4个因素,每个因素3个水平,应用Design expert 7.1.6 软件设计4 因素3 水平的响应面试验,对柿叶总黄酮缓释微丸的载药量进行优化。因素与水平设计见表1 所示。

表1 响应面试验因素与水平表Table 1 Levels and code of response surface experiments
2 结果与分析
2.1 单因素试验结果
2.1.1 海藻酸钠浓度对柿叶总黄酮缓释微丸载药量的影响
由图1A 可知,柿叶总黄酮缓释微丸载药量随着海藻酸钠浓度的增大而增高,当海藻酸钠浓度为2.5%时达到最大值,之后载药量下降。因此,海藻酸钠浓度以2.5%为宜。
2.1.2 壳聚糖浓度对柿叶总黄酮缓释微丸载药量的影响
由图1B 所示,柿叶总黄酮缓释微丸载药量随着壳聚糖浓度的增大而增高,当壳聚糖浓度为2%时达到最大值,之后载药量下降。考虑到载药量是望大的,因此,壳聚糖浓度以2%为宜。
2.1.3 氯化钙浓度对柿叶总黄酮缓释微丸载药量的影响
区别于海藻酸钠浓度和壳聚糖浓度对柿叶总黄酮缓释微丸载药量的影响,氯化钙浓度对载药量影响较小。由图1C 所示,当氯化钙浓度为3%时载药量达到最大,随后略呈下降趋势。这可能是因为壳聚糖和氯化钙形成瞬时凝聚珠并不是影响缓释微丸载药量的主要因素,综合上述分析氯化钙浓度以3%为宜。
2.1.4 投药量对柿叶总黄酮缓释微丸载药量的影响
由图1D 可知,柿叶总黄酮缓释微丸载药量随着投药量的增大而增高,当投药量为40%时达到最大值,之后载药量下降。考虑到载药量是望大的,因此,投药量以40%为宜。
2.1.5 搅拌转速对柿叶总黄酮缓释微丸载药量的影响
整体而言,搅拌转速对载药量影响较小。由图1E 可知,当搅拌转速为500 rpm 时载药量达到最大,随后呈下降趋势。因此搅拌转速应以500 rpm为宜。
2.1.6 反应温度对柿叶总黄酮缓释微丸载药量的影响
由图1F 可知,柿叶总黄酮缓释微丸载药量随着反应温度的升高而增高,当反应温度为50 ℃时达到最大值,之后载药量下降。考虑到载药量是望大的,因此,反应温度以50 ℃为宜。
2.1.7 反应时间对柿叶总黄酮缓释微丸载药量的影响
整体而言,反应时间对载药量影响较小。由图1G 可知,当反应时间为45 min 时载药量达到最大,随后呈下降趋势。分析可能是反应时间的延长不利于缓释微丸中柿叶总黄酮的溶出。综合上述分析反应时间以45 min 为宜。
2.2 响应面试验结果
根据上述单因素试验的结果,最终选取对响应值Y(载药量)有显著影响的4个因素,分别为海藻酸钠浓度(A)、壳聚糖浓度(B)、投药量(C)和反应温度(D),每个因素选取3个水平,应用Design expert 7.1.6 软件设计4 因素3 水平的响应面试验,对柿叶总黄酮缓释微丸的载药量进行优化。试验结果见表2 所示。

图1 海藻酸钠浓度(A)、壳聚糖浓度(B)、氯化钙浓度(C)、投药量(D)、搅拌转速(E)、反应温度(F)和反应时间(G)对载药量的影响Fig.1 Effects of concentration of sodium alginate (A),concentration of chitosan (B),concentration of calcium chloride (C),quantity of reagent (D),agitation speed (E),reaction temperature (F)and reaction time (G)on drug loading rate
利用Design expert 7.1.6 软件对表2 进行多元线性回归拟合,得到柿叶总黄酮缓释微丸载药量(Y)对海藻酸钠浓度(A)、壳聚糖浓度(B)、投药量(C)和反应温度(D)的二次多项回归方程为:Y=21.85 +0.97A +0.64B-0.95C +1.11D +1.2AB-0.28AC+1.3AD+0.2BC-0.73BD+1.16CD-1.38A2-3.58B2-1.15C2-5.5D2。
经方差分析可知,模型P 值<0.0001 为极显著,说明此模型模拟可靠;另外模型相关系数R2=0.9658,说明响应值Y(载药量)的变化有96.58%来源于所选因素;同时信噪比为17.943,说明该模型有很强的信号。综上所述,该模型模拟度高、方法可靠。

表2 响应面试验结果Table 2 Box-Behnken design matrix and the experimental results
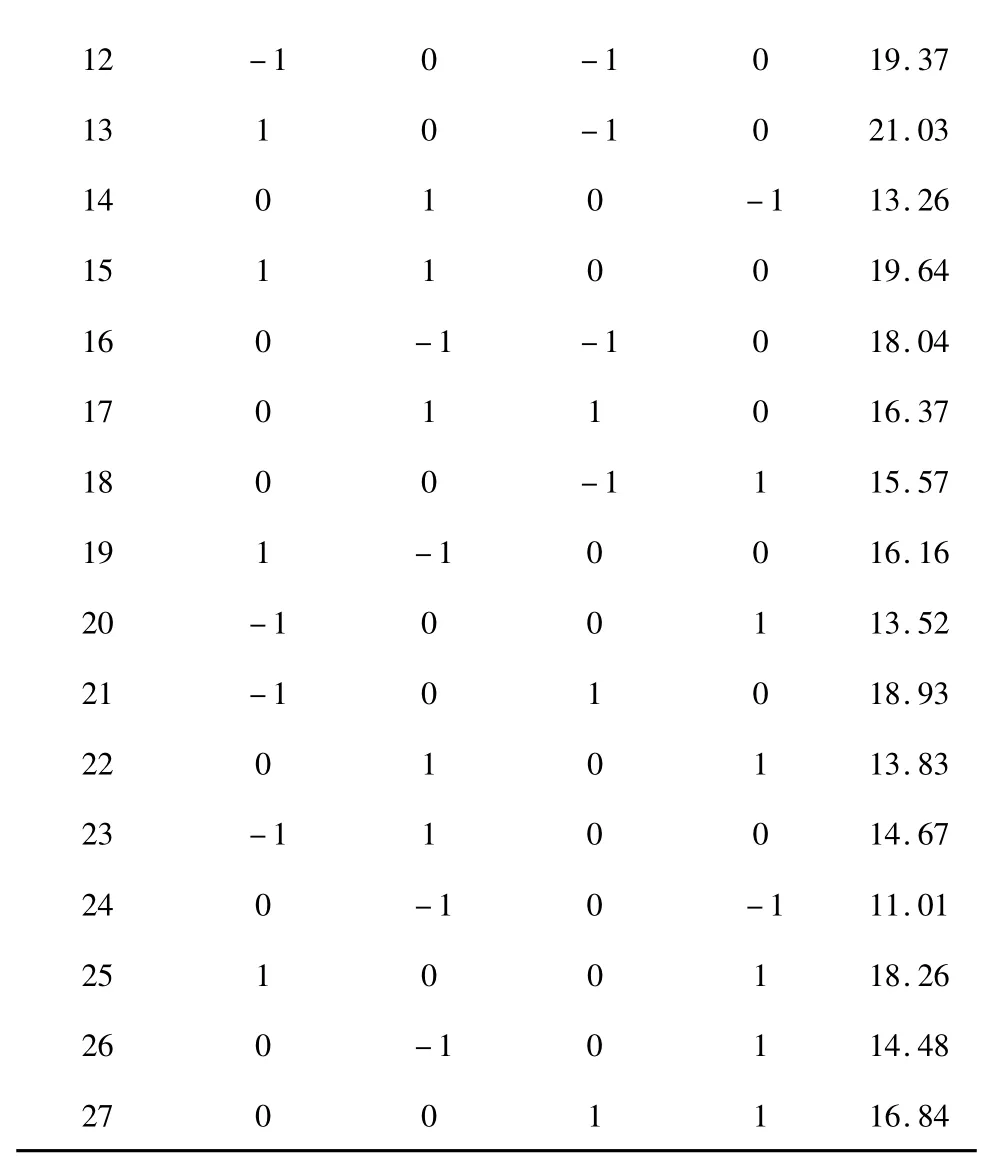
另外海藻酸钠浓度(A)、投药量(C)、反应温度(D)、海藻酸钠平方项(A2)、壳聚糖浓度平方项(B2)、投药量平方项(C2)和反应温度平方项(D2)对载药量(Y)的影响极其显著。
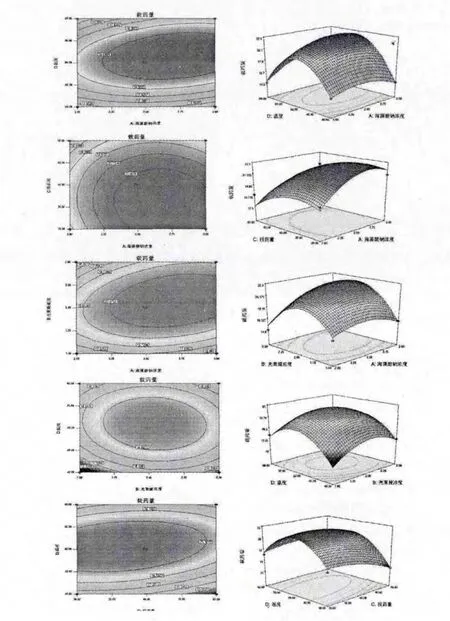
图2 A-B(a)、A-C(b)、A-D(c)、B-C(d)、B-D(e)和C-D(f)对载药量影响的等高线(C=0)与响应面图Fig.2 Responsive surface plots and contour plots of A-B (a),A-C (b),A-D (c),B-C (d),B-D (e)and C-D (f)to drug loading rate (C=0)
影响柿叶总黄酮缓释微丸载药量的因素按影响大小依次为:反应温度(D)>海藻酸钠浓度(A)>投药量(C)>壳聚糖浓度(B),其交互作用的响应面分析结果依次见图2 所示。
由2 a-f 可知,海藻酸钠浓度和壳聚糖浓度的交互作用(记为A-B)、海藻酸钠浓度和反应温度的交互作用(A-D)以及投药量和反应温度的交互作用(C-D)对柿叶总黄酮缓释微丸载药量的影响显著。表现在响应面与等高线上即为响应面曲面比较陡,并且等高线呈椭圆状。
2.3 验证性试验
对回归模型进行分析计算,最终得出当海藻酸钠浓度为2.75%、壳聚糖浓度为2.08%、投药量为35.94%、反应温度为51 ℃时载药量是22.41%。结果与预测值相差不大,说明运用响应面法优化柿叶总黄酮缓释微丸的载药量是可行的。
3 结论
本文运用响应面法优化柿叶总黄酮缓释微丸的载药量。以单因素试验结果为基础,结合Box-Behnken 中心组合设计法和响应面分析法依次考察海藻酸钠浓度、壳聚糖浓度、投药量和反应温度及其交互作用对载药量的影响,并且对回归模型进行验证确定了当海藻酸钠浓度为2.75%、壳聚糖浓度为2.08%、投药量为35.94%、反应温度为51 ℃时载药量是22.41%。另外关于柿叶总黄酮缓释微丸体外释放度的研究可见另文报道[9]。
1 Wang N(王宁),Li YZ(李远志),Xu LZ(徐莉珍),et al.Research on ultrasonic extraction of flavone from persimmon leaves.Mod Food Sci Technol(现代食品科技),2008,24:687-690.
2 Wei JL(卫静莉),Gao SP(高松平),Dong M(董梅),et al.Study on extraction method and identify of the flavonoid compound from persimmon leaves.China Forest Sci Technol(林业科技开发),2007,21(3):47-49.
3 Dong JT(董江涛),Li Y(李燕),Xu HQ(徐慧强),et al.Optimization of microwave-assisted extraction process of total flavonoids from persimmon leaves using response surface methodology.Acta Agric Zhejiangensis(浙江农业学报),2010,22:521-526.
4 Liu DY(刘登勇),Qi J(戚军),Jia N(贾娜),et al.Optimization of ultrasonic-assisted extraction of flavonoids from persimmon leaf by response surface methodology.Food Ferment Technol(食品与发酵科技),2013,49(6):1-6.
5 Dong JT(董江涛),Li Y(李燕),Xu HQ(徐慧强),et al.Purification of flavonoids from persimmon leaves by macroporous resin.Hunan Agric Sci(湖南农业科学),2010,11:85-89.
6 Wang L(王兰),Zhao L(赵麟).Optimization of the extraction technology of total flavone from FOLIUM KAXI using response surface analysis.J Anhui Agric Sci(安徽农业科学),2011,3:1370-1373.
7 Ren FL(任凤莲),Gu FF(谷芳芳),Wu ML(吴梅林),et al.Optimization of extraction for flavonoids from Hawthorn by response surface method.Nat Prod Res Dev(天然产物研究与开发),2006,18:126-129.
8 Hu N(胡娜),Yang RM(杨仁明),He YF(何彦峰),et al.Optimization of ultrasonic-assisted extraction of total flavonoids from Nitraria tangutorum Bobr.by response surface methodology.Nat Prod Res Dev(天然产物研究与开发),2012,24:1844-1848.
9 Wang L(王兰),Gu X(顾欣),Gong P(龚频),et al.Cumulative drug release rate in vitro of total flavonids sustained-release micropills from persimmon leaves.J Shaanxi Univ Sci Technol(陕西科技大学学报),2014,32:117-120.
