药用植物内生菌对青藤碱的微生物转化筛选
2014-01-09刘发贵邓艾平郭志勇邓张双
刘发贵,潘 烨,邓艾平,罗 丹,杨 进,郭志勇,邓张双
三峡大学 天然产物研究与利用湖北省重点实验室,宜昌 443002
青藤碱(Sinomenine)是一种天然吗啡烷类生物碱,拥有抗炎、免疫调节、镇痛、抗肿瘤、降血压、促组胺释放、神经保护等多种药理活性,临床用于类风湿性关节炎的辅助治疗[1]。但是,青藤碱分子结构对光、热、碱不稳定,且生物利用度低,易引起肠胃不适等副作用,限制了青藤碱作为抗炎药物的应用[2]。为了克服这些缺陷,国内外学者对青藤碱分子进行了化学结构修饰,却很少发现抗炎活性突出的青藤碱衍生物[3]。生物转化反应具有反应条件温和、反应产物立体选择性好、较易获得结构新颖的化合物等特点;同时符合生物体代谢规律,发现具有生理活性的代谢产物几率高[4]。
关于青藤碱的生物转化研究国内外报道较少。陈磊[5]报道了真菌Cunninghamella M2 转化青藤碱为羟基青藤碱,但是没有给出转化产物的结构式。课题组在前期研究过程中,发现真菌Antrodiella semisupina 能催化青藤碱和愈创木酚形成碳碳和碳氧交叉偶联产物1 和2[6],且能选择性的催化青藤碱及类似物转化为(S)-双青藤碱类结构3 和4[6-8]。Joyeau Roger 等[9]人发现青藤碱衍生物O-benzyl-sinomenine 能被真菌Mucor plumbeus ATCC 4740 转化成去氮甲基产物5 和氮氧化物6 两种转化产物。课题组借鉴前期研究经验,继续研究青藤碱的微生物转化反应及转化产物,本文以药用植物内生菌为研究载体,建立青藤碱的微生物转化筛选模型,研究青藤碱与内生菌共培养以后的代谢产物,以期发现具有高效抗炎效果或者结构新颖的青藤碱衍生物。
1 材料与仪器
1.1 材料与试剂
青藤碱盐酸盐:购自成都钜龙天然药业生命科技有限公司,经HPLC 分析,纯度≥97.0%。GF254薄层层析硅胶板(20 mm × 20 mm,0.25 mm)和正相硅胶(300~400 目)均购自青岛海洋化学有限公司。薄层层析条件:CHCl3-CH3OH(9∶1,V/V),254 nm 紫外显色。分析试剂均为色谱纯,常规试剂均为分析纯。
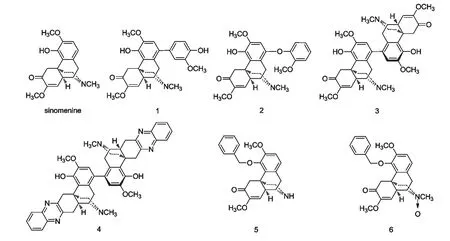
图1 青藤碱微生物转化产物Fig.1 Chemical structures of sinomenine and its biotransformed products
1.2 仪器
1H NMR、13C NMR、1H-1H COSY、HMQC 和HMBC 谱由Bruker Avance III-400 核磁共振仪测得,溶剂为CDCl3,内标为四甲基硅烷(Tetramethylsilane,TMS),化学位移记为δ(ppm);化合物分子量由液相色谱-双重漏斗传输离子阱质谱仪(仪器型号为AmozonSL+1200,布鲁克.道尔顿公司)测得;微生物培养在恒温摇床HQD150LB(武汉海声达仪器设备有限公司)上进行。
2 实验方法
2.1 植物组织
采自湖北省神龙架林区,分别为青风藤[Sinomenium acutum(Thunb)Rehd.et Wils.]、夹竹桃(Nerium oleander)、朵 云(Botrychium daucifoltum Woll)、蛇菰(Balanophora japonica),由三峡大学天然产物研究与利用湖北省重点实验室杨进副教授鉴定。
2.2 斜面培养基(SPM)
将200 g 去皮土豆切成小块,加适量水煮沸30 min,用纱布过滤,滤液中加入琼脂30 g,煮沸,加入葡萄糖20 g,KH2PO43.0 g,MgSO4·7H2O 1.5 g,微量维生素B1,调节pH 至6.0,定容至1 L,用试管分装(约10 mL/1 支试管),在121 ℃下灭菌20 min。
2.3 微生物转化培养基(SPM)
将200 g 去皮土豆切成小块,加适量水煮沸30 min,用纱布过滤,滤液中加入葡萄糖20 g,KH2PO43.0 g,MgSO4·7H2O 1.5 g,微量维生素B1,调节pH 至6.0,定容至1 L,用250 mL 锥形瓶分装(约100 mL/1 个锥形瓶),在121 ℃下灭菌20 min。
2.4 菌株分离
取部分植物组织放入75%左右的酒精溶液(含少量抗生素)中荡洗,接入含抗生素的PDA 平板中,倒置培养,观察并做好记录,待菌落开始萌发时,将单个菌落转入PDA 平板上继续培养、分离纯化,并进行斜面保种。
2.5 转化菌株筛选
活化7 d 的斜面菌种,转接到100 mL 发酵培养基中,恒温振荡器上培养4 d(25 ℃,150 rpm),利用无菌滤膜加入青藤碱盐酸盐水溶液1 mL(20 mg/mL),同样条件下继续培养4 d,停止培养。将发酵液过滤,滤液用NH3·H2O 调节pH 值至10.0,接着用CH2Cl2萃取(100 mL × 3),合并萃取液,无水Na2SO4干燥,过滤,旋转蒸干溶剂,得固体粉末。用少量CHCl3溶解,在GF254薄层层析硅胶板上以一定间距点样,展开剂为CHCl3-CH3OH(9∶1,V/V),254 nm 紫外灯下检测,观察紫色斑点位置及大小,确定是否存在转化。同样条件下,分别以培养过程中不添加青藤碱和不接入菌种作为空白对照。
2.6 转化产物的制备
活化7 d 的斜面菌种,转接到200 mL 的发酵培养基(SPM)中,恒温振荡器上培养4 d(25 ℃,150 rpm),利用无菌滤膜加入青藤碱盐酸盐水溶液1 mL(20 mg/mL),同样条件下继续培养4d,停止培养。将发酵液过滤,滤液用NH3·H2O 调节pH 值至10.0,接着用CH2Cl2萃取(200 mL × 3 × 10),合并萃取液,无水Na2SO4干燥,过滤,旋转蒸干溶剂,得固体粉末。经硅胶层析柱、HPLC 半制备柱分离,得转化产物。
3 结果与分析
3.1 青藤碱生物转化菌株的筛选
从青风藤[Sinomenium acutum(Thunb)Rehd.et Wils.]、夹竹桃(Nerium oleander)、朵云(Botrychium daucifoltum Woll)、蛇菰(Balanophora japonica)四种植物组织中利用传统的划线分离方法共分得植物内生菌84 株,保藏在天然产物研究与利用湖北省重点实验室微生物菌种库,暂未做鉴定。采用PDY 液体发酵方式,将青藤碱与84 株菌株分别进行共培养,筛选出7 株具有青藤碱转化能力的微生物菌株,菌株编号分别为JZT01、JZT11、DY10、SD04、SD06、BY09、Q08。其转化产物经薄层色谱分析(图2),7株菌株在青藤碱转化能力上大致分为四种类型:(1)菌株Q08 具有完全转化青藤碱的能力,且转化产物单一,经TLC 分析初步鉴定为(S)-disinomenine;(2)菌株JZT11 和DY10 具有完全降解青藤碱的能力,青藤碱被代谢成小分子后可能作为碳、氮源被微生物生长所消耗;(3)菌株SD06、SD04 和BY09 具有部分转化青藤碱的能力。这三株菌株与青藤碱共培养4 d 后,青藤碱并未完全转化成代谢产物,经TLC 分析,初步鉴定转化产物均为(S)-disinomenine 和(R)-disinomenine,其中(S)-disinomenine 为主要产物;(4)菌株JZT01 具有较弱的青藤碱转化能力,经TLC 分析,转化产物非(S)-disinomenine 和(R)-disinomenine,可能是一种具有新结构的代谢产物。但是,该菌株代谢青藤碱的酶活较低,如何通过代谢调控提高酶活力,从而加速青藤碱的转化速度,将是课题组后续努力方向之一。
3.2 青藤碱生物转化产物的分离与结构鉴定
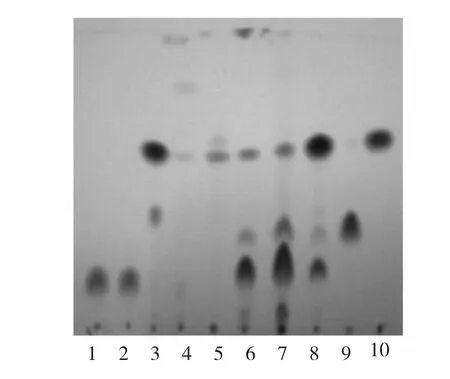
图2 青藤碱转化产物薄层色谱(TLC)分析Fig.2 TLC analysis of sinomenine and its metabolites
为了进一步确认菌株SD06、SD04 和BY09 转化青藤碱的产物为(S)-disinomenine 和(R)-disinomenine,选取菌株SD04 进行放大培养,加入青藤碱盐酸盐总计530 mg,共获得转化产物粗提物600 mg,经硅胶层析柱吸附,CH2Cl2-CH3OH(9∶1,V/V)淋洗,得转化产物S1(250 mg,产率50%,按青藤碱加入量计算),转化产物S2(100 mg,产率20%,按青藤碱加入量计算)。对菌株SD04 与青藤碱共培养的转化产物经过系统分离及NMR 鉴定,确定青藤碱被真菌SD04 转化为两种代谢产物S1 和S2,分别为(S)-disinomenine 和(R)-disinomenine。
化合物S11H NMR(400 MHz,CDCl3)δ:6.27(s,1H),6.26(brs,1H),5.45(d,J=1.7 Hz,1H),4.41(d,J=15.5 Hz,1H),3.75(s,3H),3.52(s,3H),3.09(t,J=4.0 Hz,1H),3.06(brs,1H),2.56(dd,J=2.6,11.8 Hz,1H),2.49(d,J=15.6 Hz,1H),2.43(dd,J=5.4,18.8 Hz,1H),2.34(s,3H),2.33(d,J=18.8 Hz,1H),2.19(td,J=2.8,11.9 Hz,1H),2.03(d,J=12.3 Hz,1H),1.93(dd,J=4.4,12.8 Hz,1H);13C NMR(100 MHz,CDCl3)δ:193.9,152.4,144.8,143.7,130.5,127.7,123.2,115.0,110.6,56.2,55.9,54.7,49.2,47.1,45.7,42.9,40.8,35.8,23.8;ESI-MS m/z 657[M +H]+。NMR 数据与文献[6]对照,鉴定化合物S1 为(S)-disinomenine。
化合物S21H NMR(400 MHz,CDCl3)δ:6.44(s,1H),5.30(brs,1H),4.43(d,J=15.7 Hz,1H),3.80(s,3H),3.52(s,3H),3.02-2.94(m,2H),2.60-2.42(m,3H),2.30(s,3H),2.12-1.96(m,2H),1.90(td,J=4.2,12.4 Hz,1H),1.77(dd,J=5.0,18.8 Hz,1H);13C NMR(100 MHz,CDCl3)δ:193.8,152.3,145.0,143.9,130.8,128.0,123.1,114.7,109.4,56.2,56.0,54.3,49.1,47.2,45.5,43.0,40.6,35.6,22.5;ESI-MS m/z 657[M+H]+。NMR 数据与文献[6,7]对照,鉴定化合物S2 为(R)-disinomenine。
菌株JZT01 与青藤碱共培养(0.15 mg/mL)5 d后得发酵液4 L,经调碱、萃取得浸膏200 mg,硅胶层析柱分离得转化产物S3(5 mg,产率0.8%,按青藤碱加入量计算)。
化合物S3 淡黄色,无定型粉末,分子式为C19H23NO5,分子量与青藤碱相比,增加16。化合物1H NMR 显示化合物S3 含有22 个质子信号(未见苯环羟基质子信号),包括2 个偶联的芳基质子信号δ 6.70(d,J=8.4 Hz,1H)和δ 6.54(d,J=8.4 Hz,1H);1 个烯烃质子信号δ 5.38(d,J=2.0 Hz,1H);2 个甲氧基质子信号δ 3.83 (s,3H)和δ 3.49(s,3H);1 个氮甲基质子信号δ 3.290(s,3H);联合质子偶联常数及HMQC 谱可分辨4 个亚甲基质子信号δ 1.86(d,J=13.2 Hz,1H)和δ 2.67(dd,J=4.4,13.2 Hz,1H),δ 2.60(d,J=15.2 Hz,1H)和δ 4.37(d,J=15.2 Hz,1H),δ 2.89(td,J=3.2,12.4 Hz,1H)和δ 3.12(dt,J=2.0,12.4 Hz,1H),δ 3.06(d,J=19.2 Hz,1H)和δ 3.293(dd,J=5.6,19.2 Hz,1H);2 个次甲基质子信号δ 4.39(brs,1H)和δ 3.67(t,J=4.4 Hz,1H)。13C NMR 显示化合物S3 含有19 个碳信号,包括2 个苯环烯碳信号δ 118.5 和δ 113.1;1 个烯碳信号δ 109.9;2 个次甲基碳信号δ 73.4 和δ 38.9;3 个甲基碳信号δ 58.2、56.2 和55.0;4 个亚甲基碳信号δ 61.3、47.7、31.6 和29.1;7 个季碳信号。与青藤碱分子NMR 谱图相比,可见9、14、16 和17 位的质子信号和碳信号明显移向低场,其他碳氢信号与青藤碱基本一致,说明在这4 个位置的中心碳原子上插入了杂原子。结合上面数据分析,可以推测在基团NCH3的氮原子上插入了氧原子,形成了N 氧化物。NMR 数据与文献[10]对照,鉴定化合物S3 为sinomenine N-oxide。
化合物S31H NMR(400 MHz,CDCl3)δ 6.70(d,J=8.4 Hz,1H),6.54(d,J=8.4 Hz,1H),5.38(d,J=2.0 Hz,1H),4.39(brs,1H),4.37(d,J=15.2 Hz,1H),3.83(s,3H),3.67(t,J=4.4 Hz,1H),3.49(s,3H),3.293(dd,J=5.6,19.2 Hz,1H),3.290(s,3H),3.12(dt,J=2.0,12.4 Hz,1H),3.06(d,J=19.2 Hz,1H),2.89(td,J=3.2,12.4 Hz,1H),2.67(dd,J=4.4,13.2 Hz,1H),2.60(d,J=15.2 Hz,1H),1.86(d,J=13.2 Hz,1H);13C NMR(100 MHz,CDCl3)δ:193.0,152.7,146.0,145.2,125.4,121.2,118.5,113.1,109.9,73.4,61.3,58.2,56.2,55.0,47.7,39.4,38.9,31.6,29.1;ESI-MS m/z 345.9[M +H]+。
4 结论
本文建立了药用植物内生菌对青藤碱的生物转化模型,利用薄层色谱(TLC)及NMR 技术对转化产物进行了结构确认,为(S)-disinomenine、(R)-disinomenine 和sinomenine N-oxide。所得微生物对青藤碱的转化多以双青藤碱为唯一类型的转化产物,这可能与青藤碱的刚性结构及4 位羟基有关。青藤碱的刚性结构可能阻碍了与微生物酶的结合,而青藤碱4 位羟基易被微生物体内的氧化酶氧化形成偶联产物,双青藤碱的形成进一步加剧底物与酶的结合位阻,多方面的原因导致转化产物结构类型单一。为了获得结构丰富的微生物转化产物,在共培养过程中,加入氧化酶抑制剂或者改变底物结构(如保护青藤碱4 位羟基)将是我们以后的研究方向。Sinomenine N-oxide 首次报道见于2005 年秦国伟教授等人从植物Sinomenium acutum 中分离得到,青藤碱在H2O2存在的条件下,也会发生氧化反应生成该化合物[10]。课题组在前期的研究过程中,发现邻苯二胺能诱导真菌Antrodiella semisupina 转化青藤碱为Sinomenine N-oxide,其生成机制不明确[11]。本文发现了一种真菌与青藤碱共培养,在无任何诱导剂存在的情况下,可以直接氧化青藤碱为Sinomenine N-oxide,可为氮氧化物合成酶及类似酶促反应提供一定参考价值。
1 Wang QX,Li XK.Immunosuppressive and anti-inflammatory activities of sinomenine.Int Immunopharmacol,2011,11:373-376.
2 Lou YT,Zhou HB,Zou J,et al.Modification of poorly bioactive sinomenine into more potent immunosuppressive agents by embedding of drug-like fragments.Tetrahedron Lett,2010,51:485-488.
3 Xiao J(肖靓),Deng ZS(邓张双),Li JX(李建新),et al.Sinomenine based molecular design of anti-RA agents.J Huazhong Normal Univ,Nat Sci(华中师范大学学报,自科版),2009,43:83-91.
4 Bruce NC,Boonstra B,Rathbone DA.Engineering novel biocatalytic routes for production of semisynthetic opiate drugs.Biomol Eng,2001,18(2):41-47.
5 Chen L(陈磊),Liu Y(刘怡),Lu JQ(卢建秋),et al.Synthesis of hydroxy-sinomenine by microbial transformation and optimization of its transformation conditions.J Beijing Univ TCM (北京中医药大学学报),2008,31:702-704.
6 Deng ZS,Li JX,Teng P,et al.Biocatalyzed cross-coupling of sinomenine and guaiacol by Antrodiella semisupina.Org Lett,2008,10:1119-1122.
7 Deng ZS,Zhao Y,He CC,et al.pH-Dependent,stereoselective dimerization of sinomenine.Org Lett,2008,10:3879-3882.
8 Teng P,Liu HL,Deng ZS,et al.Synthesis and biological evaluation of unique stereodimers of sinomenine analogues as potential inhibitors of NO production.Bioorg Med Chem,2011,19:3096-3104.
9 Joyeau R,Planchon M,Abessolo J,et al.Combinatorial approach to the selection of active microorganisms in biotransformation:Application to sinomenine.J Mol Catal B-Enzym,2013,85-86:65-70.
10 Bao GH,Qin GW,Wang R,et al.Morphinane alkaloids with cell protective effects from Sinomenium acutum.J Nat Prod,2005,68:1128-1130.
11 Xiao L(肖靓),Deng ZS(邓张双),Li JX(李建新),et al.Induced biotransformation of sinomenine by phenylenediamine.J Huazhong Univ of Sci & Tech,Nat Sci(华中科技大学学报,自科版),2009,37(8):125-128.
