N-氨甲酰谷氨酸对断奶环江香猪肠道微生物区系的影响
2014-01-09周笑犁连国琦孔祥峰王升平印遇龙
周笑犁,连国琦,孔祥峰,3*,王升平,印遇龙
1中国科学院亚热带农业生态研究所,中国科学院亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术研究中心,长沙 410125;2 南昌大学生命科学与食品工程学院,食品科学与技术国家重点实验室,南昌 330047;3 中国科学院环江喀斯特农业生态试验站,环江 547100
新生仔猪的肠道菌群发育快速并趋于稳定,但断奶极易破坏肠道微生态平衡,使病原菌大量繁殖,引起仔猪的腹泻、生长不良、消化功能紊乱和免疫力下降等[1]。大量研究表明,外源补充精氨酸能调节机体氨基酸的吸收和代谢,并促进其肠道发育和功能[2],增强肠道健康,从而提高机体免疫力[3],上述作用可能与其对肠道微生物的调控有关[4]。但是,外源性精氨酸在养猪生产中的应用一直受到价格因素的制约。因此,通过调控内源性精氨酸的合成增加机体内精氨酸的供给是一种经济、有效的策略。N-氨甲酰谷氨酸(NCG)作为尿素循环中鸟氨酸生成瓜氨酸的中间体N-乙酰谷氨酸的类似物,可有效激活内源性精氨酸的合成[2]。在饲料中添加NCG可显著提高平均日增重、降低料重比,增强机体免疫力,提高背最长肌、腓肠肌和十二指肠蛋白质的合成率[5];在日粮中添加0.1%NCG 可促进环江香猪肠道对营养物质的吸收,改善机体氨基酸平衡和蛋白质代谢,提高生长性能和饲料报酬[6]。可见,在日粮中添加适量NCG 对提高机体的营养状况、降低生产成本具有重要现实意义。日粮中添加NCG 是否通过调控肠道微生态而对断奶仔猪发挥上述有益作用,目前尚未见相关报道。本研究观察了日粮中添加NCG 对断奶环江香猪肠道微生物区系的影响,为阐明NCG 的促生长机制提供依据。
1 材料与方法
1.1 试验材料
选用体重为3.17 ±0.21 kg 的21 日龄断奶环江香猪12 头,随机分为2 组,每组6 头,单栏饲养。按中国地方猪营养需要量并结合NRC(1998)营养需要量配制本试验基础日粮[7]。试验组在基础日粮中添加0.1%的NCG(含量50%),对照组饲喂基础日粮。日粮中加入2 倍水后,调成粥状饲喂。每日饲喂3 次,自由采食和饮水。预饲3 d 后,逐头称取空腹体重。因断奶后14 d 断奶应激基本消失,故本试验试验期为14 d。
1.2 肠道内容物采集与微生物DNA 提取
试验结束后放血处死仔猪,无菌采集回肠和盲肠内容物,提取总细菌[1]。将提取的细菌于-70 ℃保存。按试剂盒说明提取细菌基因组总DNA(TIANGEN 公司),采用NanoDrop®ND1000(Nano-Drop Technologies Inc.,DE,USA)测定DNA 浓度,并以OD260/280 评价DNA 纯度。
1.3 肠道微生物T-RFLP 分析
PCR 扩增l6S rRNA 全长,以获得微生物总DNA 作为模板。用6-羧基荧光标记的细菌通用引物8F 5’-6-FAM-AGA GTT TGA TCC TGG CTC AG-3’和1492R 5’-GGT TAC CTT GTT ACG ACT T-3’扩增。50 μL 的扩增体系中包括2.5 ng DNA 模板,5 μL 10 ×LA PCR buffer II(含Mg2+),8 μL 2.5 mM dNTP mixture,20 μM 引物,0.5 μL 5 U/μL LA Taq(TaKaRa,Japan)。PCR 反应条件为:预变性95 ℃,5 min;95 ℃60 s,56 ℃60 s,72 ℃90 s,30 个循环;72 ℃延伸10 min。取1.0 μg 扩增反应产物,分别加入12 U 限制性内切酶Hae III(TaKaRa,Japan)及相应缓冲液和超纯水,使反应体系为20 μL,37 ℃过夜温育。ABI3100 毛细管电泳自动序列分析仪(PE Biosystems,Warrington,UK)分析荧光标记的末端限制性片段(TRF),此步骤交由上海桑尼生物科技有限公司完成。
1.4 肠道微生物PCR-DGGE 分析
根据Walter 等[8]提供的细菌通用引物,对DNA样品中的16S rRNA 基因V2~V3 段进行PCR 扩增。PCR 反应体系的配置、扩增程序和反应条件均参照Yin 等[1]的报道。采用BioRad DGGE 试剂盒对PCR 扩增产物进行DGGE 分析。电泳采用Dcode DGGE 系统(Bio Rad),电泳缓冲液为1 ×TAE 缓冲液,在100 V 电压下60 ℃电泳16 h,采用Molecular Analyst(Bio Rad)对DGGE 凝胶进行相似性分析。
1.5 肠道微生物荧光定量PCR 分析
采用SYBR Green I 染料法,在RT-PCR 仪(ABI7 900HT)上进行扩增,并运用Applied Biosystem SDS 2.3 进行数据分析。10 μL 反应体系包括:5 μL 2 ×SYBR Green PCR Master Mix(TaKaRa,Japan),0.2 μL ROX(TaKaRa,Japan),0.2 μL 10 μM上、下游引物(表1),2 μL DNA 模板,ddH2O 补充至10 μL。PCR 反应程序为:95 ℃,30 s;95 ℃5 s、60℃30 s,40 个循环。基于16S rRNA 基因相对定量分析样品中的双歧杆菌、乳酸杆菌、链球菌、大肠埃希菌和总细菌,采用2-△△CT法[9]统计目的基因的表达量,即以总细菌为内参,待测细菌表达量(以-△△CT 表示)=(CT,Target-CT,总细菌)试验组-(CT,Target-CT,总细菌)对照组。

表1 肠道部分微生物引物参数Table 1 Parameters of primer for several intestinal microflora

1.6 数据处理与分析
数据以平均值±标准误表示,利用SPSS 软件进行统计分析和t 检验。P <0.05 表示差异显著。
2 结果与分析
2.1 NCG 对肠道微生物多样性的影响
由表2 可见,回肠和盲肠内容物中微生物的TRF 数变化显著;与对照组相比,0.1%NCG 组回肠内容物微生物的TRF 数增加,提示肠道微生物的多样性提高。

表2 日粮添加NCG 对肠道微生物酶切末端限制性片段的影响(%;n=6)Table 2 Effects of diet supplemented with NCG on intestinal microflora TRFs(%;n=6)

图1 日粮添加NCG 后回肠内容物微生物16S rRNA 的DGGE 图谱(a)、相似性分析(b)和电泳条带示意图(c)Fig.1 DGGE profiles(a),similarity index(b)and sketch map(c)of 16S rRNA obtained from intestinal microflora in ileum contents after dietary supplementation with NCG

图2 日粮添加NCG 后盲肠内容物微生物16S rRNA 的DGGE 图谱(a)、相似性分析(b)和电泳条带示意图(c)Fig.2 DGGE profiles(a),similarity index(b)and sketch map(c)of 16S rRNA obtained from intestinal micro flora in cecum contents after dietary supplementation with NCG
由图1a 和图1c 可见,NCG 组回肠内容物中微生物DGGE 条带数(14.7 ±1.6)较对照组(12.2 ±1.0)有增加趋势,说明日粮添加NCG 可增加试猪回肠微生物菌群的多样性;由图2 可见,对照组和NCG 组盲肠内容物中微生物区系的相似性达60%以上。
2.2 NCG 对肠道部分细菌数量的影响
由表3 可见,饲喂0.1%NCG 14 d 后,回肠和盲肠内容物中双歧杆菌和乳酸杆菌的数量显著增加、大肠埃希菌的数量显著降低(P <0.05),盲肠内容物中链球菌的数量也显著降低(P <0.05)。
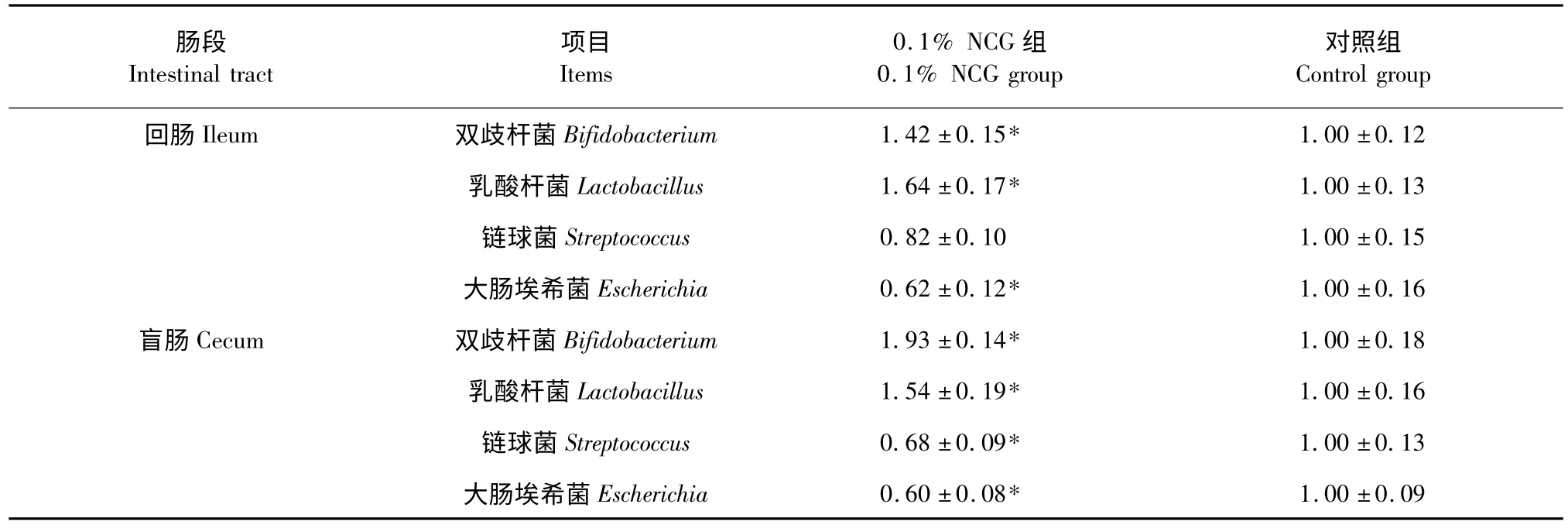
表3 日粮添加NCG 对肠道部分细菌16S rRNA 的影响(n=6)Table 3 Effects of diet supplemented with NCG on16S rRNA of several intestinal bacteria(n=6)
3 讨论
动物消化道内栖居着大量微生物,形成复杂而动态平衡的微生物区系,这对宿主的健康和营养物质的消化吸收起着重要作用。如果微生态平衡失调,机体的生理功能就会发生紊乱,导致疾病的发生。肠道中的大多数微生物为未知的、未被培养或不可培养的。分子生物学技术能有效分析复杂微生物群落及其多样性且无须培养微生物,从而越来越受到重视,是近年来用于多种生态环境微生物区系研究的最主要的分子生物学手段之一。本研究利用T-RFLP、PCR-DGGE 和荧光定量PCR 等技术研究了日粮添加NCG 对肠道菌群的影响,发现添加后仔猪小肠微生物菌群的多样性增加。一般认为,当仔猪肠道微生物多样性越高时,其稳定性也就越好,该系统愈难以因外界因素变化而失调,而一个稳定的肠道微生态系统无疑对仔猪健康是有利的。最新研究发现,精氨酸作为微生物的主要氮源,可提高小肠微生物的多样性;在微生物分泌酶作用下,精氨酸可被分解成鸟氨酸和瓜氨酸等,进而影响机体对氨基酸的利用和代谢[10]。本研究显示,NCG 可增加仔猪小肠微生物区系的稳定性,这可能是其促进机体氨基酸吸收和利用的机制之一[6]。
大肠埃希菌和沙门氏菌是仔猪肠道的正常菌群。仔猪出生后,乳酸杆菌可很快在肠道内定殖并成为优势菌;断奶后,肠道菌群发生紊乱,大肠埃希菌等致病菌增加,乳酸杆菌等有益菌下降。如果断奶后肠道中优势菌属于致病性的大肠埃希菌和链球菌属细菌,就会引起仔猪腹泻甚至死亡。本试验结果表明,在日粮中添加NCG 可不同程度地抑制回肠和盲肠内容物中大肠埃希菌的生长,而提高回肠和盲肠中乳酸杆菌和双歧杆菌的增殖。由于大肠埃希菌对肠壁的黏附是其发挥作用的主要条件,推断乳酸杆菌和双歧杆菌在肠黏膜上的占位在一定程度上减少了大肠埃希菌的数量,从而减轻了大肠埃希菌对肠道的不良影响。由于肠道微生物中存在精氨酸酶和精氨酸脱亚胺酶两条代谢通路,提高了胞外精氨酸家族氨基酸的浓度,从而调节精氨酸家族氨基酸在小肠黏膜细胞的代谢[4,10],提示NCG 可能作用于微生物中的这两条代谢通路,促进肠道对营养物质的吸收,改善机体氨基酸平衡,从而缓解环江香猪的断奶应激。
综上所述,日粮添加NCG 可增加断奶环江香猪肠道菌群的多样性,抑制大肠埃希菌、链球菌等有害菌的繁殖,促进乳酸杆菌、双歧杆菌等有益菌的繁殖。
1 Yin FG(尹富贵),Yin YL(印遇龙),Kong XF(孔祥峰),et al.Effect of Acanthopanax senticosus extracts on gut microflora in early-weaned piglets.Nat Prod Res Dev(天然产物研究与开发),2007,19:545-549.
2 Zhou XL(周笑犁),Tang WJ(汤文杰),Kong XF(孔祥峰),et al.Effects of arginine on nutrient digestibility and blood parameters in Huanjiang mini-pigs.Acta Agri Borea Sin(华北农学报),2012,27:234-238.
3 Bo MJ(柏美娟),Kong XF(孔祥峰),Yin YL(印遇龙),et al.Regulation of dietary supplemental arginine on immune response in fattening pigs.J Yangzhou Univ Agric Life Sci(扬州大学学报,农业与生命科学版),2009,30(3):45-50.
4 Dai LZ,Li XL,Xi PB,et al.Regulatory role for L-arginine in the utilization of amino acids by pig small-intestinal bacteria.Amino Acids,2012,43:234-244.
5 Wang C(王琤),Qu MR(瞿明仁),You JM(游金明),et al.Effects of N-carbamoylglutamate on growth performance,nutrient digestibility and serum free amino acids of weaned piglets.Chin J Anim Nutr(动物营养学报),2010,22:1012-1018.
6 Zhou XL(周笑犁),Yin YL(印遇龙),Kong XF(孔祥峰),et al.Effects of N-carbamylglutamate on digestion and metabolism in huanjiang mini-pigs.Chin J Anim Nutr(动物营养学报),2011,23:1970-1975.
7 Liu JF(刘俊峰),Wu C(吴琛),Kong XF(孔祥峰),et al.Effects of dietary supplementation with arginine on growth and development of fetus in pregnant huanjiang mini-pigs.Scien Agric Sin(中国农业科学),2011,44:1040-1045.
8 Walter J,Tannock GW,Tilsala-Timisjarvi A,et al.Detection and identification of gastrointestinal Lacobacillus species by using denaturing gradient gel electrophoresis and speciesspecific PCR primers.Appl Environ Microbiol,2000,66:297-303.
9 Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CTmethod.Meth,2001,25:402-408.
10 Fernandez M,Zniga M.Amino acid catabolic pathways of lac-tic acid bacteria.Crit Rev Biotechnol,2006,32:155-183.
