吸附柱层析法制备纯化茶多酚中EGCG 单体
2014-01-08王伟涛马朝阳陈尚卫娄在祥王洪新
王伟涛,马朝阳,陈尚卫,朱 松,娄在祥,王洪新,*
1 江南大学食品学院;2食品科学与技术国家重点实验室,无锡 214122
表没食子儿茶素没食子酸酯[(-)-Epigallocatechin Gallate,EGCG]是儿茶素类的主要成分,具有良好的功能特性,如防突变、抗癌、抗病毒、抗氧化、抑制生物膜、神经保护、调节代谢、消炎、抑菌等[1]。EGCG 已被应用于食品、化妆品、医药、精细化学品、保健品等各个领域。因此,寻找一条适合大规模生产、环境友好型的制备EGCG 单体工艺显得十分必要。目前,制备纯化EGCG 单体的途径主要有色谱柱层析技术,如高速逆流色谱、制备液相色谱、硅胶柱色谱、离子交换或凝胶色谱、模拟移动床色谱以及膜分离技术等[2-5]。这些技术在能得到高纯度EGCG 同时,也存在一定不足,填料成本高且使用次数有限,设备成本高昂,洗脱系统多采用三氯甲烷、乙酸乙酯等溶剂,存在残留等安全问题等。而吸附柱色谱[3,6-8]相比其他方法,具有重复利用次数多,生产成本低,溶剂系统环保安全等优点越来越受到研究者们的关注。
本研究采用吸附树脂柱层析进行EGCG 单体分离纯化,通过考察所选树脂对儿茶素的吸附分离情况,选择合适的分离填料进行EGCG 单体纯化。旨在开发一种绿色、环保,溶剂系统安全,适于工业化生产的生产工艺。
1 仪器与材料
茶多酚原料(批号TP081001-1032,四川宜宾)。EGCG、ECG、EGC、C、CA 标准品(成都曼思特生物科技有限公司,批号分别为A0159、A0160、A0161、A0158,A0470),EC 标准品(中国药品生物制品检定所,110878-200102),纯度经检测均大于98%。
吸附树脂LX-68、LX-5B、LX-8、LX-2000、XDA-1(西安蓝晓科技新材料股份有限公司),ADS-5c、ADS-21(天津南开和成科技有限公司),PA(国药集团化学试剂有限公司),HP-20(日本三菱化学),AB-8、ADS-7、ADS-17、HPD-826(沧州宝恩吸附材料科技有限公司),各树脂特性参数见表1。
BT100-2J 蠕动泵(保定兰格恒流泵有限公司),SHB-3 型循环水多用真空泵(郑州杜甫仪器厂),BC-R202B 旋转蒸发器(上海贝凯生物化工有限公司),DZF-6050 真空干燥箱(上海一恒科学仪器有限公司),Waters 1525 高效液相色谱仪及配套设备(Waters Co.Ltd.USA),乙腈(色谱纯,江苏汉邦科技有限公司),甲醇(色谱纯,江苏汉邦科技有限公司),冰乙酸(国药集团化学试剂有限公司),95%乙醇(国药集团化学试剂有限公司),超纯水纯化系统(Millipore,USA)。

表1 树脂特性参数Table 1 Characteristic parameters of resin used
2 提取与分离
2.1 茶多酚、儿茶素含量的测定
茶多酚含量测定参照行业标准QB 2154-1995。
儿茶素含量测定:Waters 1525 高效液相色谱仪,色谱柱:Grace Smart RP 色谱柱(C18填料,5 μm,4.6 ×250 mm);检测器:Waters 2489 UV/visible detector;流动相:A:10%乙腈+0.5%乙酸,B:30%乙腈+0.5%乙酸,梯度洗脱程序:0~14 min:100%~50%A,14~20 min:50%~100% A,20~25 min:100%~100% A;流速:1.0 mL/min;检测温度:30℃;检测波长:280 nm;进样量:5 μL。
2.2 吸附树脂的筛选
取预处理的树脂(干重当量1.0 g)加到20 mL原料液(20 mg/mL)中,303.15 K 下于恒温水浴摇床振荡(120 rpm)12 h 至吸附平衡。过滤吸附后树脂,80%乙醇解吸,恒温水浴摇床振荡(120 rpm)12 h 至解吸平衡,考察树脂对各儿茶素的吸附容量、吸附率、解吸率和吸附选择因数。
树脂对EGCG 吸附容量的计算采用:

其中qe为吸附平衡时对儿茶素的吸附容量(mg/g 干树脂),C0、Ce分别是儿茶素起始和平衡状态浓度(mg/mL),V0、V1分别是原料液体积以及吸附后的溶液体积(mL),W 是树脂干重当量(g)。
根据下式计算树脂对儿茶素的吸附率、解吸率及吸附选择因数:
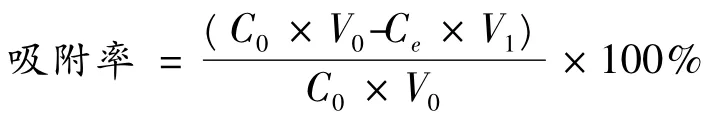
其中,C1为解吸液中目标物浓度(mg/mL),V2为解吸液体积(mL),qe为目标物吸附容量(mg/g 干树脂),W为树脂干重当量(g),RA和RB分别为EGCG 和其他儿茶素在各树脂上的吸附容量(mg/g),CA和CB分别为EGCG 和其他儿茶素吸附平衡浓度(mg/mL)。
2.3 LX-8 树脂柱层析初步纯化
2.3.1 上样浓度的确定
室温下,茶多酚原料(200、250、300、350 mg/mL)上LX-8 柱(Φ30 mm × 500 mm,柱体积245 mL),流速1.5 BV/h。分部收集,检测其中各儿茶素浓度,计算保留在柱子上的EGCG 量,确定上样浓度。
2.3.2 动态吸附量的测定
室温下,茶多酚原料(300 mg/mL)上LX-8 柱,流速分别为0.5 BV/h、1.0 BV/h、1.5 BV/h、2.0 BV/h。分部收集流出液,检测各儿茶素浓度,以EGCG 浓度对流出液体积作动态吸附曲线图,确定上样流速及动态上样量。
2.3.3 洗脱梯度及体积的确定
取茶多酚溶液,1.5 BV/h 的流速上LX-8 柱,水洗后采用5%、10%、15%、20%、25%、30%、35%、40%的乙醇溶液各600 mL(2.5 BV)以1.5 BV/h 的流速洗脱,将各组分洗脱液浓缩干燥后测定其中各儿茶素含量,计算各部收率。以各儿茶素含量对乙醇浓度作洗脱梯度曲线,从而确定洗脱梯度及体积。
2.3.4 产品制备
根据确定的洗脱梯度,取一定体积的茶多酚溶液,上LX-8 柱(Φ40 mm ×600 mm,Φ30 mm ×500 mm),吸附完毕后,梯度洗脱。水洗后,采用不同浓度乙醇洗脱液分别进行浓缩、真空干燥得到相应产品,取不同成分样品HPLC 分析其中儿茶素的浓度。分别计算其得率、回收率。
2.4 HP-20 树脂二次纯化
2.4.1 上样浓度的确定
取一定量HP-20 树脂(干重当量5.0 g)于锥形瓶中,加入不同浓度(C0=10.0、15.0、20.0、25.0和30.0 mg/mL)的LX-8 柱25%组分(200 mL),恒温(298.15 K)水浴振荡4 h,分析吸附后溶液中的各儿茶素含量,计算吸附量,确定上样浓度。
2.4.2 动态吸附量的测定
室温下,以LX-8 柱25%乙醇洗脱组分上HP-20柱(Φ30 mm×500 mm,柱体积为210 mL),流速分别为0.5、1.0、1.5、2.0 BV/h。分部收集流出液,检测其中各儿茶素浓度,以EGCG 浓度对流出液体积作HP-20 树脂动态吸附曲线图,确定上样流速及动态上样量。
2.4.3 洗脱梯度及体积的确定
取LX-8 柱25%组分,1.5 BV/h 的流速上HP-20 柱,待吸附完毕后依次采用5%、10%、15%、20%、40%的乙醇溶液550 mL(2.5 BV)以1.5 BV/h 的流速洗脱,将各组分洗脱液浓缩干燥后测定其中各儿茶素的含量,计算各部收率,从而确定洗脱梯度及体积。
2.4.4 产品制备
根据确定的洗脱梯度,以LX-8 柱40%组分上HP-20 柱,进行梯度洗脱。将不同浓度乙醇洗脱液分别浓缩、真空干燥得到相应产品,分析其中儿茶素的浓度。分别计算其得率、回收率。
3 结果与讨论
3.1 吸附树脂的筛选
合适的分离填料应能选择性吸附某一种或几种儿茶素单体,以实现不同单体之间的分离。图2 为不同树脂对几种儿茶素单体的吸附容量、吸附率及解吸率。LX-68、LX-5B、LX-8、XDA-1、ADS-21 和PA对儿茶素的吸附容量均高于其他几种,但LX-68、LX-5B、XDA-1 和ADS-21 等对儿茶素的吸附率差别不大,且各儿茶素单体在ADS-21 树脂上的解吸率仅为35%~55%;因此,以上四种树脂是不适合用来选择分离儿茶素单体的。而PA 和LX-8 对酯化和非酯化形式的儿茶素均具区分效果,以LX-8 较好,且较PA 的吸附量高。LX-2000、ADS-5c、HP-20、AB-8、HPD-826、ADS-7、ADS-17 等对酯化形式儿茶素中的EGCG 和ECG 具较好的选择吸附效应。因此可先由LX-8 进行儿茶素初步纯化,再采用LX-2000、ADS-5c、HP-20、AB-8、HPD-826、ADS-7、ADS-17 中的一种或几种进行二次纯化。

图2 不同树脂对各儿茶素的吸附容量、吸附率及解吸率Fig.2 Adsorption capacity,adsorption ratio and desorption ratio of catechins on different resins
EGCG 对其他儿茶素单体的选择吸附因数在选用的几种树脂上有一定的区别(表2)。其中,ADS-7、AB-8、HP-20 等具较好的选择性,以HP-20 稍高。因此,我们选择LX-8 和HP-20 进行后续实验。

表2 EGCG 对其他几种儿茶素单体的选择吸附因数Table 2 Selectivity coefficient of EGCG towards other catechin monomers
3.2 LX-8 树脂柱层析初步纯化
3.2.1 上样浓度的确定
随上样浓度增大,单位体积树脂柱上保留的EGCG 量呈现先增加后趋于平稳(图3)。上样浓度为300.025 mg/mL,树脂柱上的EGCG 保留量达到81.889 mg/mL;继续增大上样浓度,保留量未见明显增加。因此,选择上样浓度为300 mg/mL。

图3 不同上样浓度下EGCG 在LX-8 树脂柱上的保留量Fig.3 Adsorption amount of EGCG on LX-8 resin column with different sample concentration
3.2.2 动态吸附量的测定
不同上样流速下得到的吸附泄漏曲线如图4,上样流速为0.5、1.0、1.5 BV/h 时得到的泄漏点上样体积分别为90、60、50 mL,而2.0 BV/h 时得到的为15 mL。上样流速决定着泄漏点上样体积的大小,较小的流速可增加上样体积,但会增加操作时间,太快易导致过早泄漏;因此,选择上样流速为1.5 BV/h,上样体积为50 mL。
3.2.3 洗脱梯度及体积的确定

图4 EGCG 在LX-8 树脂柱上的吸附泄漏曲线Fig.4 Adsorption permeation curve of EGCG on LX-8 resin column
不同浓度乙醇梯度洗脱后各组分中儿茶素含量见图5。经5%、10%、15%乙醇梯度洗脱可将非酯化形式儿茶素完全解吸,之后酯化形式儿茶素开始解吸。25% 的乙醇组分中EGCG 含量最高,为65.85%,得率为15.23%。因此,采用洗脱梯度:10%乙醇洗脱6 BV,25%乙醇洗脱6 BV,80%乙醇洗脱4 BV。

图5 不同浓度乙醇梯度洗脱组分中各儿茶素含量Fig.5 Catechins content of ethanol solution step-gradient elution
3.2.4 产品制备
按洗脱梯度进行梯度洗脱,得到不同浓度乙醇组分产品,其中各儿茶素含量、得率及收率见表3。

表3 不同浓度乙醇梯度洗脱制备产品Table 3 Fraction of ethanol solution step-gradient elution
吸附后的LX-8 柱经水洗除去未吸附组分后,10%乙醇洗脱6 BV 可将吸附的非酯化形式的儿茶素解吸下来,25%的乙醇洗脱组分中EGCG 的收率为61.21%。初步实现了非酯化形式和酯化形式儿茶素的分离。但25%乙醇洗脱组分中仍存在部分色素,会影响下一步产品纯化,因此考虑将制得的25%洗脱组分再次经LX-8 柱层析,以进一步提高其中的EGCG 纯度。采用40%乙醇洗脱5 BV 可将柱子上吸附的绝大部分EGCG 解吸下来,产品中EGCG 纯度得到了提高。
3.3 HP-20 树脂二次纯化
3.3.1 上样浓度的确定
静态吸附结果如图6 所示,随上样浓度增加,HP-20 对EGCG 的吸附量呈现增加趋势,浓度为20 mg/mL 时达到饱和吸附,吸附量不再增加。因此,确定上样浓度为20 mg/mL。
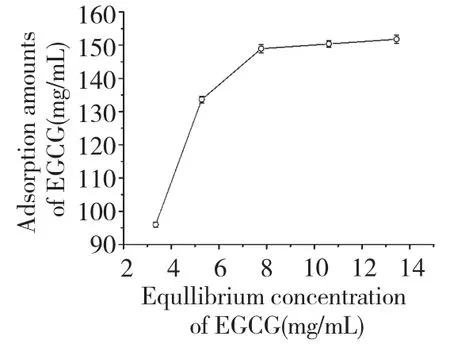
图6 EGCG 在LSA-10 树脂上的吸附等温线Fig.6 Static isotherm adsorption curves of EGCG on LSA-10

图7 EGCG 在HP-20 树脂柱上的吸附泄漏曲线Fig.7 Adsorption permeation curve of EGCG on HP-20 resin column
3.3.2 动态吸附量的确定
EGCG 在HP-20 树脂柱上的吸附泄漏曲线如图7 所示。上样流速为0.5、1.0、1.5 BV/h 时得到的泄漏点上样体积为400、350、300 mL,而2.0 BV/h时为200 mL。因此,选择流速1.5 BV/h,上样300 mL,即1.5 BV。
3.3.3 洗脱梯度及体积的确定
不同浓度乙醇洗脱组分中儿茶素含量如图8。15%乙醇组分中EGCG 含量最高,为85.70%,收率为35.65%,5%洗脱组分呈现深红色,EGCG 含量仅为69.73%。根据各组分中EGCG 收率,确定洗脱梯度为5%洗脱3 BV 以除去色素,15%洗脱6 BV将吸附的EGCG 解吸下来,采用80%洗脱3 BV 清洗柱子。

图8 不同浓度乙醇洗脱组分中儿茶素含量Fig.8 Catechins content of ethanol solution step-gradient elution
3.3.4 产品制备
按洗脱梯度及体积对HP-20 树脂柱洗脱,得到的各组分中儿茶素含量、得率及收率如表4 所示。

表4 不同浓度乙醇梯度洗脱制备产品Table 4 Fraction of ethanol solution step-gradient elution
5%乙醇洗脱3 BV 可将吸附的色素类成分解吸下来,15%的乙醇洗脱可将大部分EGCG 解吸下来,实现了EGCG 和ECG 的分离。
经过LX-8 树脂和HP-20 树脂柱层析后,由EGCG 含量50%的茶多酚原料可得到EGCG 纯度为93.16%的产品,且总收率为49.50%。相比文献[8]报道中的总收率(72.08%)略低,但文献报道中制得EGCG 产品纯度仅为68.32%,远低于本研究制得的EGCG 产品纯度。LX-8 柱层析时,柱体积为600 mL 的柱子装填LX-8(含水率70.74%)为336 g,上样茶多酚(EGCG 含量50%)原料27.5 g,单位体积树脂EGCG 负载量为139.86 mg/g 树脂干重当量。
HP-20 柱层析时,柱体积为245 mL 的柱子装填HP-20(含水率71.37%)为173 g,上样二次LX-8 柱层析后40%组分4.5 g,单位体积树脂EGCG 上样量为66.32 mg/g 树脂干重当量。
该工艺单位重量填料的EGCG 负载量高于文献中报道的负载量(20~50 mg/g),且洗脱溶剂仅为乙醇/水,溶剂系统安全、无残留且可实现循环利用,其使用成本较甲醇、乙酸乙酯、氯仿等溶剂低。该工艺是一种环境友好型工艺,有良好的应用前景。
3.4 结构表征
微红色粉末;熔点212~213 ℃;易溶于甲醇;分子式C22H18O11;ESI-MSm/z:457[M-H]-,169;红外光谱在1693 cm-1处强吸收为羰基伸缩振动峰;1H NMR (CD3OD,500 MHz)δ:4.95 (1H,s,H-2),5.52(1H,s,H-3),2.85 (2H,m,H-4a,H-4b),5.99 (2H,s,H-6,H-8),6.41 (2H,s,H-2',H-6'),6.83 (2H,s,H-3'',7'');13C NMR (CD3OD,125 MHz)δ:78.8(C-2),70.2 (C-3),27.0 (C-4),99.7 (C-6),96.8(C-8),96.2 (C-10),157.4 (C-5,C-9),157.9 (C-7),131.1 (C-1'),107.2 (C-2',C-6'),146.9 (C-3',C-5'),134.0 (C-4'),167.9 (C-1''),121.8 (C-2''),110.5 (C-3'',C-7''),146.5 (C-4'',C-6''),140.0 (C-5'')。与文献[2]对照产品鉴定为表没食子儿茶素-3-没食子酸酯(EGCG)。
4 结论
本研究以茶多酚(EGCG 含量50%)为原料,根据儿茶素单体的结构特征,选用极性和低(非)极性树脂进行选择性吸附分离。考察树脂对儿茶素的吸附容量、吸附率、解析率及吸附选择因数,选择LX-8树脂初步纯化后采用HP-20 树脂二次纯化。经LX-8 两步柱层析,1.5 BV/h 流速洗脱,40%乙醇洗脱5 BV 可得到纯度为73.06% 的EGCG 产品。以20 mg/mL 浓度的该产品上HP-20 柱,1.5 BV/h 洗脱,经5%乙醇洗3 BV,15%乙醇洗6 BV,80%乙醇洗3 BV 后,可制得纯度为93.16%,总收率为49.50%的EGCG 产品。该工艺单位重量填料的EGCG 负载量高于文献中报道的负载量,仅采用乙醇/水洗脱溶剂体系,溶剂系统安全、无残留且可实现循环利用,其使用成本较甲醇、乙酸乙酯、氯仿等溶剂低。有良好的应用前景,属于环境友好型工艺。
1 Singh BN,Shankar S,Srivastava RK.Green tea catechin,epigallocatechin-3-gallate (EGCG):mechanisms,perspectives and clinical applications.Biochem Pharmacol,2011,82:1807-1821.
2 Kumar N,Savitri RM.Separation of catechin constituents from five tea cultivars using high-speed counter-current chromatography.J Chromatogr A,2005,1083:223-228.
3 Ye JH,Wang LX,Chen H,et al.Preparation of tea catechins using polyamide.J Biosci Bioeng,2011,111:232-236.
4 Lai SM,Gu JY,Huang BH,et al.Preparative separation and purification of epigallocatechin gallate from green tea extracts using a silica adsorbent containing beta-cyclodextrin.J Chromatogr B Analyt Technol Biomed Life Sci,2012,887-888:112-121.
5 Wang S,Liang Y,Zheng S.Separation of epigallocatechin gallate from tea polyphenol by simulated moving bed chromatography.J Chromatogr A,2012,1265:46-51.
6 Wang CJ(王传金),Wei YY(魏运洋),Zhu GJ(朱广军).Preparation of high purity epigallocatechin gallate by polyamide packed chromatographic column separation.Chin J Appl Chem(应用化学),2007,24:443-447.
7 Ye JH,Jin J,Liang HL,et al.Using tea stalk lignocellulose as an adsorbent for separating decaffeinated tea catechins.Biores Technol,2009,100:622-628.
8 Gong ZH(龚志华),Huang T(黄甜),Pang YL(庞月兰),et al.Separation and purification of EGCg in catechins by HP-20 macroporous resin.J Hunan Agric Univ,Nat Sci(湖南农业大学学报,自科版),2010,36:87-91.
