局限期小细胞肺癌诱导化疗疗效与放疗时机的关系探讨*
2014-01-07刘维帅赵路军章文成袁智勇
刘维帅 赵路军 关 勇 章文成 袁智勇 王 平
小细胞肺癌(small cell lung cancer,SCLC)约占肺癌患者25%[1],而局限期小细胞肺癌患者约占SCLC患者的40%[2],其标准治疗方法是同步放化疗[3]。目前,多项研究表明放疗的尽早介入能带来更多的生存获益[4-6]。但在实际临床工作中,多数LSCLC患者因肿瘤体积较大或合并严重内科疾病等原因而先行2~3个周期诱导化疗后再行放疗。韩国Sun等[7]开展的一项关于LSCLC放疗时机的Ⅲ临床试验亦显示,2个周期诱导化疗后再行放疗组和化疗1个周期即同时联合放疗组之间生存上没有明显差异,但并发症前者却明显低于后者。
目前,对于行诱导化疗的LSCLC患者,尚未见放疗时机选择的报道。对于诱导化疗有效的患者,放疗介入时间的早晚对生存有无影响?诱导化疗后无效的患者,是否应该尽早行放疗呢?为此,本研究通过分析本院诱导化疗后行放疗的LSCLC患者临床资料,探讨诱导化疗疗效与放疗时机的关系,以期为行诱导化疗的LSCLC患者的临床治疗提供一定依据。
1 材料与方法
1.1 一般临床资料
回顾性分析天津医科大学肿瘤医院2009年1月至2011年12月诱导化疗后行3D-CRT或IMRT的148例LSCLC(美国退伍军人医院VALG分期标准)患者临床资料,所有患者均经病理学或细胞学证实为SCLC且按照(UICC 2009年)肺癌TNM分期重新进行临床分期[8]。患者年龄为33~79岁(中位数59岁),其中男性102例,女性46例;单纯SCLC患者135例,复合型SCLC患者13例;53例患者行全脑预防性放疗(表1)。

表1 患者一般临床资料及影响生存的因素Table1 Clinical data and survival-related factors in the patients
1.2 方法
1.2.1 治疗方法 1)化疗:患者诱导化疗周期为2~6个周期(中位数3个周期),化疗方案包括依托泊苷、顺铂(57.0%),依托泊苷、卡铂(32.6%)及其他含铂方案(10.4%)。98例(66.2%)患者放疗后行巩固化疗,化疗周期为1~4个周期(中位数2个周期),化疗方案包括依托泊苷、顺铂(71.1%),依托泊苷、卡铂(20.0%)及其他含铂方案(8.9%)。化疗时间间隔为3~4周。46例患者行同步放化疗,化疗方案为依托泊苷加顺铂。2)放疗:利用Pinnacle38.0 m治疗计划系统,在每例患者的定位CT图像上勾画放疗靶区。在纵隔窗勾画纵隔内肿物、纵隔阳性淋巴结及正常器官,在肺组织窗勾画位于肺内的肿物。GTV(gross target volume,GTV)包括肺部病灶和纵隔肿大淋巴结,CTV(clinical target volume,CTV)在GTV基础上外放0.5 cm,并包括诱导化疗前影像学证实转移的淋巴结所在的整个淋巴引流区,计划靶区(planning target volume,PTV)在CTV基础上向各方向均匀外扩0.5 cm。处方剂量PTV为50~63 Gy/25~30 f,单次剂量为1.8~2.1 Gy。95%PTV体积接受大于等于其处方剂量。正常器官限量:脊髓最大剂量<45 Gy;肺V20<30%(同步化疗 V20<28%),平均肺剂量<15 Gy;食管V50<50%;心脏V30<40%。82例患者采用3D-CRT技术,66例患者采用IMRT技术。
全组患者根据放疗时间介入的不同,分为2~3个周期诱导化疗后直接行放疗组(早放疗组)和4~6个周期诱导化疗后行放疗组(晚放疗组),其中早放疗组为88例,晚放疗组为60例。早晚放疗组中行同步放化疗者为39例。
1.2.2 疗效及不良反应评价 2~3个周期诱导化疗后疗效评价基线为化疗前CT所见病灶大小,采用实体肿瘤疗效评价标准(RECIST version 1.1)[9],疗效评价分为完全缓解、部分缓解、病情稳定及疾病进展。治疗后有效包括完全缓解和部分缓解。诱导化疗后疗效评价在末次诱导化疗结束后1~4周内进行。近期不良反应评价根据不良事件通用术语标准第3版(CTCAE v3.0)[10]来评价,主要包括放射性食管炎、放射性肺炎及血液学不良反应等。
1.2.3 观察终点 总生存期(overall survival,OS):从病理确诊日期开始至患者出现死亡或末次随访日期;无进展生存期(progression-free survival,PFS):从病理确诊开始至肿瘤出现影像学证实的进展复发或出现死亡或末次随访日期。区域复发包括原发灶及纵隔和锁骨上区域淋巴结的复发,除此之外的转移灶均视为远处转移。
1.3 统计学方法
采用SPSS 17.0统计软件进行统计学分析,Kaplan-Meier法进行生存分析并用Log-rank法比较组间生存率差异,Cox比例风险模型对生存进行多因素分析,P<0.05为差异具有统计学意义。
2 结果
2.1 随访
包括患者的病历资料、电话及门诊复查等,截止时间2013年5月4日末次随访,84例(56.8%)患者出现死亡,中位随访时间为20.1个月。
2.2 生存分析
全组患者的中位OS为22.8个月(95%CI:16.7~28.9个月),1、2年及3年OS分别为79.7%、49.0%及38.9%。单因素分析显示,2~3个周期诱导化疗后是否有效(P=0.002)、是否早放疗(P=0.012)是否行脑预防性放疗(P=0.008)及是否发生远处转移(P<0.001)是影响OS的重要因素(表1)。多因素分析显示,2~3个周期诱导化疗后是否有效(P=0.002)、是否早放疗(P=0.018)及是否远处转移(P<0.001)是影响OS的独立因素。
早放疗组患者的中位OS为34.0个月,而晚放疗组患者的中位OS为18.0个月(χ2=6.241,P=0.012,图1)。亚组分析发现,对于2~3个周期诱导化疗后有效的患者,早放疗组和晚放疗组患者的中位OS分别为36.9个月和22.8个月(χ2=4.471,P=0.043);对于2~3个周期诱导化疗后无效的患者,早放疗组与晚放疗组的中位OS分别为18.0个月和9.5个月(χ2=5.889,P=0.015)。
全组同步放化疗患者共46例,其中39例行早放疗,7例行晚放疗。早放疗组中,同步放化疗患者与单纯放疗患者的OS分别为34.0和25.8个月(χ2=1.153,P=0.219);晚放疗组中,同步放化疗患者与单纯放疗患者的OS分别为23.1和17.5个月(χ2=0.063,P=0.801)。
2.3 复发情况
患者的中位PFS为13.8个月,单因素分析发现,是否早放疗是影响PFS的独立因素,早放疗组和晚放疗组的PFS分别为16.8个月和10.9个月(χ2=5.503,P=0.019,图2)。亚组分析发现,对于2~3个周期诱导化疗后有效的患者,早放疗组和晚放疗组患者的中位PFS分别为19.4个月和11.7个月(χ2=6.222,P=0.011);对于2~3个周期诱导化疗后无效的患者,早放疗组与晚放疗组的中位PFS分别为12.4个月和10.3个月(χ2=0.329,P=0.566)。
全组共有50例(33.8%)患者出现局部复发,77例(52.0%)患者出现远处转移,30例(20.3%)患者既出现局部复发及远处转移。远处转移部位为脑(25.0%)、骨(15.5%)、肝(14.8%)、腹膜(8.8%)、肾上腺(8.8%)、对侧肺(4.0%)。2~3个周期诱导化疗后有效患者的局部复发率为31.3%,远处转移率为50.4%,其中,早放疗组和晚放疗组的局部复发率分别为30.4%和32.6%(P=0.806),远处转移率分别为44.9%和58.7%(P=0.209);2~3个周期诱导化疗后无效患者的局部复发率为42.4%,远处转移率为69.7%,其中,早放疗组和晚放疗组的局部复发率分别为42.1%和42.9%(P=0.966),远处转移率分别为68.4%和71.4%(P=0.514)。
2.4 不良反应
全组患者未出现4级及以上放疗反应,2级放射性肺炎发生率为8.7%(13/148),3级发生率为2.0%(3/148),其中1例(3.0%)为诱导化疗后未缓解患者;2级放射性食管炎发生率为6.1%(9/120),无3级放射性食管炎发生;2级血液学不良反应发生率为5.4%(8/148),3级血液学不良反应发生率为1.4%(2/148,表2)。
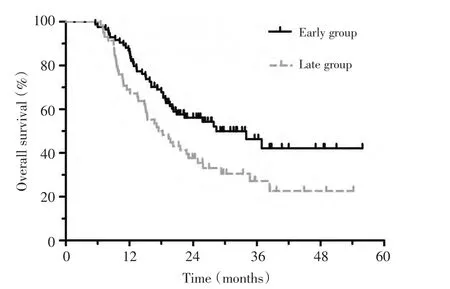
图1 不同放疗时机对患者生存的影响Figure1 Comparison of the overall survival between the early and late radiotherapy groups

图2 不同放疗时机对患者无进展生存的影响Figure2 Comparison of the progression-free survival between the early and late radiotherapy groups
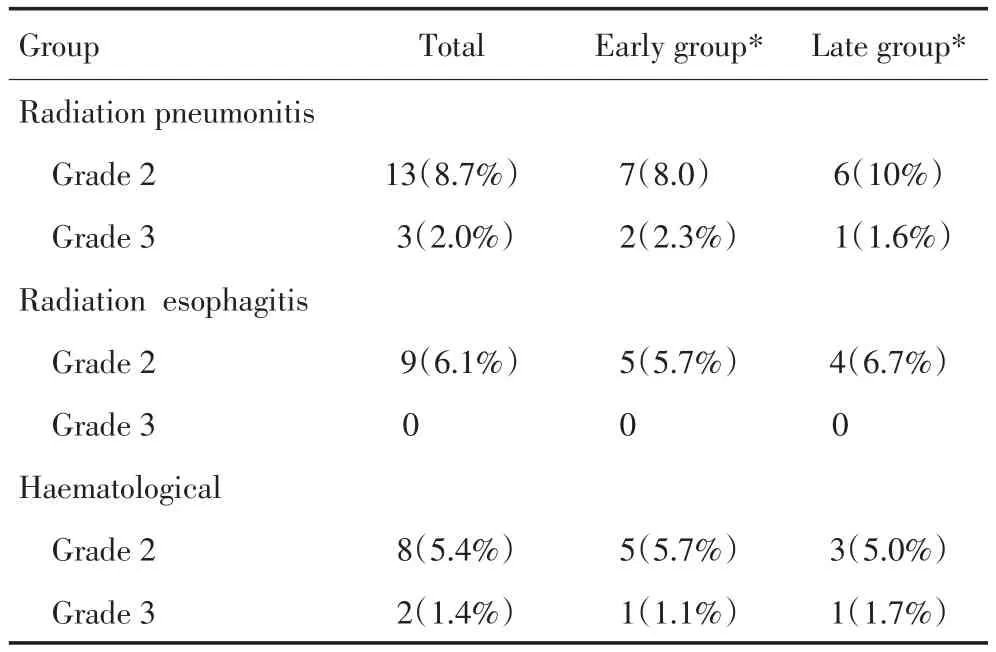
表2 患者放疗相关不良反应Table2 Radiotherapy-related toxicity and side-effect in patients
3 讨论
根据2013年的NCCN治疗指南,LSCLC的标准治疗方法也是同步放化疗[3],目前,多项研究表明早放疗比晚放疗能带来更多的生存获益[4-6]。但在临床实践中,多数患者往往因肿瘤体积较大或合并严重内科疾病等而采用诱导化疗后再给予放疗。国内Zhao等[11]的Meta分析发现,早放疗和晚放疗组在生存上没有明显差别。而韩国Sun等[7]最近的一项Ⅲ临床试验亦发现,2个周期诱导化疗后再行同步放化疗组和直接同步放化疗组之间生存上无明显差异,但并发症却明显低于后者。诱导化疗后的疗效是否会影响到放疗的时机把握呢?是否诱导化疗后疗效较好的患者可以将放疗延后呢?本研究结果显示,对于行诱导化疗的LSCLC患者,无论2~3个周期后化疗疗效如何,早放疗组比晚放疗组都有更高的OS,而诱导化疗后有效的患者,放疗的尽早介入还会显著延长患者的PFS,提示对于2~3个周期诱导化疗后有效的病例,更应该尽早进行放射治疗,以达到长期的肿瘤控制。
目前,已有研究显示诱导化疗后疗效是影响LSCLC患者预后的重要因素[12-13]。Fujii等[12]比较了第1周期化疗后达客观缓解与多周期化疗后达客观缓解患者的预后,结果发现,第1周期化疗后能否达客观缓解是影响患者生存的独立因素。国内学者邵亚娟等[13]研究亦发现诱导化疗后达客观缓解的LSCLC患者的生存明显优于未缓解患者。本结果显示,2~3个周期诱导化疗后是否有效是影响患者预后的重要因素,2~3个周期诱导化疗后有效患者与无效患者相比有更好的OS和PFS。
本文研究发现,早放疗组患者的中位OS明显高于晚放疗组。这可能与早放疗组更多的患者接受了同步放化疗有关,而同步放化疗是疗效提高的主要因素。接受2~3个周期诱导化疗的患者有较好的骨髓储备,且身体耐受性好,因而多可以耐受同步放化疗,从而缩短了总体的治疗时间,提高了生存期及疾病控制时间[14-15]。尤其对于化疗敏感的患者,放疗的及时介入可以更好地起到协同作用,降低局部复发率,提高无病生存期。另外,本研究发现,2~3个周期诱导化疗后有效患者的远处转移率明显低于化疗后无效患者。这说明对于诱导化疗后无效患者,即便胸部肿瘤得到控制亦不能抑制远处转移的出现,从而导致了早放疗对PFS的影响不大,而对化疗有效的患者,可能抑制以后远处转移的发生。
由于本研究为回顾性研究,病例数较少,放疗剂量及分割模式不统一,会对结果产生一定影响。但是本研究证实,对于行2~3个周期诱导化疗的LSCLC患者,早放疗组的预后均明显高于晚放疗组,且放疗不良反应较小,并且提示,对于化疗有效的患者,更应该尽早开始放疗。
1 Joshi M,Ayoola A,Belani CP.Small-cell lung cancer:an update on targeted therapies[J].Adv Exp Med Biol,2013,779:385-404.
2 Govindan R,Page N,Morgensztern D,et al.Changing epidemiology of small-cell lung cancer in the United States over the last 30 years:analysis of the surveillance,epidemiologic,and end results database[J].J Clin Oncol,2006,24(28):4539-4544.
3 Kalemkerian GP,Akerley W,Bogner P,et al.Small cell lung cancer[J].J Natl Compr Canc Netw,2013,11(1):78-98.
4 Pijls-Johannesma M,De Ruysscher D,Vansteenkiste J,et al.Timing of chest radiotherapy in patients with limited stage small cell lung cancer:a systematic review and meta-analysis of randomised controlled trials[J].Cancer Treat Rev,2007,33(5):461-473.
5 De Ruysscher D,Pijls-Johannesma M,Bentzen SM,et al.Time between the first day of chemotherapy and the last day of chest radiation is the most important predictor of survival in limited-disease small-cell lung cancer[J].J Clin Oncol,2006,24(7):1057-1063.
6 Stinchcombe TE,Gore EM.Limited-stage small cell lung cancer:current chemoradiotherapy treatment paradigms[J].Oncologist,2010,15(2):187-195.
7 Sun J M,Ahn YC,Choi EK,et al.PhaseⅢtrial of concurrent thoracic radiotherapy with either first-or third-cycle chemotherapy for limited-disease small-cell lung cancer[J].Ann Oncol,2013,24(8):2088-2092.
8 Goldstraw P,Crowley J,Chansky K,et al.The IASLC Lung Cancer Staging Project:proposals for the revision of the TNM stage groupings in the forthcoming(seventh)edition of the TNM Classification of malignant tumours[J].J Thorac Oncol,2007,2(8):706-714.
9 Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.
10 Trotti A,Colevas AD,Setser A,et al.CTCAE v3.0:development of a comprehensive grading system for the adverse effects of cancer treatment[J].Semin Radiat Oncol,2003,13(3):176-181.
11 Zhao H,Gu J,Hua F,et al.A meta-analysis of the timing of chest radiotherapy in patients with limited-stage small cell lung cancer[J].Zhongguo Fei Ai Za Zhi,2010,13(9):892-897.
12 Fujii M,Hotta K,Takigawa N,et al.Influence of the timing of tumor regression after the initiation of chemoradiotherapy on prognosis in patients with limited-disease small-cell lung cancer achieving objective response[J].Lung Cancer,2012,78(1):107-111.
13 Shao LJ,Ning XH,Wang YZ,Analysis of factors affecting treatment strategies and response to treatment on the prognosis of small Cell lung cancer[J].Basic Clin Med,2011,31(3):312-315.[邵丽娟,宁晓红,王毓洲.治疗策略及治疗反应对小细胞肺癌预后影响的多因素分析[J].基础医学与临床,2011,31(3):312-315.]
14 Stinchcombe TE,Gore EM.Limited-stage small cell lung cancer:current chemoradiotherapy treatment paradigms[J].Oncologist,2010,15(2):187-195.
15 Komatsu T,Oizumi Y,Kunieda E,et al.Definitive chemoradiotherapy of limited-disease small cell lung cancer:Retrospective analysis of new predictive factors affecting treatment results[J].Oncol Lett,2011,2(5):855-860.
