基因沉默抑制子HC-Pro表达载体的构建
2014-01-06金太成许亚男张晓华冯茹茹刘秋霞李双双杨丽萍
金太成,许亚男,郑 爽,张晓华,冯茹茹,刘秋霞,李双双,杨丽萍
(吉林师范大学 生命科学学院,吉林 四平 136000)
基因沉默抑制子HC-Pro表达载体的构建
金太成,许亚男,郑 爽,张晓华,冯茹茹,刘秋霞,李双双,杨丽萍
(吉林师范大学 生命科学学院,吉林 四平 136000)
RNA沉默广泛存在于植物等大多数真核生物中,能够防御外源基因的入侵和调控基因表达等.然而,基因沉默抑制子HC-Pro蛋白的具体功能的研究并不十分清楚.本文重点介绍了基因沉默抑制子HC-Pro的表达载体pBI121-HC-Pro的构建及HC-Pro基因在烟草(Nicotianabenthamiana) 中的稳定表达.并利用半定量RT-PCR技术检测了目的基因HC-Pro的表达,检测结果表明我们获得了HC-Pro基因稳定表达的转基因烟草株系,为进一步深入研究基因沉默抑制子HC-Pro的功能奠定了实验基础.
基因沉默抑制子;蚜传辅助因子;稳定表达;烟草
0 引言
RNA沉默广泛存在于植物等大多数真核生物中,能够影响或完全阻断基因的表达,同时也参与调控转座子、抗病毒反应、环境胁迫反应以及植物的生长发育等诸多过程,具有广泛而重要的生物学意义.RNA沉默在植物界被称为共抑制 (cosuppression)[1]、真菌中被称为抑制(quelling)[2]、动物中称为RNA干扰(RNA interference)[3-4].
植物基因沉默被认为是保持自身基因组稳定性,防御外来DNA序列包括防御病毒的一种保护机制.而病毒通过长期的进化,依赖自身编码的基因沉默抑制蛋白来对抗宿主的RNA沉默.迄今为止,发现的基因沉默抑制子有30多种,最早被鉴定出来的是由烟草蚀纹病毒(TEV)编码的HC-Pro和由黄瓜花叶病毒(CMV)编码的2b蛋白[5].这些沉默抑制子的结构和功能各异,能作用于RNA沉默的各个阶段,对RNA沉默途径的抑制也是多种多样.其中,2b蛋白通过与AGO1互作并抑制其对靶标的剪切[6],由马铃薯X病毒(PVX)编码的p25通过干扰dsRNA的合成而抑制RNA沉默[7],番茄丛矮病毒(TBSV)编码的p19能够结合siRNA双链来阻止siRNA进入AGO蛋白[8].而关于TEV病毒编码的Hc-Pro的功能的研究结果并不一致.有的研究人员认为Hc-Pro部分影响转入基因的DNA甲基化[9],也有研究表明Hc-Pro作用后,转入基因的插入位点仍旧保持DNA甲基化[10].还有研究表明,由烟草蚀纹病毒(TEV)和马铃薯 Y 病毒(PVY)编码的Hc-Pro蛋白能通过阻止21-24nt siRNA的形成或干扰siRNA的稳定性在抵抗宿主的沉默效应中起作用[11].总之,人们对Hc-Pro影响或调控基因沉默的机制并不十分清楚.
因此,我们对基因Hc-Pro的克隆,表达载体的构建,及沉默抑制子Hc-Pro蛋白的功能研究具有一定的研究意义.本研究利用PCR技术克隆了目的基因Hc-Pro,构建了HC-Pro表达载体pBI121-HcPro,并稳定转化了烟草(Nicotianabenthamiana)植株,半定量RT-PCR检测结果表明我们获得了四个HC-Pro转基因烟草株系,为进一步深入研究基因沉默抑制子HC-Pro的功能及其在与宿主RNA沉默机制中的作用奠定了实验基础.
1 材料和方法
1.1 表达载体p35S-pBI121
携带基因Hc-Pro的质粒由山东农大李向东教授惠赠,基因表达载体pBI121由周晓馥教授惠赠(见图1).
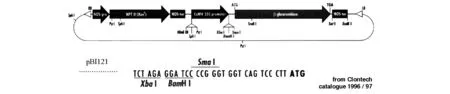
CaMV 35S promoter:为花椰菜花叶病毒35S启动子;NOS-ter:为终止子;LB和RB:为T-DNA区的左右边界;XbaI、BamHI等为多克隆位点.
图1基因表达载体pBI121图谱
1.2 植物材料
烟草(Nicotianabenthamiana)由东北师范大学王兴智教授惠赠.将烟草种子用浓度为30%的84消毒液进行灭菌处理后,播种于MS培养基培养,两周后再将小苗移栽到花盆中.以开花的烟草作为遗传转化的植物材料备用.
1.3 植物表达载体的构建
根据质粒携带的基因Hc-Pro序列设计引物(引物F:ATGTCAGCGGCAGAGCAATTTT;引物R前加SacI酶切位点:CGAGCTCTTAGCCAACTCTATAATGCTTCATTTC),以质粒为模板经PCR扩增出的Hc-Pro基因片段,引物由博仕生物公司合成.将扩增片段连接到pMD18-T载体上,转化超级感受态细胞DH5a.提取质粒DNA,将PMD18-T-Hc-Pro和pBI121分别用SacI/XbaI进行双酶切,鼎国公司购买的DNA回收试剂盒回收,将回收目的片段与pBI121载体以摩尔比3∶1的比例进行4℃连接,构建成植物表达载体pBI121-Hc-Pro.将重组质粒pBI121-Hc-Pro送交北京华大基因进行测序.
将质粒pBI121-Hc-Pro转化农杆菌EHA105感受态细胞.首先将1 μg质粒加到该感受态细胞中,并将它们保存在冰中30 min,再放在42℃恒温水浴锅中热激 42 S,再放在冰上冰浴2 min;然后加1 ml LB 培养基,在28℃下轻摇1 h.将培养物离心收集菌体,涂在含有卡那霉素(Kana+)和利福平(Rif+)的LB培养基平板上.在28℃条件下,培养2-3天,可在培养基上筛选出阳性克隆,并保存菌种.
1.4 农杆菌介导的烟草转化
取保存的菌种进行摇菌和扩摇来制备菌液重悬液MMA,测定OD600值(一般为0.8-1.0),然后采用蘸花法(详见分子克隆)将携带表达载体pBI121-Hc-Pro的菌液重悬液浸泡烟草花,转化后避光过夜,正常培养条件下培养并收获烟草种子,再进行Hc-Pro转基因烟草的筛选和基因表达的检测分析.
2 结果与分析
2.1 pMD18-T-Hc-Pro阳性克隆的PCR鉴定和酶切鉴定
分别随机挑取白色克隆的单菌落,作为PCR反应的模板,进行PCR反应后,1%琼脂糖凝胶电泳检测扩增结果(如图2A).为了进一步鉴定重组子,从有目的扩增产物的克隆进行培养以提取质粒,再用限制性内切酶SacI/XbaI进行双酶切鉴定.酶切产物经1%的琼脂糖凝胶电泳(电压为150v,1-2 h)分离,用紫外凝胶成像仪(UVIPhotoMW,BTS-20.M,EEC)进行观察和拍照(如图2B).

A:M为分子Marker DL2000;1为阳性对照;4为阴性对照;2,3,5,6,7为阳性克隆的PCR产物;B:M为分子Marker DL2000;3-6为阳性克隆的SacⅠ/XbaⅠ酶切.
图2pMD18-T-Hc-Pro阳性克隆的PCR鉴定和酶切鉴定
2.2 表达载体 pBI121-Hc-Pro的构建及检测分析
从转化平板上挑取8个单菌落进行菌落PCR,其鉴定结果为:1、4、8号单菌落都为阳性克隆; 提取8个单菌落的质粒, 进行SacⅠ/XbaⅠ酶切鉴定,结果1、4、8号为阳性克隆(如图3).酶切鉴定结果与PCR鉴定结果一致,将1、4、8号质粒送样测序(北京华大基因测序公司).
2.3 半定量RT-PCR法检测HC-Pro转基因烟草
将携带表达载体pBI121-Hc-Pro稳定转化的烟草Nb种子播种在MS培养基,两周后再将小苗移栽到花盆中,在正常温度(25℃)和光照培养条件下进行培养.利用Trizal法提取烟草叶片的总RNA,并进行RT-PCR检测分析,Actin为内参(如图4).

M为分子Marker DL 2000; 1,4,8为阳性克隆的酶切产物图3 pBI121-Hc-Pro阳性克隆的酶切鉴定

图4 转基因烟草植株的半定量RT-PCR检测结果
3 讨论
植物基因沉默抑制子HC-Pro的功能是最早被发现的,人们对其沉默抑制机制的研究表明, HC-Pro蛋白是在转录后基因沉默中起作用,但是其在转录水平基因沉默机制中的作用与功能并不十分清楚.有的研究人员认为Hc-Pro部分影响转入基因的DNA甲基化[4],也有研究表明Hc-Pro作用后的转入基因的插入位点仍旧保持DNA甲基化[5].因此,我们对HC-Pro功能的深入研究一方面有利于我们更清楚的理解HC-Pro与宿主互作的机制;另一方面,植物基因沉默抑制子还能被应用于植物生物反应器的研究.植物病毒能在宿主内通过阻断潜在的防御反应来增强病毒的传播能力和致病能力,因此,人们通过基因沉默抑制子的转基因植株来提高外源蛋白的表达水平[11-16].近年来,人们对植物病毒与宿主的互作研究成为国内外新的研究热点,这些研究成果不仅加深了我们对植物RNA沉默机制等科学问题的认识,也最终会被抗病毒育种所应用.
[1]C.Napoli,C.Lemieux,R.Jorgensen.Introduction of a chimeric chalcone synthase gene into petunia results in reversible cosuppression of homologous gene in trans[J].Plant Cell,1990,2(4):279~289.
[2]C.Cogoni,N.Romano,G.Macino.Suppression of gene expression by homologous transgenes[J].Antonie Van Leeuwenhoek,1994,65 (3):205~209.
[3]S.Guo,K.J.Kemphues.Par-1,a gene required for establishing polarity in C.elegans embryos, encodes a putative ser/Thr kinase that is asymmetrically distributed[J].Cell,1995,81 (4):611~620.
[4]A.Fire,S.Xu,M.K.Montgomery,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391 (6669):806~811.
[5]G.Brigneti.Viral pathogenicity determinants are suppressors of transgene silencing in Nicotiana benthamiana[J].Embo J,1998,17(22):6739~46.
[6]X.Zhang,Y.Yuan,Y.Pei,et al.Cucumber mosaic virus-encoded 2b suppressor inhibits Arabidopsis Argonaute1 cleavage activity to counter plant defense[J].Genes & Dev.2006,20:3255~3268.
[7]A.Hamilton,O.Voinnet,L.Cheppell,et al.Two classes of short interfering RNA in RNA silencing[J].Embo J,2002,21(17):4671~4679.
[8]P.Ounoyer,C.H.Leceuier,E.A.Parizotto,et al.Probing the microRNA and small interfering RNA pathways with virus-encoded suppressors of RNAsilencing[J].Plant Cell,2004,16(5):1235~1250.
[9]C.Llave,K.D.Kasschau,J.C.Carrington J C,et al.Virus-encoded suppressor of posttranscriptional gene silencing targets a maintenance step in the silencing pathway[J].Proc Natl Acad Sci USA,2000,97 (24):13401~13406.
[10]A.C.Mallory,L.Ely,T.H.Smith,et al.HC-Pro suppression of transgene silencing eliminates the small RNAs but not transgene methylation or the mobile signal[J].Plant Cell,2001,13(3):571~583.
[11]蒋 琳,魏春红,李 毅.病毒基因沉默抑制子及其作用机制[J].中国科学,2012,42(1):16~28.
[12]G.Pruss,Ge,X,Shi,X.M,Carrington,J.C,Vance,V.B.Plant viral synergism:the potyviral genome encodes a broad-range pathogenicity enhancer that transactivates replication of viruses[J].Plant Cell,1997,9:859~868.
[13]K.Ye,L.Malinina,D.J.Patel.Recognition of small interfering RNA by a viral suppressor of RNA silencing[J].Nature,2003,426(6968):874~878.
[14]G.Brigneti,O.Voinnet,W.X.Li,et al.Viral pathogenicity deter-minants are suppressors of transgene silencing in Nicotiana ben-thamiana[J].EMBO J,1998,17:6739~6746.
[15]K.D.Kasschau.J.C.Carrington.A counterdefensive strategy of plant viruses:suppression of posttranscriptional gene silencing[J].Cell,1998,95:461~470.
EstablishmentofexpressionvectorofgenesilencingsuppressorHC-Pro
JINTai-cheng,XUYan-an,ZHENGShuang,ZHANGXiao-hua,FENGRu-ru,LIUQiu-xia,LIShuang-shuang,YANGLi-ping
(School of Life Science,Jilin Normal University,Siping 136000,China)
RNA silencing is a conserved pathway that results in blockage of gene expression in both the cytoplasm and nucleus of eukaryotic organisms and is involved in regulating gene expression.Action of the gene silencing suppressor HC-Pro protein encoded by TEV is not clear.In this paper,we focuse on establishment of expression vector pBI121-HC-Proof gene silencing suppressor HC-Pro and stable expression of HC-Pro gene inNicotianabenthamianaplants.The expression of HC-Pro gene inNicotianabenthamianaplants was detested by semi-quantitative RT-PCR.The results showed that transgenetic tabacco lines of HC-Pro gene were acquired,and provided study base for action of the gene silencing suppressor HC-Pro protein.
gene silencing suppressor;HC-Pro;stable expression;Nicotianabenthamiana
林险峰)
2014-05-20
国家青年科学基金项目(31301043);吉林省科技发展计划青年科研基金项目 (20130522182JH)
金太成(1978-),朝鲜族,男,吉林省辉南市人,现为吉林师范大学生命科学学院讲师,博士.研究方向:植物生物反应器和植物抗逆生理.
Q94
A
1674-3873-(2014)03-0135-03
