不同品系小鼠骨密度数据库的初步建立
2014-01-04赵丽亚邢正弘陈国强缪建成
赵丽亚, 赵 莹, 邢正弘, 陈国强, 缪建成, 刘 磊
(1. 上海西普尔-必凯实验动物有限公司, 上海 201203; 2. 上海实验动物研究中心, 上海 201203)
·经验交流·
不同品系小鼠骨密度数据库的初步建立
赵丽亚1,2, 赵 莹1,2, 邢正弘1,2, 陈国强1,2, 缪建成1,2, 刘 磊1,2
(1. 上海西普尔-必凯实验动物有限公司, 上海 201203; 2. 上海实验动物研究中心, 上海 201203)
目的 采用FX Pro小动物活体成像系统,以活体小鼠股骨、椎骨为检测对象,收集11个品系、不同周龄小鼠的骨密度值构建数据库。方法 11个不同小鼠品系,分别选择4、8、12、16、48周龄,每个周龄每个品系雌雄各5只,采用10 g/L的戊巴比妥钠腹腔麻醉,动物麻醉后固定于特制的检测台上,其中股骨以左后肢为被检测对象,椎骨以尾椎为被检测对象,采用FX Pro小动物活体成像系统进行X-射线拍摄。结果 构建了11个品系小鼠的股骨密度、椎骨密度数据库。结论 不同品系的股骨、椎骨骨密度有差异,初步建立了不同品系小鼠骨密度数据库。
小鼠; 活体; X-射线; 股骨; 椎骨; 小动物活体成像系统
骨质疏松是影响人类健康的一个重要疾病,骨质疏松主要的衡量指标是骨密度。骨密度是骨强度的一个重要因素,低密度是因为骨转换率增加以及骨的成分降低[1]。在正常人的生活中,其中包括性别、营养、运动、环境、遗传等许多因素都影响骨密度的调控。研究表明, 在人类和动物中骨密度都包含很强的遗传因素,遗传因素估计占其中的60%~80%[2~7]。而动物模型是研究骨密度遗传规律的基础, 同时必须有灵敏、精确的检测手段。目前关于骨密度的研究有许多, 例如, 构建一些骨质疏松动物模型[8]、骨密度相关QTL的鉴定[9]、不同染色体替换品系骨密度存在差异[10]、离乳期间和离乳后骨细胞可能导致矿物质含量的可逆性缺失[11]、2型糖尿病的降血糖药会引起胫骨的骨质大量流失等[12]。因此通过对各个品系骨密度的测定,能够为各种骨质疏松动物模型提供参照。
本文中,主要收集来自不同小鼠品系成年鼠的股骨和椎骨的骨密度数据,选择的品系包括近交系、远交系、杂交一代,在近交系中,每个品系的遗传背景相同,专门用于分析遗传性状。
1 材料与方法
1.1 实验动物
选择未生育过的C57BL/6、B6C3F1、ICR、BALB/cA-nude、CBA/Ca、DBA/2、FVB/NJ、129/SvEvBrd、BALB/cA、uPA[13]、C3H/He小鼠。分别为4周龄、8周龄、12周龄、16周龄、48周龄,同时雌雄分开,每组5只。所有动物购自上海西普尔-必凯实验动物有限公司[SCXK(沪)2008-0016]。所有动物饲养于上海西普尔-必凯实验动物有限公司[SYXK(沪)2008-0058],动物实验遵守实验动物管理条例。
1.2 主要试剂、仪器
戊巴比妥钠购自Sigma公司。FX Pro小动物活体成像系统(Kodak In-vivo Imaging System FX Pro),由美国Kodak公司生产。
1.3 方法
1.3.1 X-射线拍摄条件 按照小鼠体质量以10 g/L的戊巴比妥钠腹腔麻醉,动物麻醉后固定于特制的检测台上,采用小动物活体成像系统(Kodak In-vivo Imaging System FX Pro)分别进行X-射线拍摄,拍摄条件为: 曝光时间30 s, 像素合并为No, 光源X-ray,光圈2.8,视野范围61.3 mm,filter为0.8 mm,有磷屏,不需要激发和发射波长。
1.3.2 拍摄对象的选择 主要收集来自不同品系小鼠的股骨和椎骨的骨密度数据,其中股骨以左后肢为被检测对象,椎骨以尾椎为被检测对象。
1.3.3 骨密度数据的采集 打开Carestream MI软件,点击“Capture In-Vivo FX”按照拍摄条件进行X-射线拍摄, 得到原始图像。在Carestream MI界面中, 打开拍摄的原始图像, 点击“Navigation”-“Image”-Image Math,出现Image Math对话框,在Calculate中选择Convert to optical or X-Ray density,在Ontput Imagez中命名输出的图像, 点击“OK”确认, 点击“Manual-ROIs”, 点击, 出现“Draw ROI Origin”, 选择“Corner”, 点击“OK”确认,选中需要分析的区域, 点击“Bone Density”, 可得到选中区域的骨密度的分析结果。
1.4 统计学分析
利用SPSS软件进行统计分析,以C57BL/6为参照,采用独立样本t检验,计算均值±标准差,以P<0.05为显著性差异。
2 结果
2.1 股骨骨密度
2.1.1 品系间比较 C57BL/6与其余每个品系的股骨密度差异见表1,综合雌雄小鼠的股骨密度比较结果, 与C57BL/6有显著差异的股骨密度值为63个,无显著差异的股骨密度值为37个, 有显著差异的比率为63%。C57BL/6与B6C3F1、ICR、CBA/Ca、129/SvEvBrd、C3H/He五个品系的股骨密度差异较大,与其余六个品系在个别周龄段有显著性差异。
2.1.2 同品系性别间、周龄间比较 同品系雄性小鼠的股骨密度均高于雌性小鼠。其中在5个周龄段同品系性别间都有显著差异的品系有: C57BL/6、BALB/cA、B6C3F1、uPA、129/SvEvBrd、C3H/He,其余品系在部分周龄段有显著差异(表1)。

表 1 11个品系小鼠不同周龄股骨骨密度 g/cm3
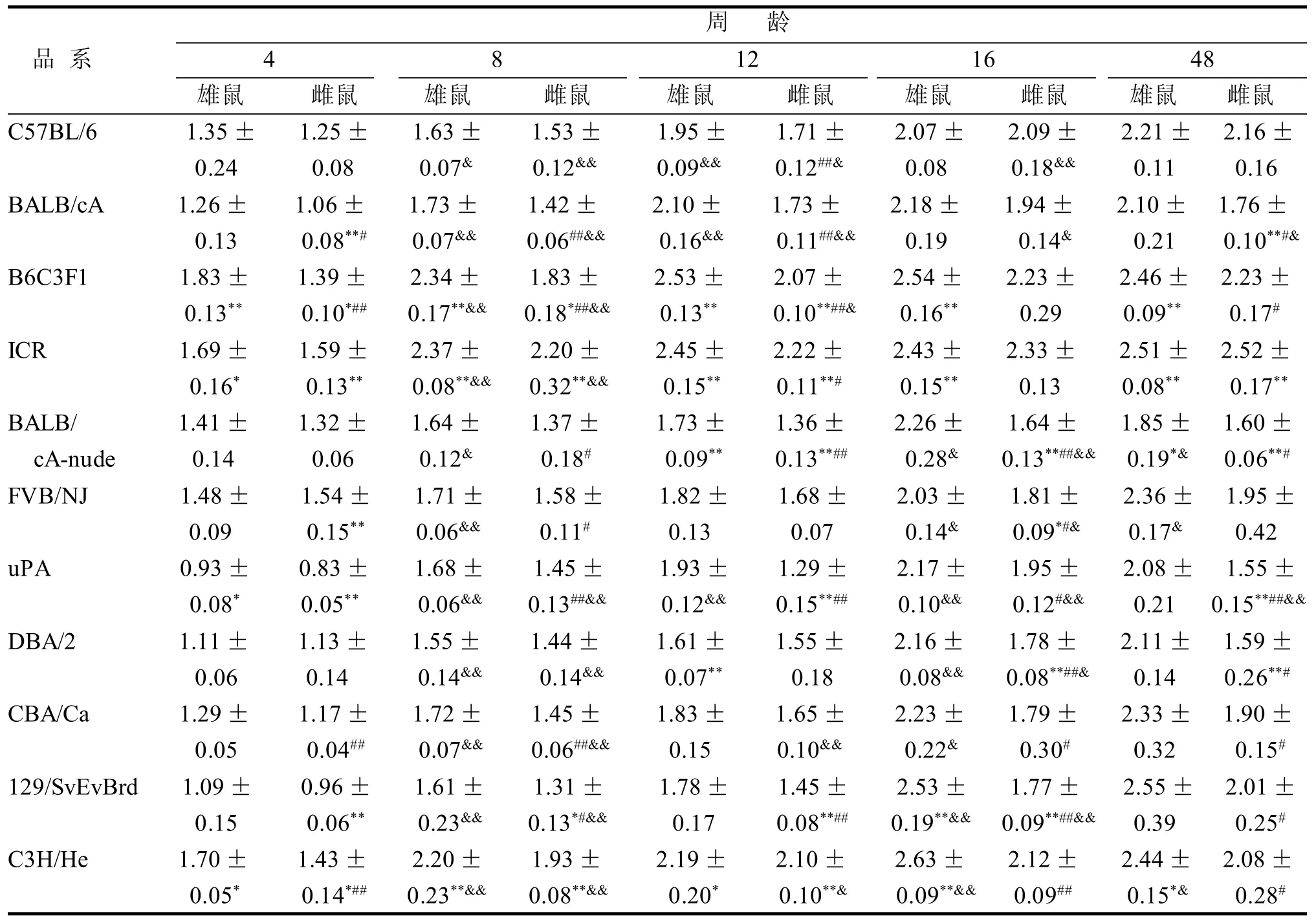
表 2 11个品系小鼠不同周龄椎骨骨密度 g/cm3
所有品系在16周龄之前骨密度处于增长过程,所有品系的4周龄与8周龄骨密度比较都有显著差异。在16周龄之后,部分品系骨密度值有所下降, 在16周龄达到最大值的品系有: BALB/cA、BALB/cA-nude、uPA, 在48周龄达到最大值的品系有: C57BL/6、B6C3F1、ICR、FVB/NJ、DBA/2、CBA/Ca、129/SvEvBrd、C3H/He(表 1)。
2.2 椎骨骨密度
2.2.1 品系间比较 C57BL/6与其余每个品系小鼠在每个周龄段的椎骨密度差异见表2,综合雌雄小鼠的椎骨密度比较结果,与C57BL/6有显著差异的椎骨密度值为46个,无显著差异的椎骨密度值为54个,有显著差异的比率为46%。C57BL/6与B6C3F1、ICR、129/SvEvBrd、C3H/He五个品系的椎骨密度差异较大,C57BL/6与BALB/cA-nude在12周龄之后差异较大,与其余五个品系在个别周龄段有显著性差异。
2.2.2 同品系性别间、周龄间比较 4周龄FVB/NJ、DBA/2雄性小鼠的椎骨密度低于雌性小鼠; 16周龄,C57BL/6雄性小鼠的椎骨密度低于雌性小鼠;48周龄,ICR雄性小鼠的椎骨密度低于雌性小鼠。在5个周龄段同品系性别间椎骨骨密度比较中,所有品系只在部分周龄段有显著差异(表2)。
同品系周龄间比较(表2),所有品系在8周龄之前椎骨密度处于增长过程,所有品系的4周龄与8周龄骨密度比较, 除BALB/cA-nude与FVB/NJ外都有显著差异。在8周龄后, 有的品系骨密度值增长缓慢, 在16周龄达到最大值的品系有: BALB/cA、B6C3F1、BALB/cA-nude、uPA、DBA/2、C3H/He,在48周龄达到最大值的品系有: C57BL/6、ICR、FVB/NJ、CBA/Ca、129/SvEvBrd,其中 BALB/cA在48周龄又降到12周龄椎骨密度水平。
3 讨论
随着社会进入老龄化,骨质疏松患者日益增多,对骨质疏松症的研究越来越深入。目前检测设备日趋高灵敏度、高精确度以及快捷、方便、安全。本研究通过对小鼠的股骨和椎骨密度分析后发现小动物活体成像系统能够用于描述小鼠的骨骼。本研究选择国内11个常用小鼠品系,分别选择4周龄、8周龄、12周龄、16周龄、48周龄五个周龄段动态观察不同性别骨密度变化。4~12周龄的小鼠生长最旺盛,最易反映每个品系的遗传状态。本研究中, 在5个周龄段同品系性别间股骨密度都有显著差异的品系有: C57BL/6、BALB/cA、B6C3F1、uPA、129/SvEvBrd、C3H/He, 其余品系在部分周龄段有显著差异。在5个周龄段同品系性别间椎骨骨密度比较中, 所有品系只在部分周龄段有显著差异。本研究周龄间比较中,所有品系的4周龄与8周龄股骨骨密度都有显著差异,所有品系的4周龄与8周龄椎骨骨密度比较,除BALB/cA-nude与FVB/NJ外都有显著差异。
目前有许多关于不同品系间骨密度有显著差异的报道,Murray等[14]报道了C57BL/6的椎骨含量最低,并且与SENCAR品系小鼠比较时缺乏再吸收和形成的连接。Beamer 等[15]报道了9个近交系在股骨密度差异,其中包含了本研究中的5个近交系,在48周龄时雌性小鼠股骨密度从大到小的顺序为: C3H/He、129/SvEvBrd、DBA/2、BALB/cA、C57BL/6,其中DBA/2与BALB/cA的差异较小。本研究中48周龄雌性小鼠股骨密度从大到小的顺序为: C3H/He、129/SvEvBrd、DBA/2、BALB/cA、C57BL/6, 与国外报道的趋势相同。本研究中48周龄雌性小鼠椎骨密度从大到小顺序为: C57BL/6、C3H/He、129/SvEvBrd、BALB/cA、DBA/2。
综合雌雄小鼠的股骨和椎骨密度结果,C57BL/6与其余各个品系小鼠有显著差异的股骨密度值为63个, 无显著差异的股骨密度值为37个, 有显著差异的比率为63%; C57BL/6与其余各个品系小鼠有显著差异的椎骨密度值为46个, 无显著差异的锥骨密度值为54个, 有显著差异的比率为46%。在之前的报道中, C57BL/6和C3H/He两个品系的股骨有50%的显著差异, 椎骨有9%的显著差异[13], 本文中的结果与文献报道的趋势一致, 因此小动物活体成像系统可以用于对小鼠股骨、椎骨密度的分析。
[1] Wronski TJ, Walsh CC, Ignaszewski LA. Histologic evidence for osteopenia and increased bone turnover in ovariectomized rats[J]. Bone, 1986, 7:119-124.
[2] Beamer WG, Donahue LR, Rosen CJ, et al. Genetic variability in adult bone density among inbred strains of mice[J].Bone, 1996, 18(5):397-403.
[3] Devoto M, Shimoya K, Caminis J, et al. First-stage autosomal genome screen in extended pedigrees suggests genes predisposing to low bone mineral density on chromosomes 1p,2p and 4q[J]. Eur J Hum Genet, 1998, 6(2):151-157.
[4] Klein RF, Mitchell SR, Phillips TJ, et al. Quantitative trait loci affecting peak bone mineral density in mice[J]. J Bone Miner Res, 1998, 13(11):1648-1656.
[5] Huang QY, Kung AW. Genetics of osteoporosis[J]. Mol Genet Metab, 2006, 88(4):295-306.
[6] Niu TH, Chen CZ, Cordell H, et al. A genome-wide scan for loci linked to forearm bone mineral density[J]. Hum. Genet,1999, 104(3):226-233.
[7] Baldock PA, Eisman JA. Genetic determinants of bone mass[J]. Curr Opin Rheumatol, 2004, 16(4):450-456.
[8] Turner AS. Animal models of osteoporosis-necessity and limitations [J]. Eur Cell Mater, 2001, 1:66-81.
[9] Beamer WG, Shultz KL, Ackert-Bicknell CL, et al. Genetic dissection of mouse distal chromosome 1 reveals three linked BMD QTLs with sex-Dependent regulation of bone phenotypes[J]. J Bone Miner Res, 2007, 22(8):1187-1196.
[10] Govoni KE, Donahue LR, Marden C, et al. Complex genetic regulation of bone mineral density and insulin-like growth factor-I in C57BL/6J-Chr #A/J/NaJ chromosome substitution strains[J]. Physiol Genomics, 2008, 35(2):159-164.
[11] Liu XS, Ardeshirpour L, VanHouten JN, et al. Site-specific changes in bone microarchitecture, mineralization, and stiffness during lactation and after weaning in mice[J]. J Bone Miner Res, 2012, 27(4):865-875.
[12] Broulík PD, Sefc L, Haluzík M. Effect of PPAR-γ agonist rosiglitazone on bone mineral density and serum adipokines in C57BL/6 male mice[J]. Folia Biol (Praha), 2011, 57(4):133-138.
[13]王晓东, 张燕, 王玉柱, 等. uPA基因缺失型小鼠与野生型小鼠肝纤维化模型的比较研究[J].实验动物与比较医学,2011, 31(4):231-235.
[14] Beamer WG, Donahue LR, Rosen CJ, et al. Genetic variability in adult bone density among inbred strains of mice[J]. Bone,1996, 18(5):397-403.
Q95-33
B
1674-5817(2014)02-0149-04
10.3969/j.issn.1674-5817.2014.02.014
2012-09-03
2013-11-08
上海市科学技术委员会科研计划项目(09140900201)
邢正弘(1957-), 男, 高级工程师, 从事实验动物学科研究和管理工作, E-mail: zhxing57@163.com
赵丽亚(1981-), 女, 硕士, 从事分子遗传学方向研究, E-mail: zhaoliya3002@163.com
