CD44和maspin在肺鳞状细胞癌中的表达及其与血管生成的关系
2014-01-04承泽农武世伍宋文庆
承泽农 武世伍 周 蕾 俞 岚 宋文庆
(蚌埠医学院第一附属医院病理科;蚌埠医学院病理学教研室,安徽233030)
肺癌是世界第一大肿瘤[1],而肺鳞状细胞(lung squamous cell carcinoma,LSCC)是肺癌中最主要的类型。LSCC患者5年生存率很低,术后复发、转移以及对放化疗抵抗是其主要原因。目前认为在肿瘤细胞中可能存在一小群会导致肿瘤复发、转移以及抵抗放化疗、并具有自我更新、无限增殖能力的细胞,即肿瘤干细胞(cancer stem cells,CSCs)。CD44是CSCs的一种标记物,同时也是一种细胞黏附分子,主要参与细胞与细胞、细胞与基质之间的黏附,并介导细胞生长、分化及死亡等功能。CD44分子的异常表达,与许多恶性肿瘤的侵袭及转移密切相关。maspin是丝氨酸蛋白酶抑制剂超家族成员之一,具有调节细胞凋亡、黏附、运动以及血管生成等功能[2-3]。诱导血管生成是恶性肿瘤增殖、浸润和转移所必须具备的能力之一,而反映血管生成能力的一个指标即微血管密度(microvessel density,MVD),与肿瘤的浸润、转移及预后密切相关。本研究通过免疫组织化学方法检测116例LSCC患者中CD44、maspin和CD34蛋白的表达,分析CD44、maspin蛋白表达以及MVD之间的相互关系,并探讨它们与LSCC浸润、转移及预后的关系。
材料和方法
1.一般资料
收集蚌埠医学院第一附属医院病理科2003年1月—2005年4月存档石蜡包埋LSCC组织标本116例(术前均未行放、化疗)和正常肺组织标本30例,所有病例均有完整的临床病理资料及随访资料,入选病例随访至患者死亡或截止2011年4月,随访时间为8-94个月(中位时间为41.8个月)。本实验是经蚌埠医学院医学伦理委员会批准后实行的。男性103例,女性13例;中央型97例,周围型19例;肿瘤最大径<3.0cm的9例,≥3.0cm的107例;高分化17例,中分化71例,差分化28例;淋巴结转移有47例,无转移有69例;根据AJCC2010版分期标准进行分期,其中I+II期患者有58例,III+IV期患者有58例。年龄34-82岁,中位年龄60.4岁。
对照组30例正常肺组织均取自距癌旁>5.0cm的肺组织,并经病理H&E染色证实为正常肺组织。
2.试剂
鼠抗人maspin(克隆号EAW24)单克隆抗体购自Lab Vision公司,鼠抗人CD44(克隆号DF1485)和CD34(克隆号 QBEnd/10)单克隆抗体,ElivisionTMplus试剂盒以及DAB显色试剂盒均购自福州迈新生物技术开发有限公司。
3.石蜡包埋
组织以4μm后连续切片、烤干,然后在二甲苯溶液及浓度梯度乙醇溶液中脱蜡至水洗。免疫组织化学操作步骤按试剂盒说明书进行,采用已知阳性片作对照,以PBS液替代一抗作空白对照。最后用苏木素淡染细胞核、盐酸酒精分化、返蓝、脱水透明,中性树胶封片。
4.免疫组织化学结果判定
CD44和CD34均以细胞膜或浆出现黄色或棕黄色颗粒为阳性;maspin以细胞核或浆出现黄色或棕黄色颗粒为阳性。MVD通过CD34阳性的小管状结构来计数,方法参考修正的 Weidner法[4]。免疫组织化学结果参考文献[5]所记载的方法进行,最后用染色强度和染色细胞百分比的得分乘积作为判断结果,若积分≤1为阴性,>1为阳性。每例标本均随机计数10个高倍视野(×400倍),免疫组织化学结果由两位病理医生采用独立双盲法阅片判定。
5.统计学分析
采用SPSS20.0统计软件进行数据分析。CD44与maspin蛋白表达与MVD(因MVD计数的中位值为20.9,故以MVD≥21为阳性,<21为阴性)阳性组与阴性组生存分析采用Kaplan-Meier法,组间比较用Log-rank检验;多因素分析采用Cox回归模型分析;在LSCC组织中,CD44和maspin蛋白的表达以及MVD计数与正常肺组织以及各临床病理因素的关系采用Χ2、Spearman等级相关以及t检验,P<0.05为差异有统计学意义。
结 果
1.LSCC组织中CD44蛋白的表达及其与临床病理因素的关系
CD44蛋白在正常肺组织中的阳性表达率为10.0%,在LSCC组织中的阳性表达率为60.3%,两组之间差异有统计学意义。CD44蛋白的阳性表达率在LSCC患者的不同性别、年龄、肿瘤位置、肿瘤大小等之间差异无统计学意义(P>0.05)。随着LSCC组织的分化越差,CD44蛋白的阳性表达率越高,差异有统计学意义(P<0.05);且CD44蛋白的阳性表达率在不同临床分期及淋巴结有无转移之间差异有统计学意义(P<0.05)(见图1A及表1)。
2.LSCC组织中maspin蛋白的表达及其与临床病理因素的关系
maspin蛋白在正常肺组织中的阳性表达率为100%,在LSCC组织中的阳性表达率为39.7%,差异有统计学意义。随着LSCC组织的分化越差、临床分期越高,maspin蛋白的阳性表达率越低,差异有统计学意义;淋巴结转移组中的maspin蛋白阳性表达率低于淋巴结无转移组,差异有统计学意义。maspin蛋白的阳性表达率在不同年龄、性别、肿瘤位置、肿瘤大小等之间差异均无统计学意义(P>0.05)(见图1B及表1)。
3.LSCC组织中MVD计数及其与临床病理因素的关系
随着LSCC组织的分化越差、临床分期越高,MVD计数就越高,差异有统计学意义;淋巴结转移组中的MVD计数明显高于淋巴结无转移组,差异有统计学意义。MVD计数在不同年龄、性别、肿瘤位置及肿瘤大小之间差异无统计学意义(P>0.05)(见图1B及表2)。
4.LSCC组织中CD44、maspin、MVD计数三者之间的相互关系
在CD44蛋白阳性表达组,MVD计数的均值为26.9±12.3,在CD44蛋白阴性表达组,MVD计数的均值为11.9±8.8,CD44蛋白表达与MVD计数呈正相关关系(r=0.609,P<0.001);在 maspin蛋白阳性表达组,MVD计数的均值为11.0±7.1,maspin蛋白阴性表达组,MVD计数的均值为27.5±12.2,即maspin蛋白表达与MVD计数呈负相关关系(r=-0.661,P<0.001);CD44蛋白表达与maspin蛋白表达之间呈负相关关系(r=-0.640,P<0.001)(见表3)。
5.生存及Cox回归分析
Kaplan-Meier生存分析显示:CD44蛋白阳性表达组患者生存时间明显低于其阴性表达组患者(P<0.001,见图2A);maspin蛋白阳性表达组患者生存时间明显高于其阴性表达组患者(P<0.001,见图2B);MVD≥21组患者的生存时间明显低于MVD<21组患者(P<0.001,见图2C)。Cox回归分析显示:CD44、maspin蛋白表达与TNM分期均是LSCC患者的独立预后因素(P<0.05,见表4)。
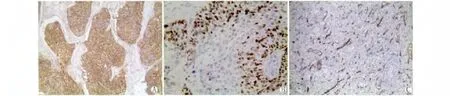
图1 LSCC中CD44、maspin蛋白的表达和MVD计数A:CD44蛋白在LSCC中的阳性表达,主要定位于细胞膜和浆(中分化,Elivision×100)B:maspin蛋白在LSCC中的阳性表达,主要定位于细胞浆和和(中分化,Elivision×400)C:在LSCC中的MVD计数(中分化,Elivision×100)Fig.1 Expression of CD44 and maspin and the score of MVD in LSCCA:positive staining of CD44 in membrane and cytoplasm of LSCC(moderately grade,Elivision×100)B:positive staining of maspin in nuclei and cytoplasm of LSCC(moderately grade,Elivision×100)C:the score of MVD in LSCC(moderately grade,Elivision×100)

图2 CD44和maspin表达阳性组与阴性组及MVD≥21组与<21组LSCC患者生存曲线A:CD44蛋白表达阳性组与阴性组患者生存曲线B:maspin蛋白表达阳性组与阴性组患者生存曲线C:MVD≥21组与<21组患者生存曲线Fig.2 Survival curves of LSCC patients with positive or negative expression of CD44,maspin protein,and MVD scoreA:Survival curves of positive or negative CD44 expressionB:Survival curves of positive or negative maspin expressionC:Survival curves of MVD≥21 group or<21 group
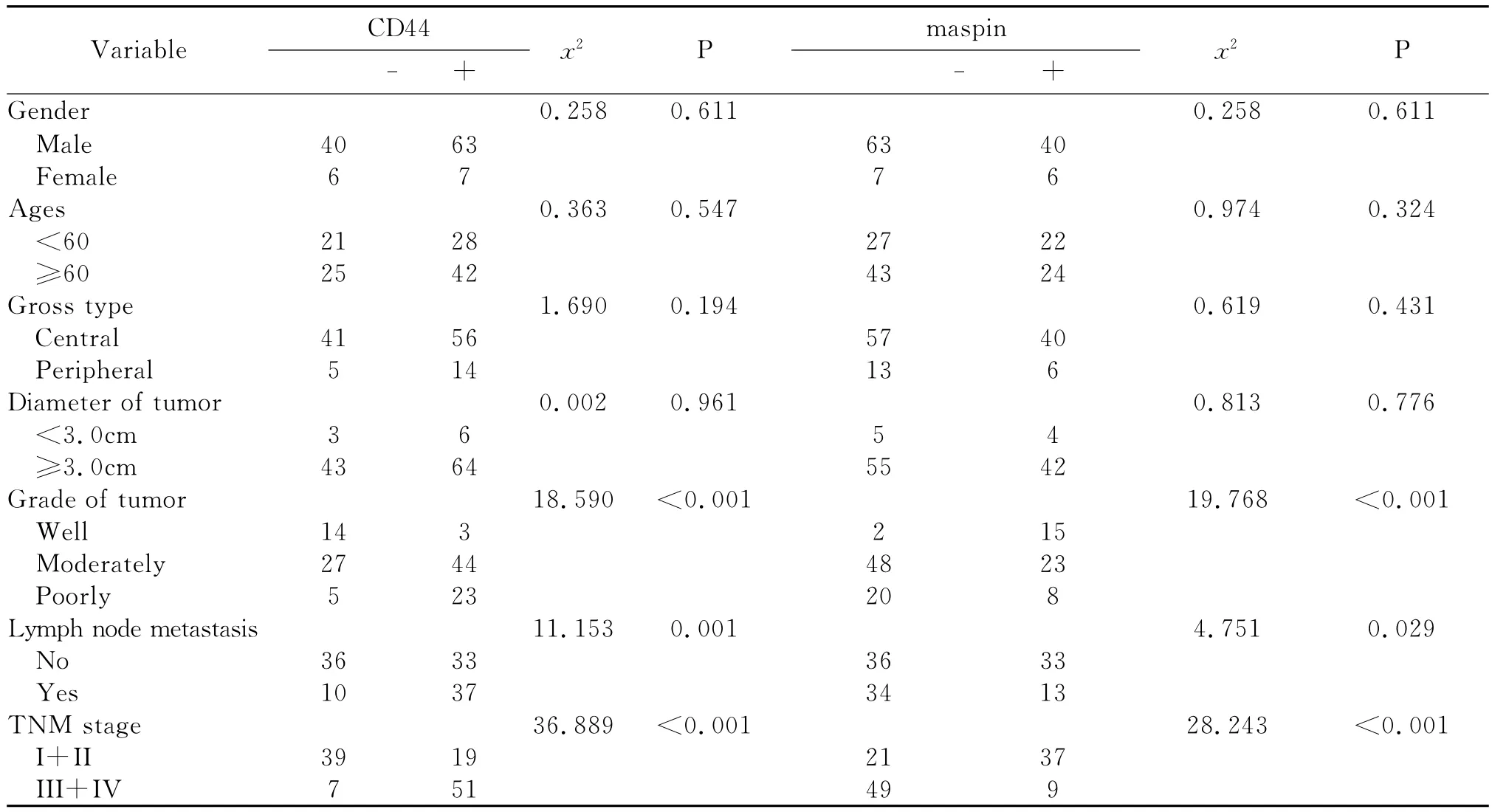
表1 LSCC中CD44和maspin蛋白的表达与临床病理因素之间的相互关系Table 1 Correlation of CD44 and maspin protein expression with clinicopathologic characteristics in LSCC
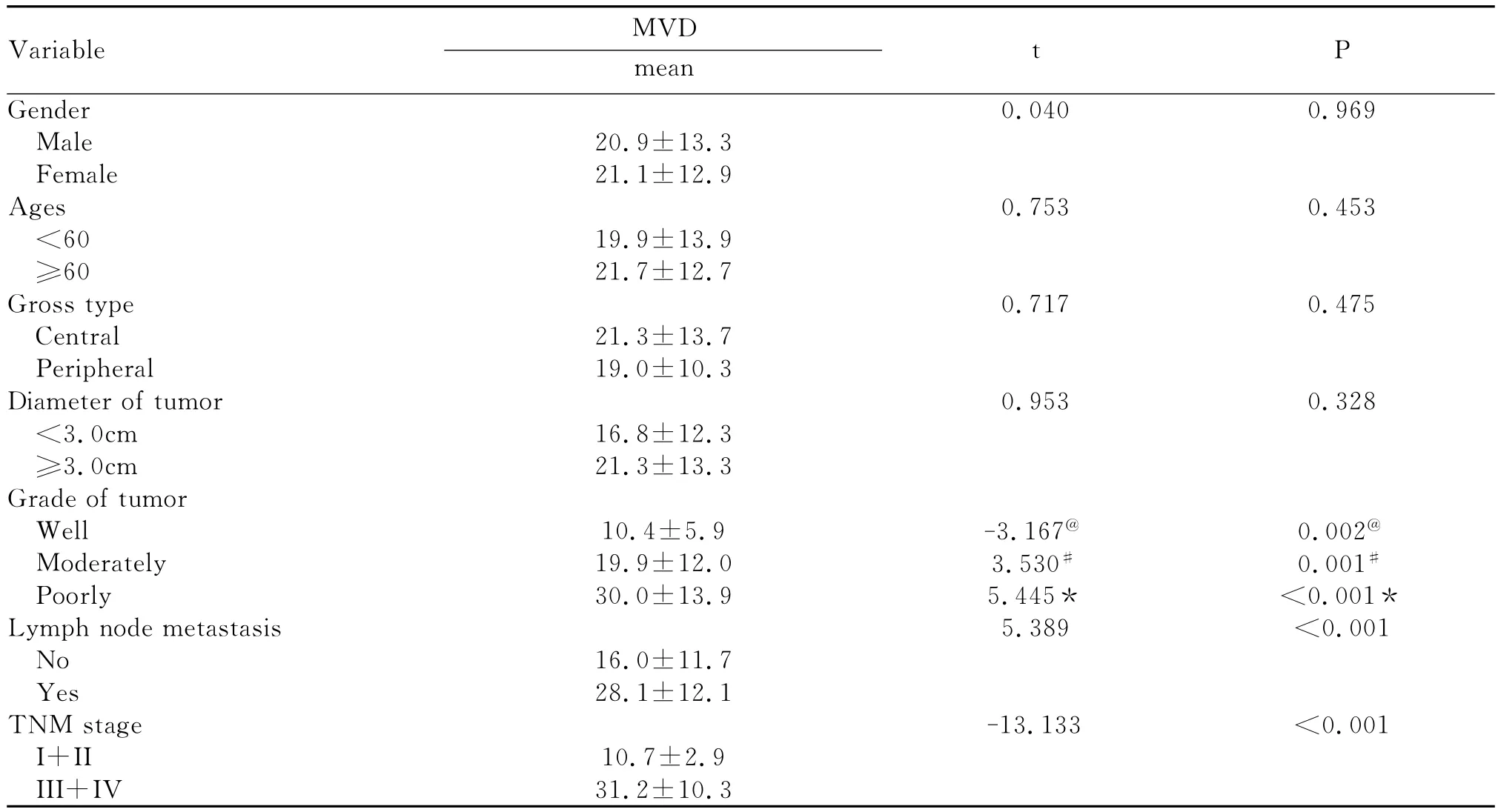
表2 LSCC中MVD计数与临床病理因素之间的关系Table 2 Correlation between the scores of MVD and clinicopathological characteristics in LSCC

表3 LSCC组织中CD44和maspin蛋白表达以及MVD计数之间的相互关系Table 3 the expression of CD44 and maspin protein and the scores of MVD and their relationship in LSCC
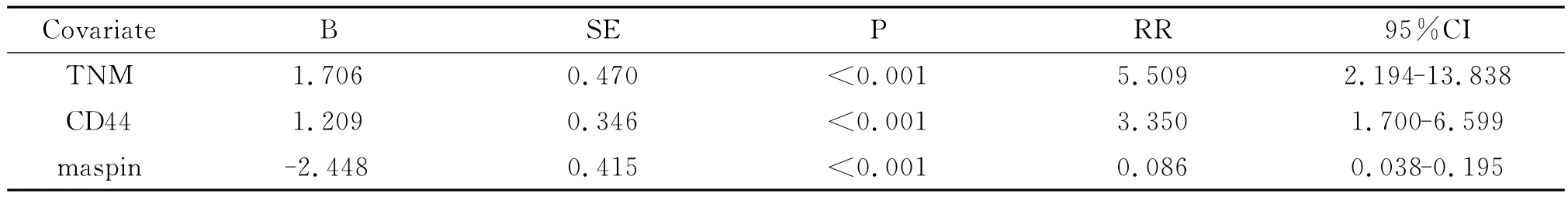
表4 116例LSCC患者多因素分析Table 4 Multivariate survival analysis of 116 patients with LSCC
讨 论
近年来的研究证实,在肺癌肿瘤细胞中可能存在着一些具有干细胞样特性的细胞,即肿瘤干细胞(CSCs)[6-7],CSCs的 存 在 可 能 是 造 成 肿 瘤 无 限 增殖、转移、复发及耐药的最主要原因,并被认为具有遗传性[8]。目前,可以通过细胞表面特异性标志物来分离和纯化肺癌CSCs,常用的干细胞标志物有CD44、乙醛脱氢酶、CD133和Lgr5,已被用于识别正常细胞 和 CSCs[6,9-11]。CD44 为 细 胞 表 面 黏 附 分子,可与透明质酸特异性结合,介导细胞的黏附、血管形成以及肿瘤的增殖、浸润和转移。本研究通过免疫组织化学方法检测LSCC组织中CD44蛋白的表达。发现在116例LSCC组织中,CD44蛋白的阳性表达率为60.3%,其表达率明显比对照组的表达率高,且CD44蛋白的阳性表达率在LSCC患者肿瘤组织的不同分化级别、淋巴结转移与否及临床分期高低之间差异有统计学意义,即CD44蛋白阳性表达的肿瘤细胞分化差、易于浸润、转移。生存分析发现,CD44蛋白阳性表达组患者生存时间短。这个结果表明,CD44蛋白阳性表达的患者预后差,这与其他学者的研究结果一致[12-13]。
maspin是一种抑癌基因,是Zou等[14]通过消减杂交技术发现的,该基因位于人染色体18q21.1-q23,编码一个长度42k Da的蛋白,在正常肺上皮细胞[15]中可以检测到其表达。基因表达缺失是maspin基因表达异常的常见形式,在肺癌中也发现了 maspin基因的表达缺失[16-17]。maspin基因可以调节肿瘤细胞的生长、浸润及转移。在本研究中,我们发现maspin蛋白在对照组和LSCC组中表达是显著减少的,差异有统计学意义;进一步的研究发现,maspin蛋白的表达率与LSCC肿瘤组织的分化程度、淋巴结转移与否及临床分期高低等密切相关。生存分析显示,maspin蛋白阳性表达组患者的生存时间明显高于其阴性表达组患者。上述结果表明,随着maspin蛋白的表达率越低,LSCC肿瘤组织分化越差、临床分期越高、易发生淋巴结转移以及患者的生存时间越短,提示maspin的表达缺失可能会影响LSCC的发生发展、浸润及转移。
侵袭和转移是恶性肿瘤的生物学特征,随着肿瘤的快速增殖,就会发生缺血和缺氧,为保障其生长,肿瘤细胞就会分泌多种诱导血管生成的化学物质从而诱导大量新生血管生成。微血管密度(MVD)是监测血管生成的一个良好指标[18]。本研究发现,在发生淋巴结转移的患者中,其MVD计数显著高于未发生淋巴结转移的患者,且MVD计数LSCC肿瘤组织的分化程度、临床分期及生存时间均密切相关,即MVD计数高的患者生存时间短、肿瘤组织分化差、临床分期高。因此,血管生成在肿瘤的生长、浸润和转移过程中起着极其重要的作用。
对maspin蛋白与CD44蛋白表达、MVD计数进行Spearman相关分析,发现在癌组织中随着maspin蛋白表达率的降低,CD44蛋白的阳性表达率和MVD计数显著升高,呈负相关;而CD44蛋白的阳性表达与MVD计数之间呈正相关。提示maspin、CD44以及MVD计数之间可能存在某种关联。CSCs生存的微环境需要大量新生血管,这样就会促进肿瘤的快速增殖、浸润及转移。正常情况下,maspin可以通过减少与肿瘤相关的MVD数量而抑制肿瘤的生长[19]。随着maspin基因表达的缺失,丧失了对血管生成的抑制,导致大量血管生成,促进了肿瘤的进展。本研究多因素分析表明CD44和maspin的表达情况是影响LSCC患者预后的独立危险因素。
综上所述,CSCs可能是LSCC发生的根源,血管生成以及maspin的表达缺失可能进一步促进LSCC的浸润、转移。因此,联合检测CD44和maspin可作为评估LSCC患者侵袭、转移及预后的指标之一。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics.CA Cancer J Clin,2011,61(2):69-90
[2]Bailey CM,Khalkhali-Ellis Z,Seftor EA,et al.Biological functions of maspin.J Cell Physiol,2006,209(3):617-624
[3]Khalkhali-Ellis Z.Maspin,the new frontier.Clin Cancer Res,2006,12(24):7279-7283
[4]Kumda T,Tsuneyama K,Hatta H,et al.Improved 1-h rapid immunostaining method using intermitten microwave irradiation:practicability based on 5 years application in Toyama Medical and Pharmaceutical University Hospital.Mod Pathol,2004,17(9):1141-1149
[5]武世伍,承泽农,俞岚等.CD82/KAI1和 HIF-1α在非小细胞肺癌中的表达及其与血管生成拟态的关系.中国肺癌杂志,2011,14(12):918-925
[6]Gomez-Casal R,Bhattacharya C,Ganesh N,et al.Nonsmall cell lung cancer cells survived ionizing radiation treatment display cancer stem cell and epithelial-mesenchymal transition phenotypes.Mol Cancer,2013,12(1):94
[7]Akunuru S,James Zhai Q,Zheng Y.Non-small cell lung cancer stem/progenitor cells are enriched in multiple distinct phenotypic subpopulations and exhibit plasticity.Cell Death Dis,2012,3:e352
[8]Barbieri F,Wurth R,Ratto A,et al.Isolation of stemlike cells from spontaneous feline mammary carcinomas:phenotypic characterization and tumorigenic potential.Exp Cell Res,2012,318(7):847-860
[9]Wu S,Yu L,Wang D,et al.Aberrant expression of CD133 in non-small cell lung cancer and its relationship to vasculogenic mimicry.BMC Cancer,2012,12:535
[10]Mao P,Joshi K,Li J,et al.Mesenchymal glioma stem cells are maintained by activated glycolytic metabolism involving aldehyde dehydrogenase 1A3.Proc Natl Acad Sci U S A,2013,110(21):8644-8649
[11]Ryuge S,Sato Y,Jiang SX,et al.O The clinicopathological significance of Lgr5 expression in lung adenocarcinoma.Lung Cancer,2013,82(1):143-148
[12]Okudela K,Woo T,Mitsui H,et al.Expression of the potential cancer stem cell markers,CD133,CD44,ALDH1,andβ-catenin,in primary lung adenocarcinoma--their prognostic significance.Pathol Int,2012,62(12):792-801
[13]Chen SC,Song XM,Chen ZH,et al.Correlation analysis of CD133/CD44 expression in colorectal cancer tissues and 5-year survival rate in colorectal cancer patients.Chinese Journal of Pathophysiology,2011,27(5):883-889
[14]Zou Z,Anisowicz A,Hendrix MJ,et al.Maspin,a serpin with tumor-suppressing activity in human mammary epithelial cells.Science,1994,263(5146):526-529
[15]Lonardo F,Li X,Kaplun A,et al.The natural tumor suppressor protein maspin and potential application in non small cell lung cancer.Curr Pharm Des,2010,16(16):1877-1881
[16]Kim S,Han J,Kim J,et al.Maspin expression is transactivated by p63 and is critical for the modulation of lung cancer progression.Cancer Res,2004,64(19):6900-6905
[17]Nam E,Park C.Maspin suppresses survival of lung cancer cells through modulation of Akt pathway.Cancer Res Treat,2010,42(1):42-47
[18]甄乐锋,叶长生,刘民锋等.D2-40和CD34在乳腺浸润性导管癌中的表达及其意义.南方医科大学学报,2010,30(7):1548-1551
[19]Anil KS,Mavis S,Fletcher MD,et al.Functional role of matrix metalloproteinases in ovarian tumor cell plasticity.Am J Obstet Gynecol,2004,190(4):899-909
