内质网应激特有Caspase-12凋亡途径在高糖刺激的条件永生型小鼠足细胞中的作用
2014-01-04曹延萍潘凤军曹志刚韩志华李亚林段惠军
曹延萍 潘凤军 曹志刚 韩志华 李亚林 刘 杰 段惠军
(1河北医科大学病理教研室,石家庄050017;2邯郸市第一医院肾内科,河北邯郸056002)
肾小球足细胞是终末分化的上皮细胞,几乎没有再生能力,作为肾小球滤过屏障的重要组成部分,在维持肾小球通透性,对抗毛细血管腔内流体静水压方面发挥重要作用,足细胞的丢失是蛋白尿形成的启动机制之一,过多丢失足细胞还会导致肾小球基底膜(glomerular basement membrane,GBM)外露,失去了足细胞支撑的GBM会在毛细血管静水压的作用下,受压突向肾小囊,进而与肾小球壁层上皮细胞黏连,形成肾小球硬化。文献报道凋亡作为导致足细胞丢失的重要因素之一,在糖尿病肾病(diabetic nephropathy,DN)的发病机制中起着关键作用[1,2]。但其凋亡的机制尚有待深入探讨。近年研究发现内质网是一个对多种应激敏感并能传递凋亡信号途径的细胞器,并已证明在糖尿病脏器损害过程中普遍存在。我们的前期研究也证实在糖尿病肾损害过程中,ERS被诱导,并可能通过激活GADD153/CHOP及其特有的 Caspase-12凋亡途径引起肾脏细胞过多丢失,在糖尿病肾病的发病机制中起重要作用[3-4]。为了证实ERS是否通过介导足细胞凋亡参与DN的发生,本研究模拟糖尿病的体外环境,同时以甘露醇作为渗透压对照组,观察体外培养的小鼠足细胞的凋亡情况,并通过检测ERS标志蛋白GRP78及其特有凋亡途径Caspase-12的表达变化,分析两者之间的相关性,探讨ERS在糖尿病肾损害足细胞凋亡中的作用及可能机制。
材料和方法
1.材料
H-2Kb-ts A58转基因小鼠条件永生型小鼠足细胞(购自北京协和医学院基础医学细胞中心)。兔抗GRP78单克隆抗体(Neo Markers公司),CASPASE-12单克隆抗体(abcam生物制品有限公司),TUNEL试剂盒(Promega公司)。
2.方法
2.1 足细胞的培养与分组
H-2Kb-ts A58转基因小鼠条件永生型小鼠足细胞购自北京协和医学院基础医学细胞中心,依据Mundel P等[5]所述方法复苏,培养足细胞,相差显微镜观察细胞形态,待细胞生长速度减慢,体积明显增大,向四周伸出足突诱导成熟分化后可用于实验。待细胞融合达60%-80%,无血清培养基同步24 h后,将实验细胞分成3组:正常糖对照组(NG,D-葡萄糖1 g/l);甘露醇对照组(M,1 g/l D-glucose plus 24.4 mmol/L mannitol)、高糖培养组(HG,D-葡萄糖4.5 g/l),经细胞分组干预刺激12、24、48、72 h后收集细胞及上清液。
2.2 TUNEL法检测细胞凋亡
采用6孔板,按实验分组刺激12、24、48、72 h收集细胞,4%多聚甲醛固定30 min,常规脱蜡至水,蛋白酶K室温下消化,TDT酶反应液37℃孵育1 h,0.3%H2O2抑制内源性过氧化物酶,Streptavidin-HRP室温5 min,DAB显色,苏木精复染。阴性对照采用无酶标记液(删除TDT)代替TDT酶反应液。凋亡细胞核呈棕褐色颗粒,随机选取6个视野,每个视野细胞计数不少于200个细胞,计算阳性细胞的百分率。
2.3 流式细胞术检测细胞凋亡
⑴按实验分组刺激12、24、48、72 h收集细胞,70%乙醇固定。⑵离心(1000 r/min,5 min),洗涤,加入DNA染液(PI 50μg/ml,RNA酶10μg/ml及1%的Triton-X100)1 ml,4℃染色30 min,上机检测。⑶应用Expo32ADC软件分析,二倍体细胞峰前出现一个亚二倍体峰判定为凋亡细胞峰,根据亚二倍体峰的分布组方图计算细胞凋亡率。
2.4 免疫细胞化学检测
采用6孔板,按实验分组刺激12、24、48、72 h收集细胞,4%多聚甲醛固定30 min,常规脱蜡至水,一抗GRP78(1∶100),Caspase-12(1∶1000)稀释,二抗为生物素化山羊抗兔IgG,PBS替代一抗作为阴性对照,DAB显微镜控制下显色。免疫细胞化学结果应用IPP图文分析软件分析,每张切片取10个高倍视野,综合阳性面积和染色深度计算阳性区域的积分光密度值(IOD),以各组的均值进行比较。
2.5 Western blot检测
按实验分组刺激12、24、48、72 h收集细胞,冰冷PBS洗2遍,加入冰冷的裂解液(20 mmol/l Tris-HCl,2.5 mmol/l EDTA,10% 甘 油,0.1%SDS,1%Triton X-100,1%去氧胆酸钠,10 mmol/l焦磷酸钠,50 mmol/L 氟化钠,1 mmol/l矾酸钠,1 mmol/l PMSF)300μl,冰浴1 h,4℃、12000 r/min-1离心25 min,取上清液。采用考马司亮蓝法测定上清液蛋白浓度,取细胞裂解蛋白50μg,经10%十二烷基硫酸钠-聚丙烯酰胺(SDS2PAGE)凝胶电泳后电转移至PVDF膜,5%脱脂奶粉封闭PVDF膜2 h,加 入 兔 抗 GRP78、Caspase-12 和 β-actin(1∶1000)多克隆抗体,4℃过夜。洗膜后加辣根过氧化物酶标记的羊抗兔抗体(1∶5 000稀释),37℃孵育2 h,TTBS洗膜后加辣根过氧化物酶标记的羊抗兔IgG(1∶5000稀释),37℃孵育1.5 h;TTBS洗膜,滴加ECL(增强化学发光)试剂,将PVDF膜放入X光片暗盒,在暗室中压片,显影,定影。用美国UVP公司Lab Works 4.5软件对Western blot条带进行定量分析,读取积分光密度值(IOD)。
3.统计学分析
结 果
1.高糖诱导了条件永生型小鼠足细胞凋亡
TUNEL分析结果显示,正常糖对照组及甘露醇对照组均有少许足细胞凋亡,随时间延长细胞凋亡率无统计学差异,于72 h时二组足细胞凋亡率分别为5.8±2.1%及6.7±1.2%,高糖刺激组于12 h及24 h亦有少许足细胞凋亡,但与正常糖对照组及甘露醇组细胞凋亡率无明显统计学差异,自48 h起,高糖组足细胞凋亡率较对照组明显升高(16.3±2.1%),并呈时间依赖性,72 h时足细胞凋亡率达36.3±2.6%,流式细胞术结果与TUNEL趋势大致相同;正常糖对照组与甘露醇对照组间足细胞凋亡率无统计学差异(图1)。

图1 高糖对足细胞凋亡的影响。将分化成熟的足细胞分成3组:正常糖对照组(NG):D-葡萄糖1 g/L;渗透压对照组(MG):D-葡萄糖1 g/L+24.4 mmol/l甘露醇;高糖刺激组(HG):D-葡萄糖4.5 g/L;自48 h起,高糖刺激组足细胞凋亡率较对照组明显升高。A:TUNEL检测足细胞凋亡。B:随机选取6个细胞数超过200个细胞的视野,计TUNEL阳性的足细胞凋亡率。C:流式细胞术检测足细胞凋亡。D:流式细胞术计算足细胞凋亡率。Fig.1 Effects of HG on podocyte apoptosis.Podocytes were incubated with 1 g/l D-glucose(NG group),1 g/l D-glucose plus 24.4 mmol/l mannitol(M group,anosmotic control)and 4.5 g/l D-glucose(HG group)for 12,24,48 and 72 h.Compare with that in control group,the podocyte apoptosis rate in HG increased from 48 h.A:Apoptosis in podocytes was detected using the TUNEL method.Arrows indicate TUBEL-positive(apoptotic)cells.B:TUNEL-positive(apoptotic)cells were counted out of a total of more than 200 cells over six random fields.The results were expressed as apoptosis cell(%).C:Apoptosis were detected using flow cytometry.D:The results of flow cytometry were expressed as apoptosis rate(%).Values are expressed as the mean±SD.**P<0.01,HG versus NG;##P<0.01,HG versus M.
2.高糖刺激上调了ERS标志蛋白GRP78在条件永生型小鼠足细胞中的表达
GRP78是重要的内质网分子伴侣蛋白之一,免疫细胞化学结果显示,GRP78在足细胞胞浆表达,呈棕黄色颗粒状。正常糖对照组及甘露醇对照组阳性表达较弱,高糖刺激组GRP78阳性细胞数明显增多。Western blot分析结果显示与正常糖对照组及甘露醇组相比,高糖刺激组GRP78于12 h表达升高,24 h表达达高峰(P<0.05),之后呈下降趋势,72 h时表达基本降至正常水平,与对照组无统计学差异;正常糖对照组与甘露醇对照组间GRP78的表达无统计学差异(图2)。
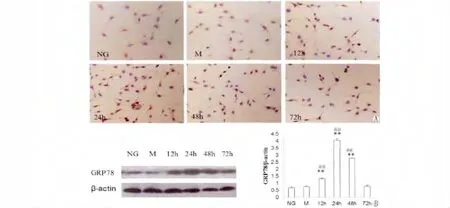
图2 高糖对足细胞中GRP78蛋白表达的影响。A:免疫组化检测GRP78蛋白在足细胞中的表达(×100)。B:Western blot检测GRP78蛋白在足细胞中的表达。对Western条带进行定量分析,以管家基因β-actin作为内参照校正,以目的调带和管家基因条带积分光密度值比值作为最终结果。Fig.2 Effects of HG on GRP78 protein levels in podocytes.Podocytes were incubated with high glucose(HG,4.5 g/l)from 12 to 72 h.A:GRP78 positive expression was detected by immunocytochemical staining(100×).B:Expression of GRP78 protein was analyzed by Western blot.The level of GRP78 protein was quantified by densitometric analysis and normalized to the level ofβ-actin.Values are expressed as the mean±SD.**P<0.05 versus control.
3.高糖刺激在条件永生型小鼠足细胞中激活了ERS特有的Caspase-12凋亡途径
Caspase-12定位于ER外膜,在膜受体或线粒体凋亡途径中不被活化,是ERS特有的凋亡途径。免疫细胞化学结果显示,Caspase-12在三组足细胞胞浆均有表达,呈棕黄色颗粒状,在高糖刺激组表达较正常糖对照组及甘露醇组表达明显增多。Western blot分析结果显示,高糖刺激组Caspase-12表达于各时间点均高于正常糖对照组及甘露醇组,并呈时间依赖性(P<0.05)。正常糖对照组与甘露醇对照组间Caspase-12的表达无统计学差异(图3)。
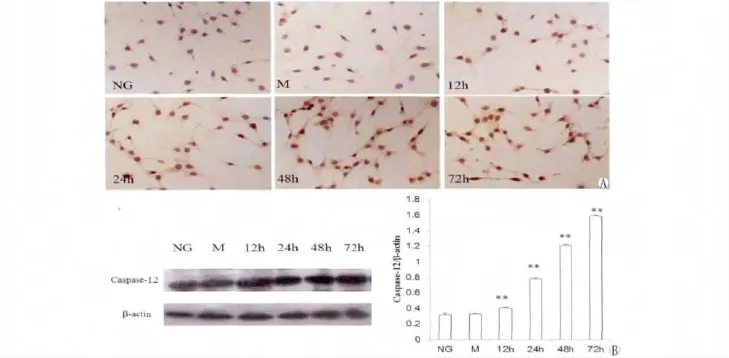
图3 高糖对足细胞中Caspase-12蛋白表达的影响。A:免疫组化检测Caspase-12蛋白在足细胞中的表达(×100)。B:Western blot检测Caspase-12蛋白在足细胞中的表达。对Western条带进行定量分析,以管家基因β-actin作为内参照校正,以目的调带和管家基因条带积分光密度值比值作为最终结果。Fig.3 Effects of HG on Gaspase-12 protein levels in podocytes.Podocytes were incubated with high glucose(HG,4.5 g/l)from 12 to 72 h.A:Caspase-12 positive expression was detected by immunocytochemical staining(100×).B:Expression of Caspase-12 protein was analyzed by Western blot.The level of Caspase-12 protein was quantified by densitometric analysis and normalized to the level ofβ-actin.Values are expressed as the mean±SD.**P<0.05 versus control.
4.高糖刺激的条件永生型小鼠足细胞凋亡数与Caspase-12蛋白表达的相关性分析
相关性分析结果显示,Caspase-12蛋白表达与高糖刺激的条件永生型小鼠足细胞凋亡率呈正相关,相关系数为r=0.915,P<0.01。
讨 论
DN是糖尿病严重并发症之一,既往研究认为,细胞外基质(extracellular matrix,ECM)过度积聚、肾小球硬化、小管扩张与萎缩、间质纤维化是DN特征性病理改变,近年来,随着对肾小球滤过屏障结构和功能改变研究的深入,作为肾小球滤过屏障主要组成部分的足细胞在DN发生发展中的作用,逐渐成为研究热点[1]。足细胞即肾小球脏层上皮细胞,它附着在肾小球基底膜的外侧,与小球基膜及毛细血管内皮细胞共同组成小球的滤过屏障,足细胞的足突通过与肌动蛋白、肌球蛋白等结构调节肾小球基底膜的肌原张力,与肾小球内皮细胞、基底膜共同抵抗毛细血管内的流水静压,维持毛细血管襻结构的稳定,并一定程度上清除肾小囊腔的免疫复合物及某些大分子物质[6]。足细胞又是终末分化的上皮细胞,缺乏再生能力,Toyoda等[7-8]研究证明,足细胞的损伤与DN蛋白尿及肾功能损害密切相关,Susztak K[9]在小鼠Ⅰ型、Ⅱ型DM模型中发现足细胞凋亡增多并伴随蛋白尿的形成,并在体内外实验中证实,高糖引起氧化反应簇(reactive oxygen specie,ROS)产生增多,参与了足细胞的凋亡,导致其数量和密度的下降,肾小球的通透性和基膜完整性受损,蛋白尿的发生并最终形成肾小球硬化,是DN早期发病的重要机制。
凋亡的起源问题,既往认为线粒体在其发生过程中起核心作用,近来研究结果证明,内质网在控制细胞命运中具有更重要的作用。内质网(ER)是真核细胞中蛋白质翻译合成和细胞内钙离子的储存场所,对细胞应激反应起调节作用。缺血、缺氧、错误折叠蛋白的积聚、Ca2+稳态失衡等都可干扰内质网正常生理功能,这种亚细胞器病理状态称为内质网应激(endoplasmic reticulum stress,ERS)。ERS最初诱导适应性的未折叠蛋白反应(unfolded protein response,UPR),通过上调内质网中分子伴侣的表达,增强内质网蛋白折叠的功能,改变其转录及翻译过程,减少蛋白合成,降低进入内质网的蛋白量,同时细胞还可以通过上调内质网蛋白降解途径的相关基因表达,加速未折叠蛋白的降解过程,因此UPR最初的目的是为了促进细胞对内环境的适应能力,以期重建正常的内质网功能。UPR一条主要的途径就是上调内质网分子伴侣,帮助修复未折叠蛋白,及时有效的逆转ERS,增强细胞的存活能力。GRP78属于热休克蛋白(HSP70)家族,也称免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein,BiP),是内质网分子伴侣蛋白之一,生理情况下,GRP78在基础水平表达,主要功能是作为分子伴侣参与新生多肽链的折叠、装配和转运,通过与内质网应激元件PERK、IRE1以及ATF6的结合,抑制ERS的激活[10],GRP78的诱导广泛被认为是ERS的标志性分子[11]。ERS被诱导后,未折叠蛋白在内质网内堆积,使GRP78从3种跨膜蛋白上解离下来,从而去结合未折叠蛋白,解离后的感受蛋白被活化并启动UPR,减低未折叠或错误折叠蛋白在ER内的积聚,恢复内质网的正常功能。GRP78是触发UPR的关键蛋白,显示出细胞保护的潜在作用,有研究表明细胞过表达GRP78可以有效抵抗ERS[12]。尽管早期ERS通过激活UPR及时有效的逆转ERS增强细胞的存活能力,但ERS持续存在时,凋亡将是其最终的结局。ERS可以激活多条途径诱导细胞凋亡,尽管ERS介导的凋亡途径并没有完全阐明,但是内质网膜上的Caspase-12的活化已经被确认参与这个过程[13]。Caspase-12定位于ER外膜,是介导ERS凋亡的关键蛋白酶,在膜受体或线粒体凋亡途径中不被活化,是ERS特有的凋亡途径。Rao等报道ERS导致GRP78-procaspase12-procaspase7复合物形成,过度应激最终使这一多聚复合物裂解,释放活性Caspase-12,激活其下游的Caspase级联凋亡途径。
研究表明,高糖可以诱导引起ERS的许多因素[14],据报道,高糖影响内环境中的 Ca2+,抑制Ca2+通过内质网的能力,使得Ca2+在内质网储积、释放以及再次泵入障碍,并且,高糖易引起氧化产生过氧化氢并产生活性中间体,氧化应激在DM肾损伤中起重要作用[15,16]。除了高血糖,低氧、脂质沉积、分泌性蛋白合成增多等因素均可引起ERS。我们前期的研究结果显示,DM大鼠肾损害过程中诱导了 ERS,其相关凋亡途径 CHOP/GADD153、Caspase-12可能参与了肾脏固有细胞凋亡并在DM的发生发展中发挥重要作用[3,4]。这促使我们采用体外培养条件永生性小鼠足细胞作为研究对象,排除其他干扰,探讨ERS在足细胞凋亡中的作用及其相关机制。
我们的研究结果显示,与正常糖对照组相比,高糖刺激组GRP78于12 h表达升高,24 h表达达高峰(P<0.05),之后呈下降趋势,72 h时表达基本降至正常水平,与对照组无统计学差异;ERS特有凋亡途径Caspase-12蛋白在高糖组的表达较正常对照组明显增高,并随着时间的延长表达呈增高的趋势。这些结果提示高糖刺激的足细胞很快诱导了ERS,一方面积极调动UPR反应蛋白,以抵御应激诱因造成的不利影响,调整内质网功能以适应新的内环境变化要求,但这种保护作用是短暂的;与此同时,也表达了Caspase-12,这种ERS特有的可能导致细胞死亡的蛋白。结果还显示高糖刺激组在12 h及24 h有少许条件永生型小鼠足细胞发生凋亡,但较正常糖对照组、甘露醇组足细胞凋亡率并无统计学差异,随着刺激时间的延长,于48 h高糖组足细胞凋亡率较两对照组均明显升高,并随时间延长呈增多趋势,相关性分析结果显示,Caspase-12蛋白表达与高糖刺激的条件永生型小鼠足细胞凋亡率呈正相关,相关系数为r=0.915,P<0.01。我们推测起初由于UPR的保护作用,足细胞的凋亡率较对照组并无明显增多,随着应激反应的进一步演进,短暂的UPR不足以恢复内质网功能,通过Caspase-12凋亡途径诱导足细胞的凋亡作用来摧毁这些受损的细胞可能是解决内质网应激受损细胞不得已的最后措施,以最后清除那些根本无法恢复到正常功能状态的应激细胞,这可能在DM肾组织损害病理过程中发挥重要作用,但仍需我们进一步通过干扰ERS不同环节,更加明确ERS在糖尿病肾损伤发病机制中的作用,从而更深入的了解DM肾损伤的潜在分子机制,为疾病治疗方案的全新设计提供新思路。
[1]Sieber J,Lindenmeyer MT,Kampe K,et al.Regulation of Podocyte Survival and Endoplasmic Reticulum Stress by Fatty Acids.Am J Physiol Renal Physiol,2010,299(4):821-829
[2]Kaneto H,Matsuoka TA,Nakatani Y,et al.Oxidative stress,ER stress,and the JNK pathway in type 2 diabetes.J Mol Med,2005,83(6):429-439
[3]曹延萍,李航,王建等.转录因子GADDl53/CHOP的激活与糖尿病大鼠肾组织固有细胞凋亡的关系初探.中国组织化学与细胞化学杂志,2010,19(5):453-456
[4]曹延萍,郝咏梅,刘青娟等.内质网应激及其特有凋亡途径Caspase-12与糖尿病大鼠肾组织固有细胞凋亡之间的关系.中国应用生理学杂志,2011,27(2):236-240
[5]Mundel P,Reiser J,Zúñiga Mejía Borja A,et al.Rearrangements of the cytoskeleton and cell contacts induce process formation during differentiation of conditionally immortalized mouse podocyte cell lines.Exp Cell Res,1997,236(1):248-58
[6]Petermann AT,Krofft R,Blonski M,et al.Podocytes that detach in experimental membranous nephropathy are viable.Kidney Int,2003,64(64):1222-1231
[7]Toyoda M,Najafian B,Kim Y,et al.Podocyte detachment and reduced glomerular capillary endothelial fenestration in human typeⅠdiabetic nephropathy.Diabetes,2007,56(8):2155-2160
[8]Meyer TW,Benett PH,Nelson RG,et a1.Podocyte number predicts long-term urinary album in excretion in Pima Indians with typeⅡdiabetes and microalbuminuria.Diabetologia,1999,42(11):1341-1344
[9]Susztak K,Raff AC,Schiffer M,et al.Glucose-induced reactive oxygen species cause apoptosis of podocytes and podocyte depletion at the onset of diabetic nephropathy.Diabetes,2006,55(1):225-233
[10]Rao RV,Peel A,Logvinova A,et al.Coupling endoplasmic reticulum stress to the cell death program:role of the ER chaperone GRP78.FEBS Lett,2002,514(2-3):122-128
[11]Ni M,Lee A S.ER chaperones in mammalian development and human diseases.FEBS Lett,2007,581(19):3641-3651
[12]Morris JA,Dorner AJ,Edwards CA,et al.Immunoglobulin binding protein(BiP)function is required to protect cells from endoplasmic reticulum stress but is not required for the secretion of selective proteins.J Biol Chem,1997,272(7):4327-4334
[13]Zhang K,Kaufman RJ.The unfolded protein response:A stress signaling pathway critical for health and disease.Neurology,2006,66(2 Suppl 1):S102-9
[14]Cheng DW,Jiang Y,Shalev A,et al.An analysis of high glucose and glucosamine-induced gene expression and oxidative stress in renal mesangial cells.Arch Physiol Biochem,2006,112(4-5):189-218
[15]Kaneto H,Matsuoka TA,Nakatani Y,et al.Oxidative stress,ER stress,and the JNK pathway in type 2 diabetes.J Mol Med,2005,83(6):429-439
[16]King GL,Loeken MR.Hyperglycemia-induced oxidative stress in diabetic complications.Histochem Cell Biol,2004,122(4):333-338
