竹材木质素高效降解菌的分离筛选及鉴定
2014-01-03刘君昂周国英
刘 剑,刘君昂,周国英,李 河,杨 菁
(中南林业科技大学 经济林培育与保护省部共建教育部重点实验室,湖南 长沙 410004)
竹材木质素高效降解菌的分离筛选及鉴定
刘 剑,刘君昂,周国英,李 河,杨 菁
(中南林业科技大学 经济林培育与保护省部共建教育部重点实验室,湖南 长沙 410004)
采用愈创木酚变色、苯胺蓝平板退色和酶活性测定筛选出高效降解竹材木质素的菌株。结果表明:通过腐烂的竹材等34份样品分离纯化出139株真菌;通过0.04%愈创木酚和0.1‰苯胺蓝平板初筛,从分离纯化的139株真菌中筛选出具有产木质素降解酶活性的7株降解菌;7株降解菌经液体产酶培养基复筛得到2株高效产降解木质素酶活的菌株:培养7 d,漆酶、木质素过氧化物酶和锰过氧化物酶活性分别达72.558、23.769、55.044 和34.611、38.781、82.646 U/mL;2株降解菌FG-35和FG-98 分别鉴定为革耳菌Panus lecomtei和烟管菌Bjerkandera adustus。
竹材;木质素;降解菌;分离筛选;鉴定
我国竹材资源非常丰富,栽培面积达7.20×106hm2,占到世界竹材面积的40%,同时我国的竹林面积增长较快,仅湖南省的竹林面积达6.278×105hm2。而竹纤维具有抗菌性、吸湿性、透气性等优点被称为继棉、麻、丝、毛之后的“第五大纤维”,因此有关竹原纤维的开发很有必要[1-5]。但由于木质素是由苯丙烷结构构成的高分子聚合物,具有化学结构复杂、物理和化学性质不均一、极性强与纤维素等物质结合紧密等问题,从而使木质素难降解,而木质素在自然界中完全降解是由于多种微生物共同作用的结果,其中真菌起主要的降解作用,典型的木质素降解菌是白腐真菌。目前有关木质素降解菌株的研究主要集中在黄孢原毛平革菌Phanerochaete chrysosporium、变色栓菌Trametes versicolor等白腐菌[6-10],而关于竹材木质素的微生物降解菌株的筛选报道研究却很少。基于此,该研究从腐烂的竹材中筛选出2株对竹材木质素降解有很高酶活性的真菌菌株,为生物酶法制备竹原纤维提供依据和支持。
1 材料与方法
1.1 材 料
分离样品所采用的腐烂竹材均采于湖南省攸县黄丰桥国有林场天然竹林。
1.2 培养基
真菌培养基:PDA基础培养基;PDA-愈创木酚培养基:PDA基础培养基中添加愈创木酚(质量浓度计0.04%);PDA-苯胺蓝培养基:PDA基础培养基中加入苯胺蓝(质量浓度计0.1‰)[11];液态产酶培养基:参考文献[12]。
1.3 方 法
1.3.1 竹材木质素降解菌株筛选
竹材木质素降解菌株的分离纯化;降解菌株的愈创木酚显色筛选:将分离纯化的菌株通过愈创木酚法进行初筛。方法参考文献略有改动[13-14],在实验中加入0.04%质量浓度的愈创木酚;降解菌株的苯胺蓝退色筛选:将分离纯化的菌株通过苯胺蓝退色法进行筛选方法参考文献[11-15];降解菌株的复筛;3种主要降解木质素酶活力的测定:漆酶(Lac)活性测定采用愈创木酚法[16];木质素过氧化物酶(LiP)活性的测定方法:采用藜芦醇法[17];锰过氧化物酶(MnP)活性的测定方法[18]。
1.3.2 竹材木质素降解菌株鉴定
(1)菌落的形态学观察;(2)菌株的ITS分子鉴定:降解菌株基因组总DNA的提取方法采用CTAB法[19];对18SrDNA转录间隔区的引物ITS1和ITS4进行PCR扩增[20];PCR扩增条件参考文献[21],将PCR扩增的产物委托铂尚生物技术(上海)有限公司测序;再利用MEGA软件进行系统进化发育分析,构建菌株的系统进化树。
2 结果与分析
2.1 竹材木质素降解菌的筛选与分离
根据菌落形态通过菌液稀释和平板划线法从34份样品中分离纯化得到139株真菌。
2.2 竹材木质素降解菌株的初筛
2.2.1 PDA-愈创木酚平板显色反应
由2.1所分离纯化的139株真菌进行PDA-愈创木酚平板反应试验,其中23株真菌在PDA-愈创木酚平板上先后发生了不同程度的显色反应,颜色反应结果见表1,发生颜色变化的显色图见图1(A)。

表1 初筛木质素降解菌的愈创木酚显色†Table 1 Primary screen results of discoloration in guaiacol-PDA plates by lignin-degrading fungus
由表1可以看出,只有23株真菌在愈创木酚的平板上发生了显色反应(见图1),可以清晰的看出PDA-愈创木酚平板上有明显的红褐色的显色圈。其中 FG-25、FG-35、FG-44、FG-48、FG-54、FG-65和FG-98等7株菌株发生显色的时间较快且颜色变化程度也逐渐加深,说明这7株真菌产漆酶能力较强;而菌株FG-03、FG-11、FG-14、FG-15、FG-17、FG-18、FG-28、FG-32、FG-39、FG-46、FG-64、FG-78、FG-80等 16个菌株发生显色时间较晚,并且颜色变化不明显,初步说明这16株产漆酶能力不强。
2.2.2 PDA-苯胺蓝平板退色反应
根据愈创木酚平板变色的结果,使PDA-愈创木酚发生变色的23株真菌进行苯胺蓝退色试验,而23株真菌中仅有7株菌发生了退色反应(实验结果见表2),发生退色反应的退色图见图1(B)。

图1 平板显色反应和退色反应Fig.1 Diagram of color and fading reaction in plate

表2 初筛木质素降解菌的苯胺蓝退色†Table 2 Primary screen results of de-colorization in aniline blue-plates by lignin-degrading fungus
通过表2可以看出,23株使愈创木酚发生变色的菌株在苯胺蓝平板上发生退色反应的只有FG-25、FG-35、FG-44、FG-48、FG-54、FG65- 和FG-98等7株菌,并且退色程度在第7 d和第9 d时发生退色反应比较明显,特别是FG-35、FG-44和FG-98号菌退色程度比较明显,由此可以初步说明7株菌均具有产木质素过氧化物酶等过氧化物酶的能力,特别是FG-35、FG-44和FG-98号3株真菌具有很好的产降解木质素的过氧化物酶的能力;而其他的16株真菌均没有发生退色反应,说明不产生使木质素降解的过氧化物酶类。
2.3 降解木质素菌株的复筛
根据初筛平板的显色反应和退色反应的结果,筛选出产木质素降解酶能力较强的7个菌株(编号分别是 FG-25、FG-35、FG-44、FG-48、FG-54、FG-65和FG-98),分别接种到装有50 mL液体培养基的300 mL三角瓶中,于28 ℃、160 r/min恒温震荡培养箱中培养7 d,对7株真菌进行主要的3种降解酶的测定,测定结果见图2。
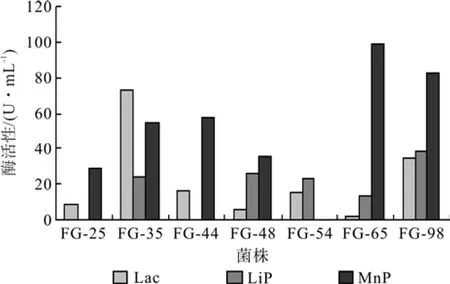
图2 不同菌株的3种木质素降解酶酶活的比较Fig.2 Comparison among 3 kinds of lignin-degrading enzyme activities in different fungus
从图2中可以看出:对于漆酶(Lac),7株菌均有漆酶的产生,菌株FG-35的酶活力最高,菌株FG-98次之,而菌株FG-48和FG-65的产酶能力相对较小。在初筛时虽然在PDA-愈创木酚平板显色反应中有显色反应,但却不如在PDA-苯胺蓝平板退色反应中退色明显,可能这2个菌株产生木质素过氧化物酶的能力更强。对于木质素过氧化物酶(LiP),菌株FG-98酶活力最高,菌株FG-48次之。相比FG-48菌株FG-35稍弱一点;而对于锰过氧化物酶(MnP),菌株FG-65酶活力最高,菌株FG-98次之。虽然菌株FG-48木质素过氧化物酶的活力相对高些,但漆酶和锰过氧化物酶的活力相对较低,同时菌株FG-65锰过氧化物酶的活力最高,但漆酶和木质素过氧化物酶的活力很低。综合以上结果,菌株FG-35和FG-98具有较高的产木质素酶的综合能力。
2.4 菌株FG-35和FG-98的鉴定
菌株FG-35的鉴定:在PDA培养基上观察到的形态特征是菌落呈圆形,白色菌丝,表面绒毛状,与培养基结合紧密,同时测得的碱基序列长度为606 bp,与NCBI的GenBank数据库中的数据进行相似性分析,得出与Panus lecomtei的ITS序列相似性较高达到98%,构建系统进化发育树(见图3)。结果表明,FG-35号菌株与接收号为JQ955726的菌株的ITS区相似性最为接近。因此结合形态学特征,初步确定FG-35菌株为革耳菌Panus lecomtei。
菌株FG-98的鉴定:FG-98号菌落特征是在PDA培养基上呈圆形扁平,白色菌丝,表面棉絮状,与培养基结合不紧密,同时DNA测序得到碱基的序列为751 bp,同时将所测得的序列与GeneBank中的18S rDNA的ITS序列进行比对,进行相似性分析,发现FG-98号菌株与Bjerkandera adustus的ITS序列最为接近,相似性达到99%,构建系统进化发育树(见图4),FG-98菌株与接收号为AY089741的菌株的ITS序列最为接近。结合菌落的形态特征,初步确定FG-98号菌株为烟管菌Bjerkandera adustus。
3 结论与讨论

图3 FG-35菌株的ITS系统发育树Fig.3 ITS phylogenetic tree of the strain FG-35
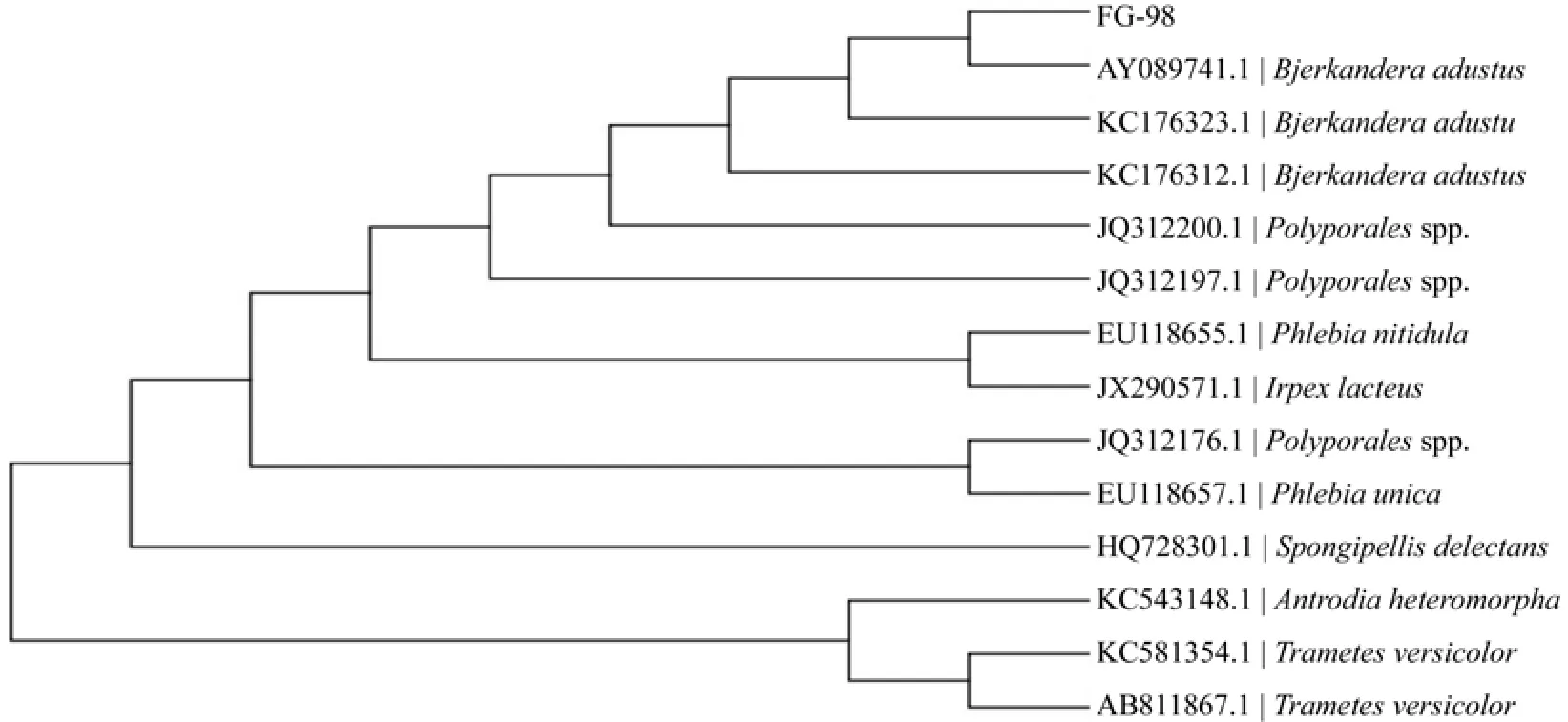
图4 FG-98菌株的ITS系统发育树Fig.4 ITS phylogenetic tree of the strain FG-98
从腐烂的竹材等34份样品中通过平板稀释和平板划线的方法直接分离纯化出139株真菌;对139株真菌进行愈创木酚变色和苯胺蓝退色反应初筛,初步判定得到7株具有降解木质素能力的菌株;而FG-35号和FG-98号菌株不仅在愈创木酚的变色反应中发生变色反应较快且颜色变化程度也比较明显,而且在苯胺蓝的退色反应中发生退色较快同时退色比较完全。
通过木质素降解菌的初筛和复筛最终筛选出7株菌,对7株菌进行木质素酶活力的测定结果表明,FG-35和FG-98号菌株明显比其他5株菌的木质素降解的综合酶活力高。
(3)对得到的2株优良的竹材木质素降解菌进行菌落形态和分子生物学鉴定,确定FG-35和FG-98号菌株分别是侧耳科革耳菌Panus lecomtei和多孔菌科烟管菌Bjerkandera adustus。
(4)木质素的降解一直是研究者研究的一个难题,由于木质素的分子结构比较复杂,针对不同的植物的存在形式不同,也为木质素的降解带来了很大的难度。虽然有关木质素降解的研究有很多,而绝大部分的研究都具有一定的针对性,针对稻草、秸秆和烟草的木质素降解的筛选等相关研究有很多[22-24],但是目前针对竹材木质素降解的研究却很少,而竹材木质素难降解一直是研究的一个难题,从而限制了对竹材的开发和利用。该研究所筛选的菌株是从天然竹林中腐烂的竹材等样品中筛选的菌株,对竹材木质素的降解更具针对性,为研究与降解竹材木质素有关的实际应用提供借鉴和参考。
[1] 江泽慧.世界竹藤[M].沈阳:辽宁科学技术出版社,2002.
[2] 杨开良.我国竹产业发展现状与对策[J].经济林研究,2012,30(2): 140-143.
[3] 黎祖尧,李晓霞.厚竹种质形状与生理活性研究综述[J].经济林研究,2013,31(2):167-170.
[4] 陈建华,胡 健.毛竹种子育苗技术[J].经济林研究,2013,31(2): 151-153.
[5] 石明旺,庞延军,王修强,等.竹类植物分子生物学研究进展及展望[J].经济林研究,2006,24(2):63-68.
[6] 孙正茂,肖克宇.真菌木质素降解酶系的研究进展[J].广东饲料,2006,15(4):41-43.
[7] 燕 红,苏 俊,于彩莲,等.高效木质素降解菌株的分离筛选[J].浙江大学学报:农业与生命科学版,2011,37(3):259-262.
[8] 董旭杰,曹福祥,陈 静,等.3种白腐菌木质素降解酶的比较[J].中南林业科技大学学报,2007,27(6):131-135.
[9] 刘 波,黄慧艳,余洪波,等.木质纤维素各类对白腐菌降级选择性的影响[J].中南林业科技大学学报,2012,32(8):108-111.
[10] 黄慧艳,刘 波,余洪波,等.固体发酵体系中白腐菌Echinodontiumspp.的产酶特性研究[J].中南林业科技大学学报, 2013, 33(3): 25-29.
[11] 蔡 磊,尹峻峰,杨丽萍,等.几种简便的木质素降解真菌定性筛选方法[J].微生物学通报,2002,29(1):67-69.
[12] 王 华,刘小刚,罗 华,等.木质素降解菌株筛选及葡萄枝条木质素降解研究[J].西北农业学报,2009,18(5):302-305.
[13] 刘 敏,张 明.一株产漆酶菌株的筛选鉴定和发酵条件的研究[J].生物学杂志,2008, 25(3):40-43.
[14] 王宜磊,朱 陶,邓振旭.愈创木酚法快速筛选漆酶产生菌[J].生物技术,2007,17(4):40-42.
[15] 杨金水,刘 葳,倪晋仁.木质素降解菌的分离鉴定及木素过氧化物酶的纯化[J].环境科学,2006,27(5):981-985.
[16] 周金燕,张发群,桑原正章.真菌产生的锰过氧化物酶和漆酶的研究[J].微生物学报,1993,33(5):387-391.
[17] Tien M , Kick T K. Lignin-degrading enzyme from Phanerochaete chrysosporium purif i cation characterization catalytic properties of a unique H2O2-requiring oxygenase[J]. Proceedings of the National Academy of Sciences,USA,1984,81(8):2280-2284.
[18] 杜海萍,宋瑞清,王钰祺.几种真菌产木质素降解酶的比较研究[J].林业科技,2006,31(4):20-24.
[19] Hillis DM,Moritz C M,Mable BK. Molecular systematics[M].Massachusetts: Sinauer Associates,1996:407-514.
[20] Sambrook J, Russell D. Molecular Cloning: A Laboratory Manual[M]. 3rd.New York:Cold Spring Harbor Laboratory Press,2001: 304-331.
[21] 李 河,周国英,周德明.用于提取可纺性竹原纤维菌株的选育[J].中南林学院学报,2006,26(1):48-52.
[22] 邓 勋,宋瑞清,闵 凯,等.高效选择性降解稻草木质素的菌株及其产酶特性的研究[J].吉林农业大学学报,2009,31(4):390-397.
[23] 梁军锋,张洪生,张克强,等.木质素降解菌的筛选及对秸秆的降解研究[J].华北农学报,2009,24(5):206-209.
[24] 王 娜,李 仙,王定伟.烟草木质素降解菌的筛选及在烟草中的应用[J].吉林农业大学学报,2008,23(1):64-67.
Isolation, screening and identif i cation of high effective bamboo-lignin degradation fungus
LIU Jian, LIU Jun-ang, ZHOU Guo-ying, LI He, YANG Jing
(Key Lab. of Cultivation and Protection for Non-Wood Forest Trees Co-constructed by Provinces and State Ministry of Education,Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
Fungal strains with highly lignin-degrading enzymes activity were screened by colorful reactions of guaiacol-PDA plates,aniline blue-plates and determination of enzymes activity. The results indicate that the 139 fungal strains of fungi were isolated and purif i ed from 34 decayed bamboo samples; And the 7 fungal strains with highly enzymes activity were fi nally obtained from 139 fungal strains by using guaiacol-PDA plates (containing 0.04% guaiacol) and aniline blue-plates; Then the 7 fungal strains were taken into the liquid medium for determining their’s enzymes activity; Finally, two fungal strains (FG-35, FG-98) with the highly lignin-degrading enzymes activity, were produced after were cultivate for 7 days, which were identif i ed to be Panus lecomtei and Bjerkandera adustus;The Lac activities, LiP activities and MnP activities of the two fungal strains were: 72.558, 23.769, 55.044 and 34.611, 38.781, 82.646U/mL, respectively.
bamboo wood; lignin; degrading fungus; isolation and screening; identif i cation
S795;S718.8
A
1673-923X(2014)08-0048-05
2013-09-28
湖南省科技重大专项(2011FJ1006);林业公益性行业科研专项经费项目(201004014);中南林业科技大学研究生科技创新基金项目(CX2012B15)
刘 剑(1986-),男,内蒙古赤峰人,硕士研究生,主要从事林业应用微生物研究
周国英(1966-),女,湖北应城人,教授,博士,主要从事林业微生物研究;E-mail:gyzhou2118@163.com
[本文编校:文凤鸣]
