血清胃蛋白酶原、CEA、CA19-9及CA72-4检测对胃癌的诊断价值探讨
2014-01-02张金锋
张金锋
(义乌市中心医院,浙江义乌322000)
胃癌是目前世界上常见的消化道恶性肿瘤之一,发病率呈逐年上升趋势,其症状的非特异性常导致被临床忽视而延误诊治。因此,早期诊断胃癌在临床上有重要意义。关于胃癌血清肿瘤标志物检测的报道较多,其敏感性和特异性有较大差异。如果在胃癌早期及进展阶段即能进行准确的检测并给予合理的针对性治疗,对于患者的诊断及预后无疑是大有裨益的。选择适当的肿瘤标志物进行联合检测可提高检测的有效性及诊断的准确性,有利于临床早期诊断和判断病情。本研究探讨了联合检测血清Ⅰ型胃蛋白酶原(typeⅠpepsinogen,PGⅠ)、Ⅱ型胃蛋白酶原(typeⅡpepsinogen,PGⅡ)、PGⅠ/PGⅡ比值及癌胚抗原(carcinoembryonic antigen,CEA)、糖类抗原 19-9(carbohydrate atigen 19-9,CA19-9)、糖类抗原72-4(carbohydrate antigen 72-4,CA72-4)对胃癌的辅助诊断价值。
材料和方法
一、材料
收集义乌市中心医院2013年1至7月经胃镜活检病理确诊的胃癌患者40例(胃癌组),其中男27例,女13例,年龄46~90岁。收集同期浅表性胃炎、十二指肠溃疡等良性胃病患者40例(良性胃病组),其中男30例,女10例,年龄35~70岁。另选取同期健康体检者40名作为正常对照组,男21名,女19名,年龄31~72岁。
二、方法
1.标本检测 采集受检者清晨空腹静脉血,分离血清,立即上机检测。所有检测均使用美国雅培Aeroset全自动生化分析仪和ARCHITECT I2000全自动免疫分析仪及配套试剂,标本测定均严格按照厂家操作说明。
2.判定标准 CEA参考区间为0~5 ng/mL,CA19-9为0~37 U/mL,CA72-4为0~6 IU/mL,PGⅠ为70~160 ng/mL,PGⅠ/PG-Ⅱ比值为≥3。如果CEA、CA19-9、CA72-4的检测结果高于参考区间上限,PGⅠ、PGⅠ/PGⅡ比值的检测结果低于参考区间下限判定为阳性。
三、统计学方法
采用 SPSS 19.0软件进行统计分析。以Kolmogorov-Smirnov测定变量的分布。计量资料呈偏态分布,用中位数(M)和四分位数(P25~P75)表示。两组间比较采用Mann-Whitney U检验。多组间比较采用Kruskal-Wallis检验。采用受试者工作特征(receiver operating characteristics,ROC)曲线计算每个变量诊断胃癌的最佳界值并确定曲线下面积(AUC)、诊断临界值、诊断敏感性和特异性。P<0.05为差异有统计学意义。
结 果
一、3组之间血清 PGⅠ、PGⅠ/PGⅡ比值、CEA、CA19-9、CA72-4水平比较
胃癌组各项指标的检测结果与良性胃病组及正常对照组比较,差异均有统计学意义(P均<0.05);而良性胃病组与正常对照组之间差异均无统计学意义(P均>0.05)。见表1。
二、单项指标及联合检测对胃癌的诊断价值
将胃癌组及良性胃病组血清 PGⅠ、CEA、CA19-9、CA72-4水平及PGⅠ/PGⅡ比值做ROC曲线。ROC曲线显示PGⅠ诊断胃癌的最佳临界值为54 ng/mL(敏感性为63.9%、特异性79.7%、曲线下面积为0.851±0.047),PGⅠ/PGⅡ比值的最佳临界值为4.5(敏感性为75%、特异性为80.6%、曲线下面积为 0.788 ±0.056),CEA 的最佳临界值为3.20 ng/mL(敏感性为56.4%、特异性为 76.9%、曲线下面积为 0.310 ±0.063),CA19-9的最佳临界值为34.05 U/mL(敏感性为54.6%、特异性为69.2%、曲线下面积为0.352±0.065),CA72-4 的最佳临界值 3.18 IU/mL(敏感性为53.8%、特异性为 79.5%、曲线下面积为0.344 ±0.065)。胃癌患者血清 PGⅠ、PGⅠ/PGⅡ比值、CEA、CA19-9、CA72-4联合检测的特异性与单项检测相比差异无统计学意义(P>0.05),而敏感性则明显提高(P<0.05)。见表2及图1~3。
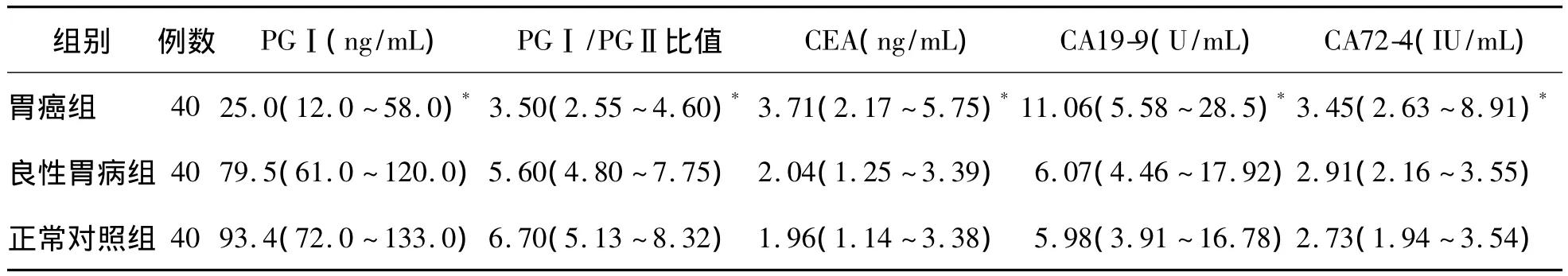
表1 胃癌组、良性胃病组及正常对照组血清PGⅠ、PGⅠ/PGⅡ比值、CEA、CA19-9、CA72-4水平比值[M(P25~P75)]
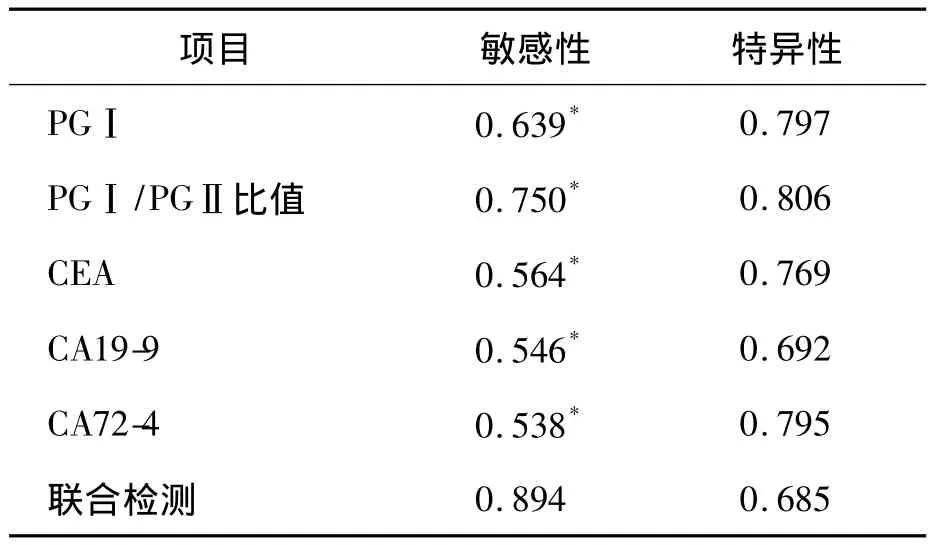
表2 胃癌患者血清 PGⅠ、PGⅠ/PGⅡ比值、CEA、CA19-9、CA72-4单独及联合检测的敏感性及特异性比较 (%)
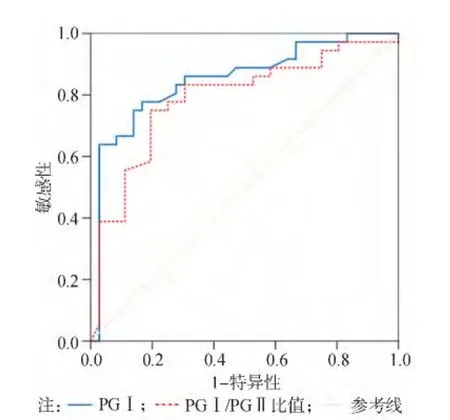
图1 血清PG-Ⅰ、PG-Ⅰ/PG-Ⅱ比值诊断胃癌的ROC曲线
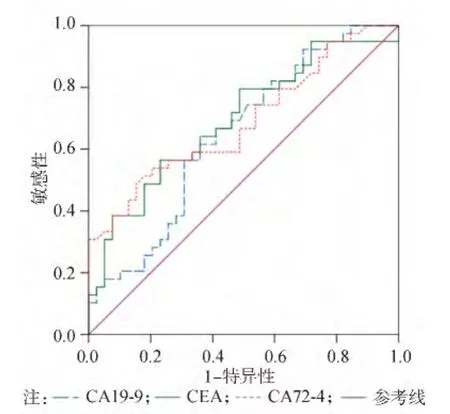
图2 血清CEA、CA19-9、CA72-4诊断胃癌的ROC曲线
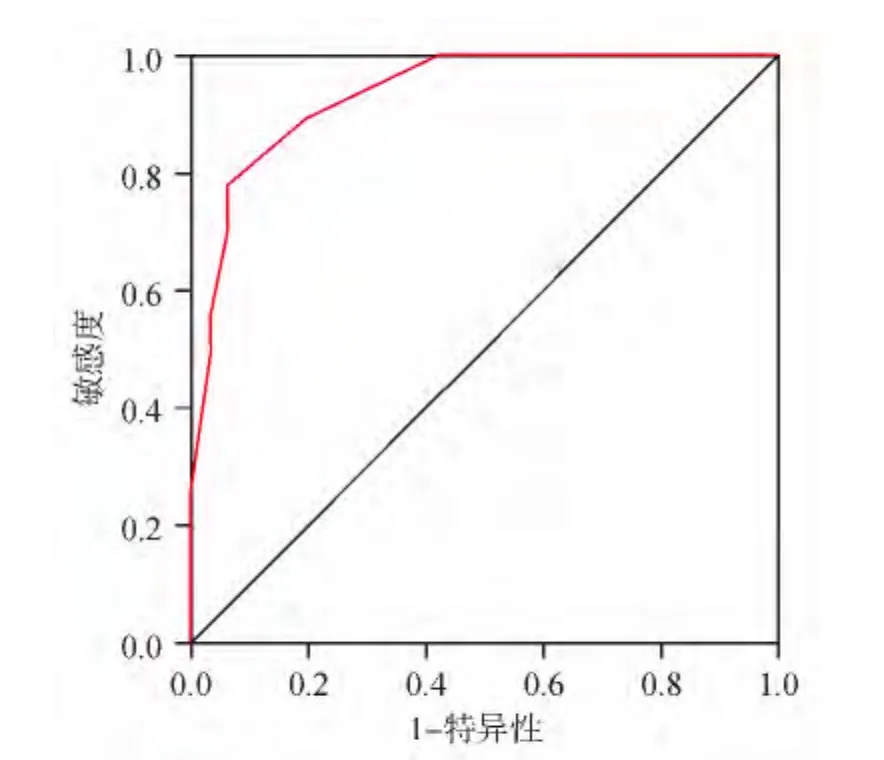
图3 联合检测诊断胃癌的ROC曲线
讨 论
胃癌是常见的恶性肿瘤之一,其死亡率较高的原因之一是胃癌的早期诊断率较低。目前,胃癌的诊断主要依靠胃镜检查加活检,筛查成本高且患者的痛苦较大,不适合大批量人群的筛查。为此,寻找一种简捷经济,对患者创伤小的胃癌早期筛查及术后监测的方法显得十分必要。
PG是胃黏膜主细胞分泌的一种胃蛋白酶的前体,在胃内盐酸或已活化的胃蛋白酶的作用下转变为具有活性的胃蛋白酶。PG根据免疫原性分为两类:PGⅠ和PGⅡ。因为胃几乎是胃蛋白酶原的唯一来源,并且在分泌阶段的分泌量会发生变化,所以血清PGⅠ和PGⅡ反映了胃黏膜腺体和细胞的数量,也间接反映了胃黏膜不同部位的分泌功能[1]。当胃黏膜伴有萎缩时,胃体腺、胃底腺数量减少或被幽门腺所取代,主细胞数量减少,胃黏膜分泌功能受损,PGⅠ水平下降,而PGⅡ水平由于分泌PGⅡ的细胞分布较广以及幽门腺化生等因素保持稳定或仅有轻度增加,导致PGⅠ/PGⅡ比值降低。因此,血清PGⅠ水平和PGⅠ/PGⅡ比值能够反映胃黏膜功能状态。既往研究表明血清PGⅠ水平和PGⅠ/PGⅡ比值可以作为萎缩性胃炎诊断的血清标志物[2]。在慢性浅表性胃炎、萎缩性胃炎、肠上皮化生、异型增生、胃癌这一量变到质变的多阶段渐进性演化过程中,当萎缩发生时,主细胞减少,PGⅠ水平下降;而当萎缩性胃炎伴有肠化胃窦腺假幽门腺化生,PGⅡ含量会随之增高。当肠上皮化生、不典型增生和胃癌时,PGⅠ分泌会减少,PGⅠ/PGⅡ也会发生变化。在日本,PGⅠ/PGⅡ比值<3.0、PGⅠ<70 g/L已被作为胃癌的筛查界值[3]。本研究结果显示PGⅠ的ROC曲线下面积为0.851;当PGⅠ<54 ng/mL时,诊断的敏感性为63.9%,特异性为79.7%。证实了血清PG可作为监测胃癌的一个可靠的标志物。当PGⅠ、PGⅠ/PGⅡ比值的最佳临界值分别为54 ng/mL和4.5时,对胃癌的辅助诊断有一定的参考价值。
CEA是人类胚胎抗原特异性决定簇的酸性糖蛋白,属非器官特异性肿瘤相关抗原,在正常成年人循环血液中含量极微,其升高程度与癌细胞增殖数量密切相关,目前已广泛应用于各种类型肿瘤的检测。本研究结果显示CEA对胃癌的敏感性为56.4%,特异性为76.9%。可见CEA是一种广谱肿瘤标志物,不能作为诊断胃癌的特异性指标。CA19-9是一种黏蛋白型的糖类蛋白肿瘤标志物,为细胞膜上的糖脂质,在血清中以唾液黏蛋白形式存在,分布于正常胎儿胰腺、胆囊、肝、肠和正常成年人胰腺、胆管上皮等处。CA19-9升高可见于胰腺癌及其它恶性肿瘤。在多种腺癌,特别是进展期胃癌中,CA19-9水平也可能升高[4]。CA72-4是一种高分子量糖蛋白抗原,是胃肠道和卵巢肿瘤的标志物。它存在于85%~95%的胃、结肠、胰腺、肺和卵巢肿瘤中,不存在于良性肿瘤、渗出物或正常人组织内。本研究结果显示,CA72-4对胃癌的敏感性为53.8%,特异性为79.5%。由此可见,CA72-4对胃癌的诊断价值不如PGⅠ、PGⅠ/PGⅡ比值。本研究显示PGⅠ、PGⅠ/PGⅡ比值、CEA、CA19-9、CA72-4 联合检测的敏感性为83.4%,特异性为68.5%。由此可见,联合检测对发现和诊断早期胃癌具有一定的实用价值。
综上所述,任何单项一种肿瘤标志物在检测诊断胃癌的敏感性和特异性方面均存在一定的局限性,采用单一肿瘤标志物检测往往会造成漏诊。而联合检测肿瘤标志物可明显地提高肿瘤的阳性检出率。但本研究病例数量有限,还需要大样本资料进行研究验证。随着免疫组织化学及分子生物学的发展,胃癌的病理与免疫学及分子生物学研究之间越来越密不可分,目前已探索了许多与胃癌相关的基因及其蛋白质产物[5]。早期发现这些标志物为探讨胃癌发病机理开辟了新途径,更加能够揭示肿瘤组织的生长特性,从而更加准确地诊断及指导临床治疗。
[1]Zhang X,Xue L,Xing L,et al.Low serum pepsinogenⅠ and pepsinogenⅠ/Ⅱ ratio and Helicobacter pylori infection are associated with increased risk of gastric cancer:14-year follow up result in a rural Chinese community[J].Int J Cancer,2012,130(7):1614-1619.
[2]曹雪源,贾志芳,马洪喜,等.血清抗幽门螺杆菌IgG抗体、胃蛋白酶原水平与胃癌发病的相关性分析[J].中国实验诊断学,2012,16(6):1026-1028.
[3]陶 伟,李亚俊,杨 力.慢性胃炎、胃溃疡及胃癌患者血清胃蛋白酶原水平的研究[J].宁夏医科大学学报,2011,33(11):1054-1057.
[4]Goonelilleke KS,Siriwardena AK.Systematic review of carbohydrateantigen(CA19-9)asabiochemical marker in the diagnosis of pancreatic cancer[J].Eur J Surg Oncol,2007,33(3):266-270.
[5]钱屹崟,倪润洲.胃癌分子病理学中相关肿瘤标志物的研究新进展[J].现代肿瘤医学,2013,21(3):671-675.
