ROC曲线对ELISA检测丙型肝炎抗体阳性判断值的确定和分析
2014-01-02包建玲孟存仁张朝霞
唐 婧,包建玲,孟存仁,张朝霞
(新疆医科大学第一附属医院医学检验中心,新疆乌鲁木齐830054)
丙型肝炎病毒(hepatitis C virus,HCV)感染引起的丙型病毒性肝炎呈全球分布,大约有1.7亿人为HCV感染者,占世界人口的3%,且发展中国家高于发达国家[1]。丙型肝炎病毒抗体(抗HCV)是目前应用最广泛的用于流行病学调查、临床丙型肝炎患者筛查和诊断的检测项目,为丙型肝炎的早发现、早治疗提供了可靠的依据[2]。酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)是抗HCV检测最常用的方法。在免疫定性测定中,确定合适的阳性判断值(Cut-off值)对减少假阳性和假阴性,确保试验的敏感性和特异性具有重要意义[3]。研究表明受试者工作特征(receiver operating characteristic,ROC)曲线是设定 Cut-off值的最佳方法[4]。我们采用ROC曲线确定实验室两种不同酶免分析系统检测抗HCV的最佳Cut-off值,以提高ELISA检测抗HCV的敏感性和特异性。
材料和方法
一、研究对象
使用盲法收集2013年3月至2013年5月新疆医科大学第一附属医院医学检验中心血清标本202份,分离血清,置-80℃保存待测。标本来源对象年龄1~82岁,男93例,女109例,其中132份来自肝病科门诊和住院患者、70份来自普通门诊患者和体检者。
二、仪器与试剂
addcare ELISA 1100全自动酶免分析系统(简称ddcare ELISA 1100,烟台生物科技有限公司);TECAN加样系统(瑞士帝肯公司);FAME后处理系统(瑞士哈美顿公司)。抗HCV确证试剂盒[重组免疫印迹法(recombinant immunoblot assay,RIBA)]由北京万泰生物药业股份有限公司提供(批号为RC20130101);抗HCV诊断试剂盒由(ELISA)北京万泰生物药业股份有限公司提供(批号为C20130406)。所有试剂均在有效期内使用,按说明书操作。
三、方法
1.标本检测 对-80℃保存待测的202份血清标本分别用上述指定厂家的抗HCV诊断试剂(ELISA)和抗HCV确证试剂(RIBA)进行抗HCV测定和抗HCV确认,记录吸光度(A)值,其中ELISA分别用addcare ELISA 1100和TECAN+FAME组合酶免分析系统(简称TECAN+FAME酶免系统)进行检测。检测前两种系统均进行了校准和性能验证。
2.RIBA确认结果判定 条带强度的判读和结果的解释见表1和表2。

表1 RIBA抗HCV反应条带强度的判读标准
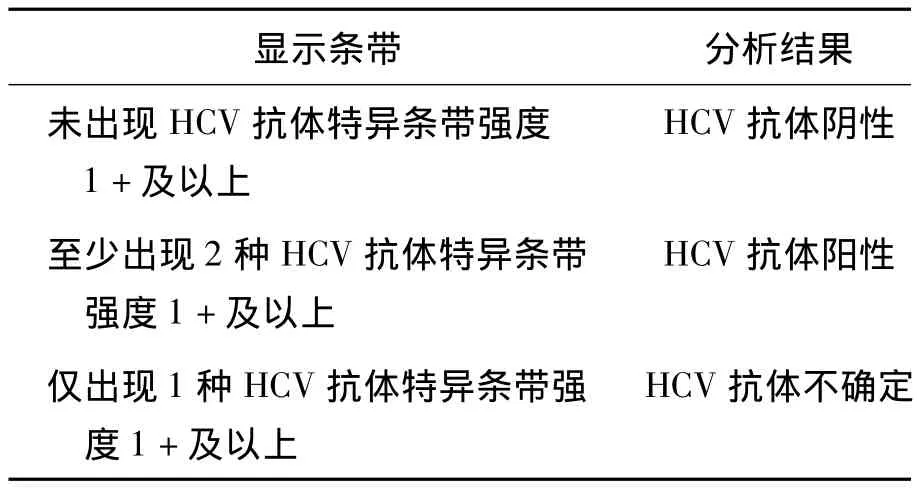
表2 RIBA抗HCV反应结果的判读标准
3.质量控制 ELISA检测每一批分别设定2个阴性对照、2个阳性对照和1个质控,其中阴性对照孔A值≤0.08,阳性对照孔A值≥0.50,否则实验无效,质控孔S/CO值在2.39~4.96的范围内。RIBA检测每一批分别设定1个阴性对照和1个阳性对照,其中阴性对照出现对照线-1和对照线-2,阳性对照出现 Core、NS3、NS4-1、NS4-2、NS5、对照线-1和对照线-2,且每条试验结果中对照线-1和对照线-2均必须出现,如果对照线-1和对照线-2均不出现或仅出现1条,则此条的检测结果无效。试验均有良好的质量控制。
4.Cut-off值的验证 EP12-A文件Cut-off值的验证方法:(1)准备具有临界值浓度和浓度在临界值±20%的标本,标本的量要充足,以保证同一份样本能重复测定20次;(2)重复测定每个标本20次,计算出每个标本的阴性和阳性百分比;(3)估计的临界值是否准确,如果准确,同一份样本重复测定的结果应该有50%阳性和50%阴性结果;(4)临界值±20%的浓度范围是否位于该实验方法的“95%区间”,当临界值+20%浓度的标本检测阳性率≥95%,且临界值-20%浓度的标本检测结果阴性率≥95%,则该浓度范围≥该方法95%区间;此时,标本浓度在临界值±20%浓度范围之外就能得到稳定的检测结果。
四、统计学方法
采用SPSS 17.0软件进行统计分析。用抗HCV A值做ROC曲线,计算曲线下面积,并探讨其最佳临界值即约登指数最大时的Cut-off值,且约登指数为敏感性与特异性之和减去1,从而确定抗HCV诊断价值最大时的Cut-off值。用配对四格表卡方检验探讨ROC曲线确定的两种不同酶免分析系统ELISA检测抗HCV最佳Cut-off值下的检测结果的差异。P<0.05为差异有统计学意义。
结 果
一、RIBA确认检测结果
RIBA检测结果为阳性142份,阴性60份。其中142份RIBA阳性标本5个抗原区条带强度分布情况见表3。142份RIBA阳性标本中,Core蛋白、NS3蛋白、NS4-1蛋白、NS4-2蛋白和NS5蛋白阳性的分别有142份、141份、80份、16份和68份,其中强度为2+的分别有125份(88%)、121份(85%)、61份(43%)、9份(6%)和 56份(39%),强度为1+的分别有17份(12%)、20份(14%)、19份(13%)、7份(5%)和12份(8%)。
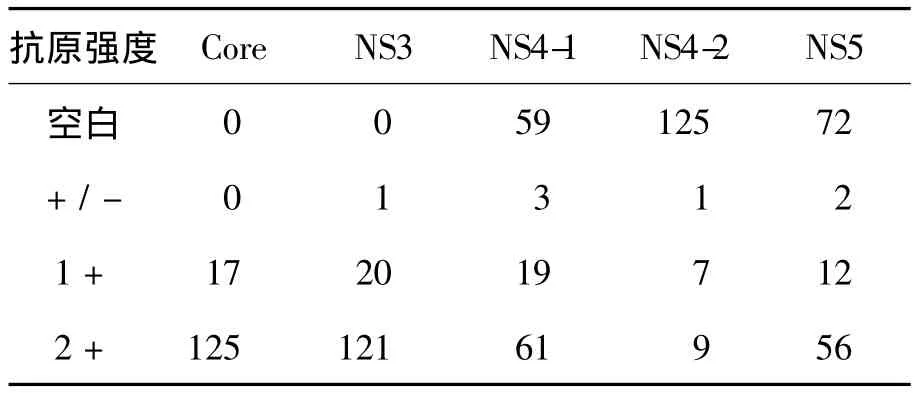
表3 142份RIBA阳性标本5个抗原区条带强度分布情况
二、ROC曲线分析结果
以RIBA检测结果为参照,绘制两种酶免分析系统不同阳性判断值的ROC曲线。addcare ELISA 1100检测抗 HCV的最佳 Cut-off值为0.448,敏感性为 99.3%,特异性为 96.7%,约登指数为0.960,ROC 曲线下面积为 0.998,见图 1。TECAN+FAME酶免系统检测抗HCV的最佳Cut-off值为 0.406,敏感性为 99.3%,特异性为96.7%,约登指数为 0.960,ROC 曲线下面积为0.998,见图2。两种系统不同临界值时的敏感性和特异性见表4和表5。对比两种系统采用ROC曲线确定的最佳Cut-off值下的抗HCV检测结果,差异无统计学意义(P=1.000)。见表6。
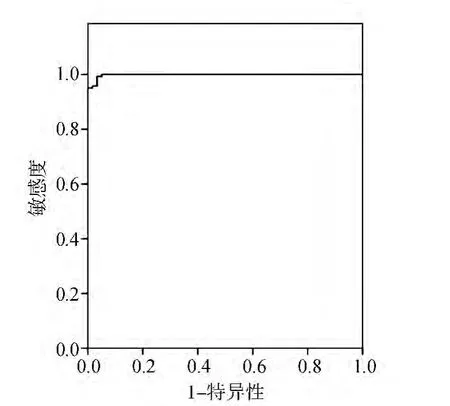
图1 addcare ELISA 1100检测抗HCV的ROC曲线图
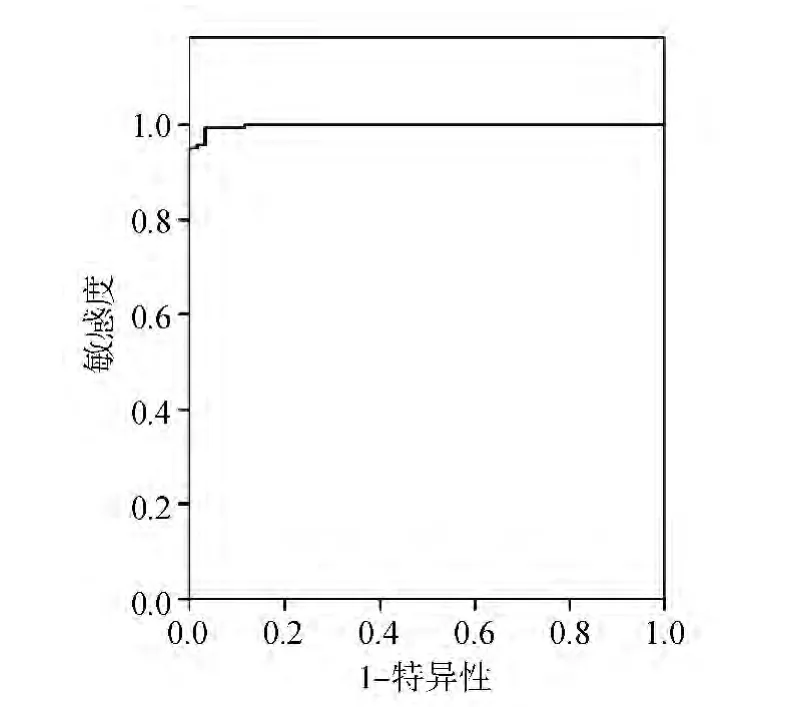
图2 TECAN+FAME酶免系统检测抗HCV的ROC曲线图
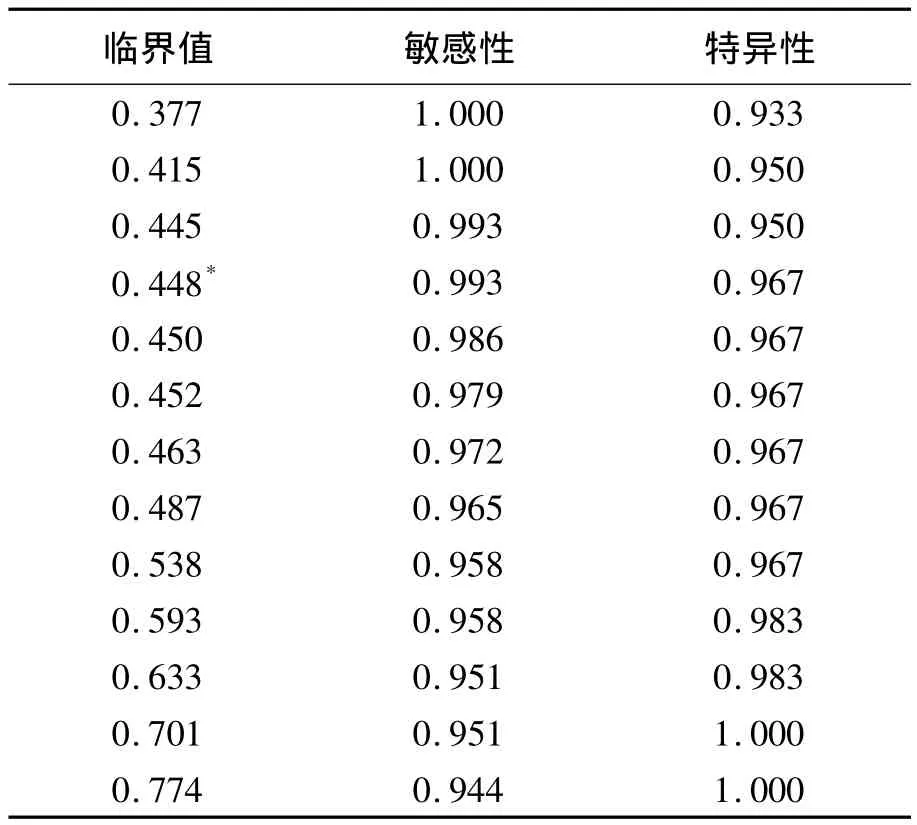
表4 addcare ELISA 1100不同临界值下的敏感性和特异性
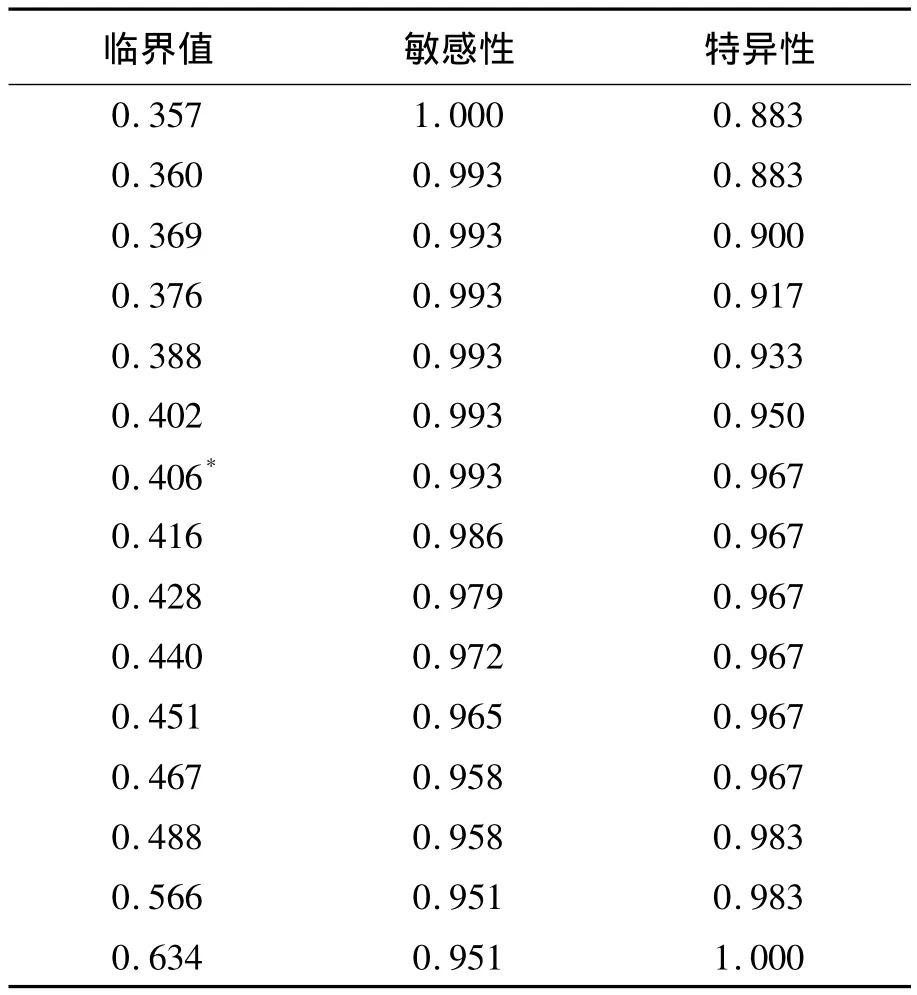
表5 TECAN+FAME酶免系统不同临界值下的敏感性和特异性
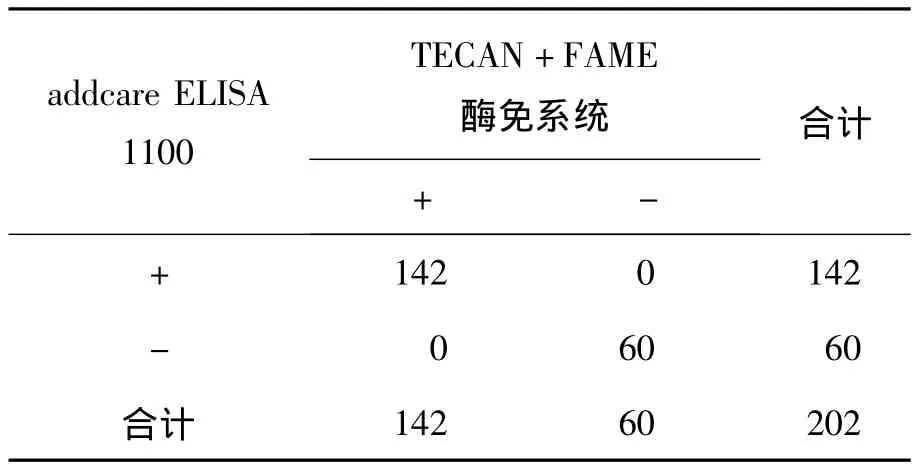
表6 两种系统检测抗HCV的最佳Cut-off值下的检测结果 (例)
三、Cut-off值的验证结果
addcare ELISA 1100检测抗HCV的最佳Cutoff值为0.448。一个 A值约为0.448的标本重复测定20次获得50%阳性结果和50%阴性结果。一个A值约为0.538(临界值+20%)的标本重复测定20次获得的阳性率为95%。一个A值约为0.358(临界值-20%)的标本重复测定20次获得的阴性率为100%。
TECAN+FAME酶免系统检测抗HCV的最佳Cut-off值为0.406。一个A值约为0.406的标本重复测定20次获得50%阳性结果和50%阴性结果。一个A值约为0.487(临界值+20%)的标本重复测定20次获得的阳性率为95%。一个A值约为0.325(临界值-20%)的标本重复测定20次获得的阴性率为100%。
讨 论
ELISA是目前临床检验中应用较为广泛的一种检测方法,其判断测定结果的依据主要依靠所谓的“阳性判断值”,即Cut-off值。虽然各厂家生产的ELISA试剂盒均提供Cut-off值的计算方法,但不同批试剂盒使用相同Cut-off值。多年使用同一Cut-off值的现象普遍存在,这显然存在不合理性。由于试剂盒生产工艺的不均一性,各批试剂盒的反应效果不尽相同,所得的Cut-off值应当不同。此外,环境温度、加样体积误差、洗板效果等方面均是影响ELISA检测性能的因素。为此,各实验室需自行设定并计算适合本实验室的Cutoff值[5]。
本研究中的两种系统(addcare ELISA 1100和TECAN+FAME酶免系统)虽然使用同一种抗HCV诊断试剂盒,但是addcare ELISA 1100是加样、后处理一体机,有2个工作舱(前、后舱自动转板,避免污染)和3台独立洗板机(前后舱均可使用,每台洗板机均为96针洗板头,洗板强度大、效果好),开放操作(易受环境温度干扰);TECAN+FAME酶免系统是TECAN加样系统和FAME后处理系统组合的酶免分析系统,人为转板,易污染,2台洗板机(每台洗板机均为24针洗板头,洗板效果较差),后处理机内部操作(受环境温度干扰小)。针对以上不同点,本实验室有必要分别确定两种系统ELISA各自的检测抗HCV的Cutoff值。
Cut-off值的设定方法一般有标准差比率、测定标本对阴性比值、以阴性对照均值±2s或3s、百分位数法、双质控、ROC曲线等[4]。不同的方法设定的Cut-off值有一定的差异,但都要综合考虑假阳性率和假阴性率。在各种Cut-off值的计算方法中,ROC曲线法已得到了实验室的认可[6]。该方法考虑了每一个可能的Cut-off值,因而能够更客观地评价诊断试验的诊断价值和确定最佳临界值。
本研究通过ROC曲线确定addcare ELISA 1100检测抗HCV的最佳Cut-off值为0.448,敏感性为 99.3%,特异性为 96.7%,约登指数为0.960,ROC 曲线下面积为0.998;TECAN+FAME酶免系统检测抗HCV的最佳Cut-off值为0.406,敏感性为99.3%,特异性为96.7%,约登指数为0.960,ROC 曲线下面积为0.998。
伍建宁等[7]研究通过对5 709份无偿献血者标本的抗HCV ELISA检测的A值的统计和RIBA检测,确认Cut-off值以0.112为宜,与本研究所确定的Cut-off值(0.448和0.406)相差较大。其原因可能有:(1)Cut-off值的设定方法不同,伍建宁等[7]的Cut-off值的设定方法为百分位数法单侧99%,本研究Cut-off值的设定方法为ROC曲线法;(2)仪器与试剂不同,伍建宁等[7]使用Genesis RSP-200型全自动标本处理系统加样,德国BEPⅢ全自动酶标仪进行后处理及检测,本研究分别使用 addcare ELISA 1100和 TECAN+FAME酶免系统检测,伍建宁等[7]研究抗 HCV ELISA测定试剂盒购自厦门新创生物工程公司,抗HCV RIBA 3.0SIA确认试剂盒购自美国Chiron公司,本研究抗HCV ELISA测定试剂盒和抗HCV RIBA确认试剂盒均购自同一家公司;(3)标本来源不同,伍建宁等[7]研究标本来自5 709份无偿献血者,本研究标本来自202份临床检测者。采供血系统血液筛检抗HCV,Cut-off值的设定应略低于临床抗HCV检测,这对于减少HCV的经输血传播具有重要意义[7]。
抗HCV诊断试剂盒说明书上提供的Cut-off值的计算公式为临界值=阴性对照孔A均值+0.12(不足0.02按0.02计算)。因此通常情况下所计算出的Cut-off值为0.140,与本研究所确定的Cut-off值(0.448和0.406)相差较大。若按照说明书上提供的Cut-off值判断阴性和阳性标本,虽然敏感性较高,但是特异性较低,即易出现假阳性。再者,由于ELISA方法学上的缺陷,抗HCV检测出现假阳性的原因有:(1)高球蛋白血症[4];(2)类风湿因子(RF)的干扰,如血清或血浆标本中存在RF,则其可与固相上的IgG和酶标记的IgG结合,从而出现假阳性反应;(3)标本中超氧化物歧化酶的干扰;(4)用于固相包被的HCV基因工程抗原不纯[8];(5)试剂保存、运输等环节的影响[9]。因此会增加临床抗HCV检测的误诊率。若按照本研究确定的Cut-off值判断阴性和阳性标本,虽然敏感性降低,但是特异性升高,即易出现假阴性。抗HCV检测出现假阴性的原因有:(1)HCV感染后到抗体的出现有一个较长的窗口期(平均为6~12周)[10];(2)HCV 感染的其它阶段。因此会提高临床抗 HCV检测的漏诊率。ELISA技术本身在Cut-off值的设置上存在局限性,也就是说在Cut-off值周围一定区域内,测定结果难以明确判断是阴性还是阳性,即所谓的灰区,而这个灰区到底有多大,在国内使用的ELISA试剂盒中均无说明。这种一刀切的判断方式所得到的结果存在假阴性的可能[7]。
综上所述,虽然从理论上而言,ROC曲线是设定Cut-off值的最佳方法,但是由于ELISA测定通常有较大的变异,其每次测定的Cut-off值都会有所差异,因此需要控制Cut-off值的批间变异,但在实际应用中有一定的局限性[3]。因此,综合抗HCV诊断试剂盒说明书上提供的Cut-off值(0.140)和经ROC曲线确定的两种系统的Cut-off值(0.448和 0.406)的诊断性能,将本实验室addcare ELISA 1100和TECAN+FAME酶免系统检测抗HCV的“灰区”分别设定为0.140~0.448和0.140~0.406。对于ELISA检测抗HCV中的“灰区”结果,最好采用较为敏感和特异的方法进行复检,以免误诊和漏诊。有条件的实验室可以用确认试验对结果进行确认。
[1]王晓艳,伊 瑶,陈斯勇,等.丙型肝炎病毒的病毒学检测方法[J].中华实验和临床病毒学杂志,2011,25(2):158-161.
[2]马文昭.丙型肝炎病毒抗体的检测及临床意义[J].中国现代医生,2008,46(13):159.
[3]康 炜,辛 娜,尤 涛,等.ROC曲线对ELISA法检测HBsAg阳性判断值的确定及应用评价[J].现代检验医学杂志,2010,25(6):49-50.
[4]李金明.临床酶免疫测定技术[M].北京:人民军医出版社,2005:104.
[5]凌月明,杜丕波,黄 伟,等.应用ROC曲线分析确定乙肝表面抗原 cut-off值[J].实用医技杂志,2006,13(14):2461-2462.
[6]Gall D,Nielsen K.Comparison of some methods for determining cut off values for serological assays:a retrospective study using the fluorescence polarization assay[J].J Immunoassay Immunochem,2001,22(2):85-98.
[7]伍建宁,刘志泉.采供血系统ELISA筛检丙型肝炎病毒抗体阳性判断值的设定及意义[J].检验医学,2007,22(3):365-366.
[8]Wang TY,Kuo HT,Chen LC,et al.Use of polymerase chain reaction for early detection and management ofhepatitisC virusinfection after needlestick injury [J].Ann Clin Lab Sci,2002,32(2):137-141.
[9]傅立强,桑列勇,蒋国瑾.ELISA试剂检测抗HCV反应性结果分析[J].检验医学,2012,27(7):588-591.
[10]谢 立,黄德庄,时洪波,等.用酶联免疫夹心法测定肝炎患者血清丙型肝炎抗原[J].中华检验医学杂志,2005,28(11):1159-1162.
