238Pu溶液α吸收剂量率的测定
2013-12-28刘金平
刘金平,宋 鹏,陈 辉,何 辉,王 亮
中国原子能科学研究院 放射化学研究所,北京 102413
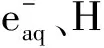
U、Np、Pu、Am等的α辐解工作均有人研究[3]。常用的α辐解源主要是210Po[4]、244Cm[5]和Pu[6]。Pu可以做成固体微球,其优点是溶液的放射性大大降低,便于样品分析;Pu也可以直接加入被辐照溶液中形成均相体系[6],其优点是更准确的反映辐解效应,反应速度也会提高。Ekberg等[7]采用了211At作为α辐解源,放置一段时间后,溶液中211At衰变完全,溶液中放射性极低,为辐解产物分析提供了方便。本工作拟采用238Pu作为辐解源,反应时间短,剂量率高。钚原料中238Pu的同位素丰度约80%,详细同位素丰度不知,有必要通过剂量率测定来纠正放射源的辐照剂量。
剂量率的测量主要有量热法、电离法和化学法。而适用于α辐解剂量测量的是化学测量法,主要有硫酸亚铁剂量计[8-9]、硫酸铈剂量计[10]和重铬酸盐剂量计[11]。其中硫酸亚铁(Fricke)剂量计使用广泛、精度高、稳定性好,已作为一种标准的剂量计使用。
本工作采用硫酸亚铁剂量计,研究空气饱和条件下,以238Pu作为α辐解源的溶液的吸收剂量率。
1 实验部分
1.1 仪器和试剂
Perkin Elemer UV-λ950分光光度计,美国PE公司;LS-6000LL液体闪烁谱仪,美国Beckman公司;IKA color squid磁力搅拌器,德国IKA广州仪科实验技术公司;石英比色皿,光程0.01 m,宜兴市晶科光学仪器有限公司。
强碱性吡啶型阴离子交换树脂、238Pu材料、超纯水(电阻率18.4 MΩ·cm),中国原子能科学研究院;浓硝酸,分析纯,北京市化学试剂公司;浓硫酸,分析纯,北京市化学试剂公司产品,经中国原子能科学研究院钴源辐照中心辐照;硫酸亚铁剂量计溶液,由中国原子能科学研究院钴源辐照中心配制;Fe2(SO4)3标准溶液,由中国原子能科学研究院钴源辐照中心配制(c(Fe3+)=2.522 3 mmol/L,0.4 mol/L H2SO4)。
1.2 原理
硫酸亚铁剂量计的组成为空气饱和的0.4 mol/L H2SO4、10-3mol/L FeSO4和10-3mol/L NaCl水溶液,经α射线辐照后,Fe2+可被水的辐解产物氧化成Fe3+,其化学反应式如下:

(1)

(2)

(3)
(4)
(5)

(6)
所以,
G(Fe3+)=2G(H2O2)+3G(H)+G(OH)
(7)
吸收剂量D可由下式计算:

(8)
式中:ΔA,已辐照和未辐照的剂量计的溶液吸光度之差(t2温度下测量);ε,Fe3+的摩尔线性吸光系数(t1温度下测量),m2/mol;G,Fe3+的辐射化学产额(α辐解中G(Fe3+)=5.1×10-7mol/J[9]);l,石英杯的光程长度,m;ρ,剂量计溶液的密度(25 ℃下为1.022×103kg/m3)。
1.3 实验方法
1.3.1238Pu纯化和钚浓度测定238Pu采用强碱性吡啶型阴离子交换树脂柱纯化。树脂装柱后,用1.0 mol/L硝酸洗柱,流出液用一定浓度的Ag+检测至无沉淀产生。柱子先用8 mol/L硝酸洗涤,酸化过夜。取5 mL Pu储备液与5 mL浓硝酸混合均匀(调酸度至7~8 mol/L)后,上柱,用2~3个柱体积8 mol/L硝酸洗涤柱子。然后用0.30 mol/L稀硝酸解吸,所得钚为238Pu(Ⅳ)。纯化后的238Pu溶液浓度用液闪谱仪测定。
1.3.2Fe3+摩尔线性吸光系数的测定[12]分别移取0.5、0.8、1.2、1.5、1.8、2.0 mL Fe2(SO4)3标准溶液于6个10 mL容量瓶中,用0.4 mol/L H2SO4溶液稀释至刻度,摇匀。以0.4 mol/L H2SO4溶液作为参比液,于波长303 nm处测Fe3+的吸光度值,进行线性拟合,斜率即为ε(Fe3+)。
1.3.3空气饱和条件下238Pu源的剂量率测量
(1) 于50 mL烧杯中加入20 mL Fe2+和35 μL238Pu(Ⅳ),磁力搅拌(保证空气饱和),反应15 min,使238Pu(Ⅳ)和Fe2+完全反应生成238Pu(Ⅲ)和Fe3+,取样利用分光光度法于303 nm波长处测Fe3+的浓度(以空气为参比)。后面生成的Fe3+均可认为是由α辐解引起的,每间隔15 min取样1次,测Fe3+的吸光度随时间的变化值,以吸光度对测量时间作图并进行线性拟合,根据曲线的斜率获得剂量率,温度为20 ℃。另取20 mL Fe2+溶液,不加入238Pu(Ⅳ),每隔15 min测Fe3+的吸光度变化,在105 min内吸光度从0.110 0变化到0.116 6,因此在本实验时间范围内空气中的氧气或者溶解氧对Fe2+的氧化影响可忽略。
(2) 其它条件不变,改变238Pu(Ⅳ)取样体积为50 μL和70 μL,测吸光度随时间变化值,并进一步获得剂量率。
2 实验结果
2.1 纯化后的238Pu浓度
纯化后的238Pu溶液经稀释后利用液闪谱仪进行测量,获得其质量浓度为25.96 g/L。
2.2 Fe3+摩尔线性吸光系数
Fe3+的摩尔线性吸光系数ε(Fe3+)示于图1。本实验在22 ℃下进行,计算可得ε(Fe3+)=ΔA/(bΔc)=212.03 m2/mol。
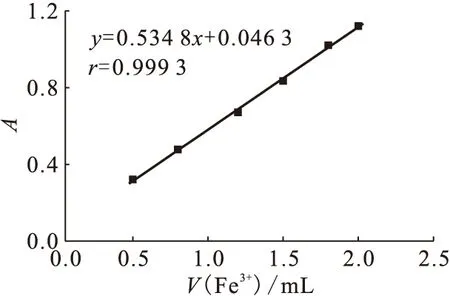
图1 Fe3+摩尔线性吸光系数ε(Fe3+)
2.3 不同238Pu浓度下溶液的吸收剂量率
考察了不同238Pu浓度下溶液的α吸收剂量率,实验均在20 ℃下完成,故:
D=9.06×102ΔA
实验结果示于图2。

ρ(238Pu),mg/L:(a)——45.43,(b)——64.9,(c)—— 90.86
(1) 35 μL238Pu加入到20 mL剂量剂中(剂量剂中钚质量浓度为45.43 mg/L,反应温度20 ℃),由图2(a)可知,ΔA/Δt=2.12×10-3/min,D/Δt=9.06×102×ΔA/Δt=1.92 Gy/min,单位浓度238Pu的剂量率为:
1.92 Gy/min÷45.43 mg/L=42.2 Gy·L/(g·min)
(2) 50 μL238Pu加入到20 mL剂量剂中(剂量剂中钚质量浓度为64.9 mg/L,反应温度20 ℃),由图2(b)可知,ΔA/Δt=3.1×10-3/min,D/Δt=9.06×102×ΔA/Δt=2.80 Gy/min,单位浓度238Pu的剂量率为:
2.80 Gy/min÷64.9 mg/L=43.1 Gy·L/(g·min)
(3) 70 μL238Pu加入到20 mL剂量剂中(剂量剂中钚质量浓度为90.86 mg/L,反应温度20 ℃),由图2(c)可知,ΔA/Δt=4.01×10-3/min,D/Δt=9.06×102×ΔA/Δt=3.64 Gy/min,单位浓度238Pu的剂量率为:
3.64 Gy/min÷90.86 mg/L=40.0 Gy·L/(g·min)
2.4 实验结果与计算值比较
2.4.1238Pu溶液α吸收剂量率的理论计算238Pu发生衰变,放出4种能量的α粒子(表1)。由表1计算可得α粒子的平均能量为5.487 MeV,238Pu的半衰期为87.750 a,可求得238Pu的比活度为6.179×1011Bq/g。则每克238Pu辐照能量为0.543 J/(s·g),和文献报道的238Pu的衰变热为0.54 W/g相吻合。溶液中的238Pu衰变辐射出α粒子,由于α粒子在溶液中穿透性极低,可认为所有α粒子的辐射能量被溶液吸收,即1 g/L的238Pu溶液每分钟吸收的能量为0.543 J/(s·g)×60 s/min=32.58 J/min(吸收剂量Gy定义为每千克溶液吸收1 J的能量,对于稀溶液,1 g Pu的1 g/L238Pu溶液的质量即为1 kg,即32.58 (Gy·L)/(g·min))。

表1 不同种类238Pu α粒子的比例及能量
2.4.2实验值和理论值的比较 本工作所求得单位浓度238Pu的剂量率为40.0~43.1 Gy·L/(g·min)(表2),与理论值偏差为23%~33%。误差出现的可能原因有:(1) 溶液的α辐解受实验器皿和实验环境影响较大;(2) 本工作中采用的剂量率的计算公式中G(Fe3+)值为一实验值;(3) 本工作的实验环境有少量的β核素存在,β核素的存在会导致剂量率的提高。
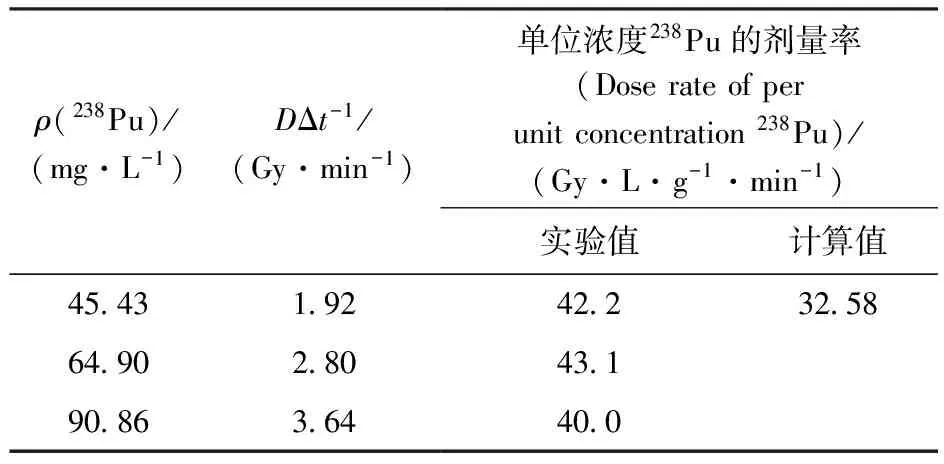
表2 实验值和理论值的比较
3 结 论
为了了解α粒子对无盐试剂的辐解效应,需要确定α辐解源的辐照剂量率。采用硫酸亚铁(Fricke)剂量计测定了238Pu为α源的溶液的α吸收剂量率,45.43、64.9、90.86 mg/L浓度下Fe3+吸光度随时间线性增加,由斜率求得单位浓度238Pu的剂量率为40.0~43.1 Gy·L/(g·min);按照238Pu α粒子的能量计算,质量浓度为1 g/L的238Pu溶液每分钟吸收的能量为32.58 J/min,即32.58 Gy·L/(g·min),计算值和理论值偏差为23%~33%,此与α辐解测定难度和实验环境有关。
[1] 姜圣阶,任凤仪,核燃料后处理工学[M].北京:原子能出版社,1995.
[2] 刘东元,吕恭序.辐射化学实验方法[M].北京:原子能出版社,1992.
[3] Pikaev A K,Shilov V P,Gogolev A V. Radiation Chemistry of Aqueous Solutions of Actinides[R]. Russian: Russian Academy of Sciences and Turpion Ltd.,1997.
[4] Savel’ev Yu I,Ershova Z V,Vladimirova M V,Alpha-Radiolysis of Aqueous Solutions of Ntric Acid[J]. Solviet Radiochem,1967,9: 221-225.
[5] Li C Y,Olander D R. Steam Radiolysis by Alpha-particle Irradiation[J]. Radiat Phys Chem,1999,54: 361-371.
[6] Pashalidis I,Kim J I,Lierse Ch,et al. The Chemistry of Pu in Concentrated Aqueous NaCl Solution: Effects of Alpha Self-Radialysis and the Interaction Between Hypochlorite and Dixoplutonium(Ⅵ)[J]. Radiochim Acta,1993,60: 99-101.
[7] Ekberg C,Aneheim E,Fermvik A,et al. Using211At as Internal Alpha Radiolysis Source Allowing for Simple Detection of Radiolysis Products[J]. Radiat Phys Chem,2010,79: 454-456.
[8] 中华人民共和国国家标准.GB 139—89 使用硫酸亚铁剂量计测定水中吸收剂量的标准方法[S].北京:中国标准出版社,1989.
[9] Trumbore C N,Hart E J. α-Radiation of Ferrous Sulfate in 0.4M Sulfuric Aacid Solutions[J]. J Phys Chem,1959,63: 867-873.
[10]国家计量技术规范.JJG-1017-90 使用硫酸铈-亚铈剂量计测量γ射线水吸收剂量的标准方法[S].北京:中国标准出版社,1990.
[11]国家计量技术规范.JJG-1018-90 使用重铬酸银剂量计测量γ射线水吸收剂量的标准方法[S].北京:中国标准出版社,1990.
[12]陈翠萍,程英.硫酸亚铁剂量计摩尔线性吸收系数的测定:CNIC-01878[R].北京:中国核科技报告,2006.
