伯乐树cpDNA-PCR反应体系的优化与引物筛选
2013-12-27胡尚力徐刚标刘雄盛肖玉菲郝博搏
胡尚力,徐刚标,梁 艳,刘雄盛,肖玉菲,郝博搏
(中南林业科技大学 生命科学与技术学院,湖南 长沙 410004)
伯乐树cpDNA-PCR反应体系的优化与引物筛选
胡尚力,徐刚标,梁 艳,刘雄盛,肖玉菲,郝博搏
(中南林业科技大学 生命科学与技术学院,湖南 长沙 410004)
伯乐树为国家一级保护植物,在研究被子植物的系统发育和古地理、古气候等方面具有重要的科学价值。cpDNA-PCR反应是在分子水平上确定伯乐树系统分类的基础。建立了伯乐树cpDNA-PCR反应体系,对影响扩增反应的因素(Mg2+浓度、dNTP浓度、引物浓度以及模板DNA浓度)进行了优化,得到了伯乐树cpDNAPCR扩增反应的最佳体系,并筛选出了适合伯乐树分子谱系地理研究的非编码区序列和引物。伯乐树cpDNAPCR最佳反应体系为:30 μL反应体系含有10×PCR buffer、2.9 mmol Mg2+、120 mmol dNTP、上下游引物各11 μmol、DNA模版30 ng以及3个单位的Taq酶。适合于伯乐树分子谱系地理学研究的3对引物及其退火温度为PipetB1411F-PipetD738R(52℃ )、psbA-trnHGUG(59℃ )、trnL-trnF(56℃ )。
伯乐树;cpDNA;PCR体系优化;引物筛选
伯乐树Bretschneidera sinensis Hemsl.为伯乐树科伯乐树属,因其花萼似钟状,故又名钟萼树,零散分布于浙江、台湾、福建、湖南、湖北、广东、广西和四川等省(区),是我国特有的单型科植物,已被列为国家一级保护植物[1],在研究被子植物的系统发育和古地理、古气候等方面具有重要的科学价值。
目前对于伯乐树遗传多样性[2-3]、生物学特征、生态学特性、系统发育、种群遗传及繁殖技术等方面已进行了大量的研究工作[4],但伯乐树系统地位仍存在争议[5]。叶绿研究(chloroplastc DNA,cpDNA)分子标记技术已广泛应用于植物系统分类、系统发育以及种群遗传结构等方面[6-8]。cpDNA分子标记的基础是PCR反应,受多种影响因素。PCR技术目前在诊断遗传病、克隆基因、植物育种等方面均有应用[9-13]。本研究通过优化伯乐树cpDNA-PCR反应体系,筛选出适合于系统分类研究的非编码区序列引物,为在分子水平上确定伯乐树系统分类地位奠定基础。
1 材料与方法
1.1 材 料
优化cpDNA-PCR体系的12株伯乐树标本于2012年7~10月采自广西猫儿山自然保护区。取其新鲜叶片用硅胶干燥后,带回实验室储存于-70℃冰箱中备用。
cpDNA非编码序列标记引物由南京金斯瑞生物科技有限公司提供(见表1),Taq DNA Ploymerase、dNTPs、Mg2+、10×Buffer、Marker DGL1500、Maker DGL2000购置于天根生化科技有限公司。
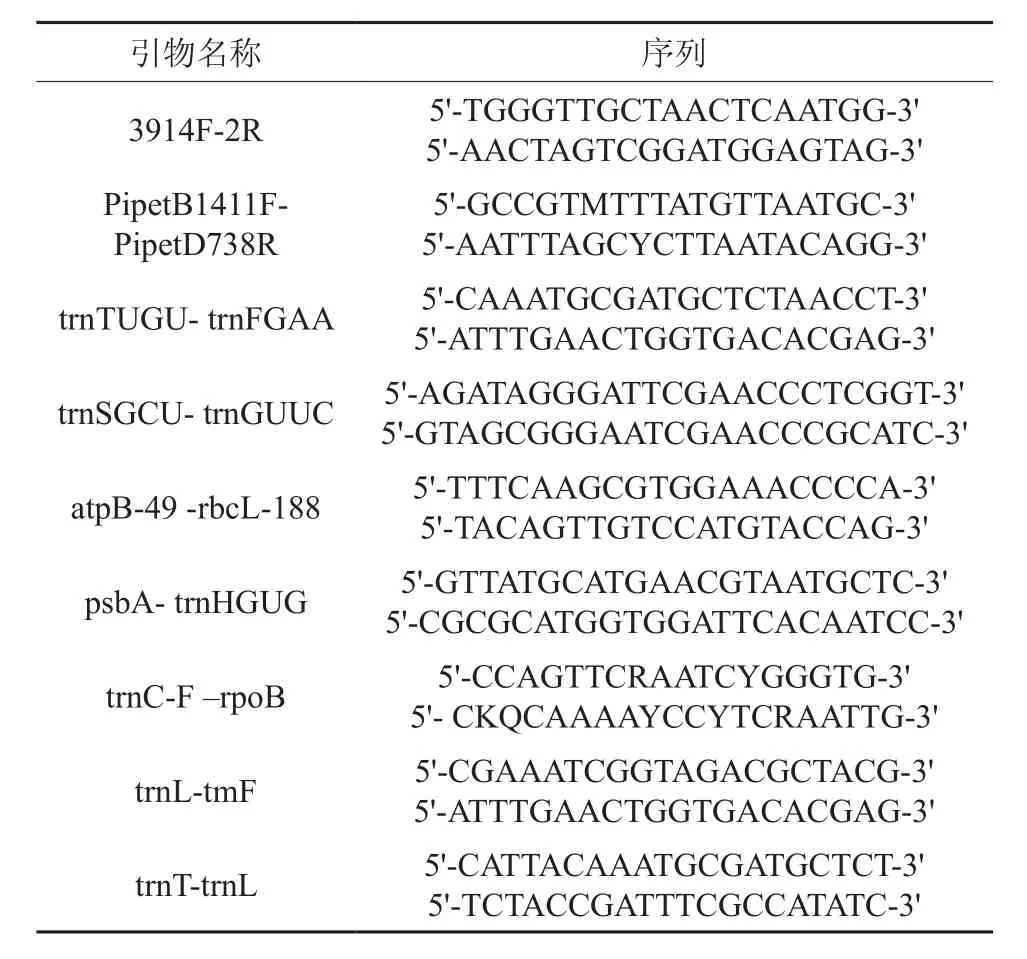
表1 实验所用引物序列Table 1 Primer sequences used in analysis
1.2 基因组DNA提取与检测
采用改良的CTAB法提取伯乐树总DNA,用0.8%琼脂糖凝胶对基因组DNA质量进行电泳检测,DNA浓度和纯度采用Eppendorf公司的Biophotometer核酸蛋白分析仪进行测定,并将DNA浓度稀释为20 ng/μL。
1.3 PCR反应及产物检测
[14],首先确定基本扩增反应体系 (30 μL) 为:3 μL 10×PCR buffer、2.5 mmol Mg2+、100 mmol dNTP、上下游引物各 10 μmol、DNA模版25 ng以及3个单位的Taq酶。
PCR反应程序为:94℃预变性 4 min,35个循环;95℃50 s,退火50 s,72℃5 min;最后以72℃延伸10 min。设计反应条件中的4种不同因素(Mg2+浓度、dNTP浓度、引物浓度以及模板DNA浓度)进行梯度实验。浓度梯度见表2。
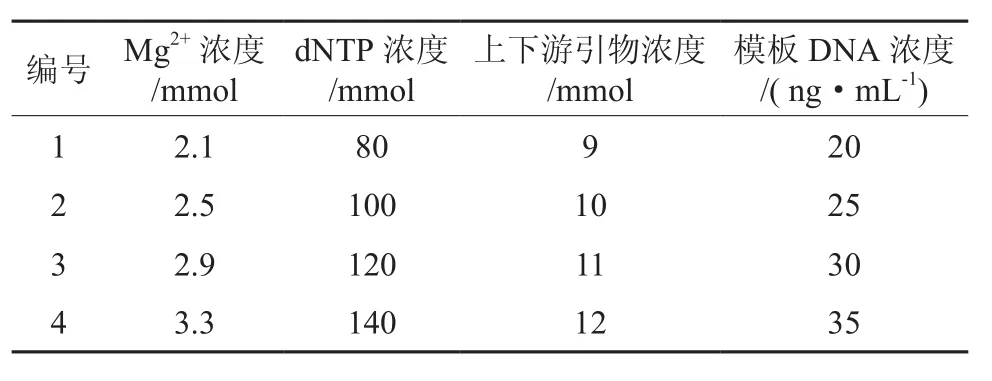
表2 cpDNA-PCR反应系统浓度设计Table 2 Concentration grads for cpDNA-PCR reaction system
扩增产物的检测:取2 μL 上样缓冲液与5 μL扩增产物混合后在浓度为1.6%的琼脂糖上进行电泳,电泳缓冲液为1×TAE,电压5 V/cm。在SYNGENE凝胶成像系统上记录结果。
1.4 引物筛选
对 rpl16、trnK、rps16、petD内 含 子,trnS-trnG、trnT-trnF、atpB-rbcL、psbA-psbH 、trnL-trnF、trnC–rpoB基因间隔区共9对引物进行筛选,得到适合cpDNA基因间隔区标记的引物。
2 结果与分析
2.1 伯乐树叶绿体基因组DNA的纯度与浓度
12株伯乐树标本提取的总DNA经核酸蛋白分析仪测定的纯度与浓度结果见表3。
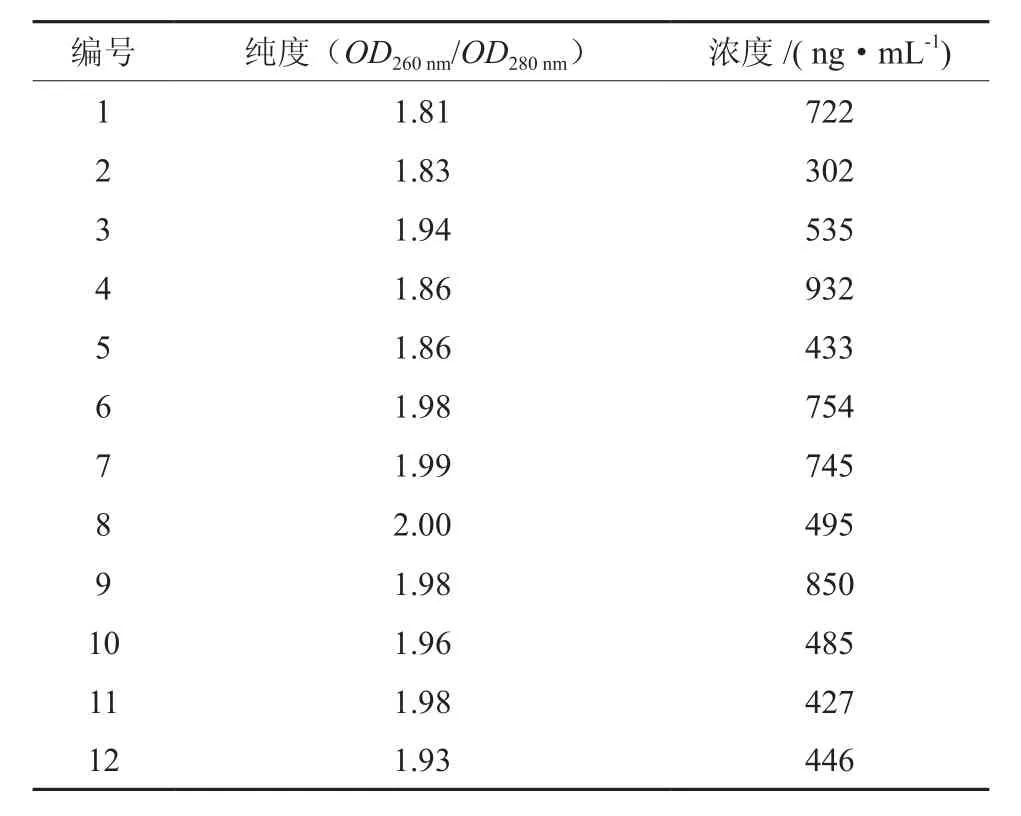
表3 伯乐树叶绿体基因组DNA的纯度与浓度Table 3 The concentration and purity of total DNA
OD260nm/OD280nm比值是衡量总DNA纯度的指标。若比值低于1.6,说明DNA中混有RNA杂质,若比值高于2.0则说明DNA中混有蛋白质杂质。由表3可知,比值在1.6~2.0之间,说明实验提取的总DNA含量较高,符合PCR反应所需的要求。
2.2 cpDNA非编码序列的PCR反应体系与反应程序
2.2.1 Mg2+浓度的确定
Mg2+是反应混合物中Taq酶的激活物,并且影响反应的效率[15]。4个Mg2+浓度梯度下扩增产物凝胶成像结果如图1所示。图1中Marker为D2000。
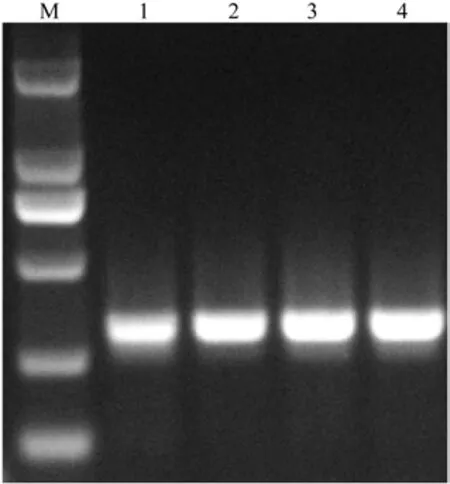
图1 不同Mg2+浓度下扩增产物凝胶电泳Fig.1 The gel electrophoresis image of different Mg2+concentrations
由图1可以看出,随着Mg2+浓度的升高,电泳条带由暗变亮,2.9 mmol时条带明亮且清晰。
2.2.2 dNTP浓度的确定
dNTP在生物DNA、RNA合成中以及PCR反应中起原料作用。在PCR反应中,dNTP的浓度会影响非靶位置启动和延伸时的核苷酸错误掺入[16]。本实验设置了4个梯度的dNTP浓度,扩增结果如图2所示。
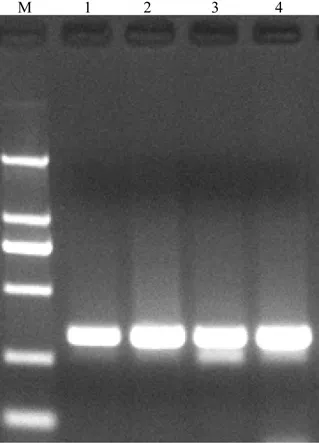
图2 不同dNTP浓度下扩增产物凝胶电泳Fig. 2 The gel electrophoresis image of different dNTP concentrations
由图2可见,dNTP浓度在80~140 mmol时电泳条带均很明亮,而浓度为120 mmol时条带最为清晰。
2.2.3 引物浓度的确定
引物的作用是帮助游离的碱基结合到DNA单链上去,在一定范围内,引物浓度越大DNA复制越快,超过一定浓度,即达到饱和状态,对PCR影响减弱。如果引物浓度过高,还会因为引物与体系中的镁离子结合而影响酶的活性,并产生大量引物二聚体[17]。本实验设置了4个梯度的引物浓度,扩增结果如图3所示。
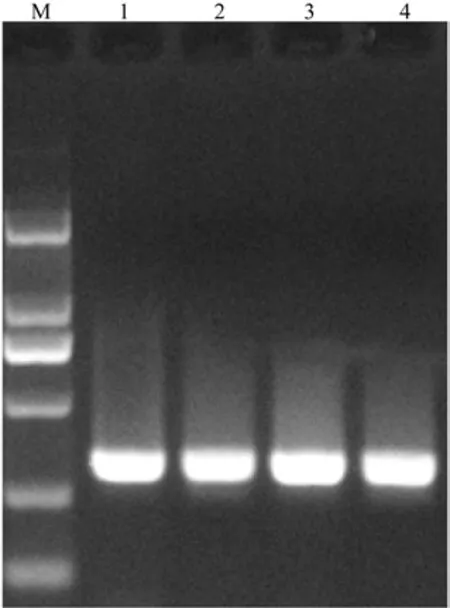
图3 不同引物浓度下扩增产物凝胶电泳Fig. 3 The gel electrophoresis image of different primers concentrations
从图3可以看出,当上下游引物浓度为10 mmol和12 mmol时,条带清晰但较暗;当浓度为9 mmol和11 mmol时条带清晰,但11 mmol浓度条带更为明亮。因此上下游引物最佳浓度为11 mmol。
2.2.4 DNA模版浓度的确定
DNA模版就是要扩增的DNA片段,同样在一定范围内,模版浓度越高DNA复制越快,但如果模版浓度过高会导致非特异性的扩增,并且在电泳检测时会导致条带弥散[18]。4种不同浓度的DNA模版扩增结果如图4所示。
从图4可知,当DNA模板为20 ng/μL时,条带较为暗;浓度达到25 ng/μL时,条带明显变亮。从扩增结果来看,DNA模板浓度在30 ng/μL时最好,条带最为清晰、明亮。
2.3 伯乐树cpDNA-PCR的最优反应体系
根据PCR各项反应因素优化结果,得到的伯乐树cpDNA-PCR最优反应体系(30 μL)为:10×PCR buffer、2.9 mmol Mg2+、120 mmol dNTP、上下游引物各11 μmol、DNA模版30 ng以及3个单位的Taq酶。
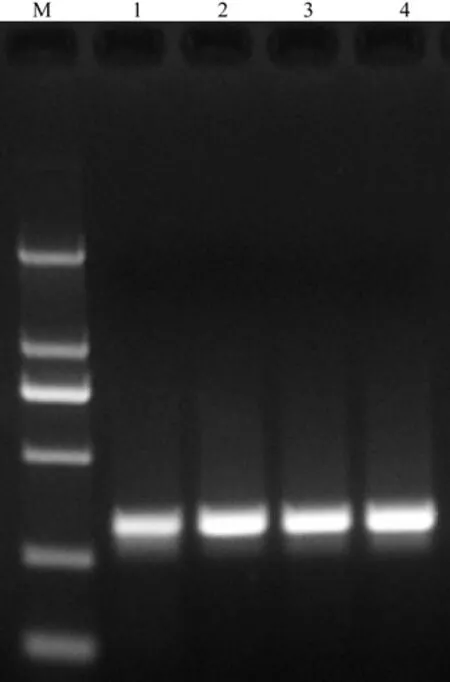
图4 不同DNA模版浓度下扩增产物凝胶Fig.4 The gel electrophoresis image of different template DNA concentrations
2.4 引物筛选
根据已优化的PCR反应体系和程序,对rpl16、trnK、petD 内 含 子,trnS-trnG、trnT-trnF、atpB-rbcL、psbA-psbH 、trnL-trnF、trnC–rpoB基因间隔区共9对引物进行筛选。实验中引物的退火温度与时间取决于引物的长度、碱基组成及其浓度,还有模版DNA的序列长度[19]。而引物的退火温度会对引物与模版的特异性结合产生影响,因此对于不同引物的退火温度需要进行单独且细致的筛选。本试验中先以Tm值计算得出的理论退火温度为标准,进行梯度为2℃的6个退火温度的试验,得到初步的最适温度。再以这个温度为标准,设置梯度为0.5℃的6个退火温度,最终确定该引物的最佳退火温度。最终获得电泳条带清晰、明亮、单一的引物共3对,结果见表4。

表4 筛选出的4对引物Table 4 The four pairs of selected primers
利用3对最佳引物获得的PCR产物经1.6%凝胶电泳检测,结果见图5、图6、图7。
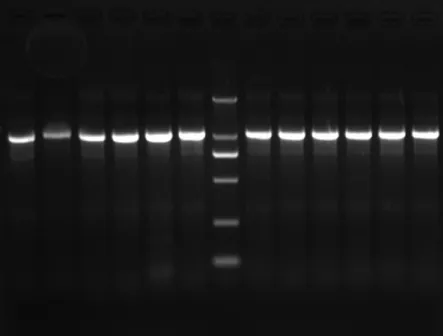
图5 petD内含子扩增产物凝胶电泳Fig.5 The gel electrophoresis image of petD intron amplif i cation result

图6 psbA-trnH基因间隔区扩增产物凝胶电泳Fig.6 The gel electrophoresis image of psbA-trnH intergenice spacer amplif i cation result

图7 trnL-trnF内含子扩增产物凝胶电泳Fig.7 The gel electrophoresis image of trnL-trnF intron amplif i cation result
3 结 论
cpDNA分子标记是基于PCR反应的技术,受到反应中多种因素的影响,所以应对各种因素进行优化以得到最佳的反应体系。对于实验结果的分析,是以凝胶电泳条带清晰程度、亮度以及单一性来判断的,具有一定主观性。因此应进行多次重复试验,去除主观因素的影响,得到稳定的结果。
实验得到伯乐树的最优cpDNA-PCR反应体系(30 μL) 为:10×PCR buffer、2.9 mmol Mg2+、120 mmol dNTP、上下游引物各11 μmol、DNA模版30 ng以及3个单位的Taq酶。通过优化后的体系筛选出适合于伯乐树分子谱系地理学研究的3对引物及其退火温度为:PipetB1411F-PipetD738R(52℃)、psbA-trnHGUG(59 ℃)、trnL-trnF(56 ℃)。
参考文献:
[1] 于永福. 国家重点保护野生植物名录:第一批[J].植物杂志,1999,(5):4-11.
[2] 梁 艳, 徐刚标, 张合平, 等. 南岭地区伯乐树自然和人工迁地保护种群的遗传多样性[J]. 林业科学, 2012, 48(12):45-52.
[3] 彭莎莎, 黄华宏, 童再康. 濒危植物伯乐树遗传多样性的初步研究[J]. 植物遗传资源学报, 2011, 3(12):362-367.
[4] 乔 琦, 邢福武. 中国特有珍稀植物伯乐树的研究进展和科研方向[J]. 中国野生植物资源, 2011, 30(5):4-8.
[5] 刘成运. 伯乐树科及其近缘科的花粉形态研究[J]. 云南植物研究,1986,8(4):441-450.
[6] Guo W, Yu Y. A phylogeny of Photinia sensu lato (Rosaceae)and related genera based on nrITS and cpDNA analysis[J]. Plant Syst. Evol., 2011(291):91-102.
[7] Bruneau A, Starr J R. Phylogenetic relationship in the genus Rosa: new evidence from chloroplast DNA sequences and an appraisal of current knowledge[J]. Systematic botany, 2007,2(32):366-378.
[8] Bruyns P V, Mapaya R J. A new subgeneric classification for Euphorbiaceae (Euphorbiaceae) in southern Africa based on ITS and psbA-trnH data [J]. Taxon, 2006(55):397-420.
[9] 李昌珠,李培旺,张良波,等.光皮树无性系ISSR-PCR反应体系的建立[J].经济林研究,2009,27(2):6-9.
[10] 王弦云,朱晓敏,王 勤,等.杜仲ISSR-PCR反应体系的建立与引物筛选及其在遗传多样性研究中的应用[J].经济林研究,2013,31(1):31-34.
[11] 罗淑萍,曾 斌,孙晋科,等.野扁桃ISSR-PCR反应体系的优化[J].经济林研究,2007,25(3):1-5.
[12] 邵俊培,李志辉,杨模华,等.马尾松ISSR-PCR体系的优化[J].中南林业科技大学学报,2012,32(4):159-163.
[13] 祝全东,张党权,李晓云,等.油茶SRAP标记的PCR体系建立与优化[J].中南林业科技大学学报,2010,30(3):57-62.
[14] 王美娜, 乔 琦. 广东南昆山与大岭山孑遗植物伯乐树群落特征比较与谱系地理学研究[J]. 广西植物, 2011,6(31):789-794.
[15] 赵素芬, 张 婷. 长心卡帕藻RAPD-PCR反应体系的正交优化研究[J]. 生物技术通报,2008(4):161-165.
[16] 倪 穗, 田 敏. 红山茶总DNA提取及ITS-PCR扩增条件优化研究[J]. 浙江林业科技,2007,27(2):16-19.
[17] 郭大龙, 罗正荣. 部分柿属植物SRAP-PCR反应体系的优化[J]. 果树学报,2006,23(1):138-141.
[18] 吴雪琴, 徐刚标, 梁 艳. 观光木ISSR-PCR 反应体系的建立及优化[J]. 中南林业科技大学学报, 2012, 32(7):76-79.
[19] 张玉梅,徐刚标,谷振军,等. 珙桐cpDNA非编码序列引物反应条件优化与筛选[J]. 中南林业科技大学学报, 2011,31(3): 183-186.
Optimization of cpDNA-PCR system for Bretschneidera sinensi and primers screening
HU Shang-li, XU Gang-biao, LIANG Yan, LIU Xiong-sheng, XIAO Yu-fei, HAO Bo-bo
(School of Life Science and Technology, Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
Bretschneidera sinensis is a kind of national first-grade protected plants and has important scientific value in studying angiosperm’s phylogeny, paleogeography and paleoclimate. The cpDNA-PCR reaction is the basis of determinting the phylogenetic classif i cation of B. sinensis at the molecular level. The concentrations of Mg2+, dNTPs, primers and template DNA affecting the cpDNAPCR that will affect the amplif i ed reaction were optimized to establish the cpDNA-PCR for B.sinensis, and the suitable non-coding sequences and primers for B. sinensis on molecular phylogeography were screened. The optimum 30 μL reaction system contained 10×PCR buffer, 2.9 mmol Mg2+, 120 mmol dNTPs, 11 μmol primers, 30 ng template DNA and 3 units Taq polymerase. The 3 pairs of primers that are appropriate for the geographical study of molecular genealogy of B. sinensis and their corresponding annealing temperatures were screened out as followings: PipetB1411F-PipetD738R (52℃ ), psbA-trnHGUG (59℃ ), trnL-trnF (56℃ ).
Bretschneidera sinensis Hemsl.; cpDNA; optimization of PCR system; primers screening
S794.9;Q78
A
1673-923X(2013)07-0067-05
2012-12-16
林业公益性行业科研专项经费项目(201104033);湖南省研究生科研创新项目(CX2012B326)
胡尚力(1989-),男,湖南湘潭人,硕士研究生,主要从事生物化学与分子遗传学研究
徐刚标(1965-),男,安徽枞阳人,教授,博士,博士生导师,主要从事植物种群遗传与育种研究
[本文编校:谢荣秀]
