干热河谷台湾相思树种根瘤菌的耐干热研究
2013-12-27沙桦欣伍建榕周利平张东华马焕成
沙桦欣,伍建榕,周利平,王 芳 ,张东华,马焕成
(1.西南林业大学林学院 云南省高校森林灾害预警控制重点实验室,云南 昆明 650224;2.国家林业局 西南地区生物多样性保育重点实验室,云南 昆明 650224)
干热河谷台湾相思树种根瘤菌的耐干热研究
沙桦欣1,伍建榕1,周利平2,王 芳2,张东华1,马焕成2
(1.西南林业大学林学院 云南省高校森林灾害预警控制重点实验室,云南 昆明 650224;2.国家林业局 西南地区生物多样性保育重点实验室,云南 昆明 650224)
通过对干热河谷地区台湾相思树种根瘤菌进行高温干旱等抗性研究,揭示干热河谷地区台湾相思树种根瘤菌在高温条件下生长规律,为发掘优良的根瘤菌种质资源提供理论依据。通过野外调查、采集、分离纯化采自干热河谷地区台湾相思树种的根瘤菌;经与相思树种无菌苗共生接瘤培养,将筛选出的各根瘤菌菌株接种到YMA培养基中,于不同温度下恒温培养,记录菌落数和菌落横纵径;用聚乙二醇6 000(PEG 6 000)人工模拟干旱条件在最终浓度(w/v)分别为0,5%,10%,20%,30%等5个水平的PEG培养液中接种菌株培养,用分光光度计测定该菌悬液的OD600值并绘出相应的曲线。实验结果表明高温能明显抑制根瘤菌菌落生长。YMAPEG溶液的OD值随浓度的增大而减小,菌株M-08、M-10、M-11属于高温干旱适应较强类型,菌株CK、M-05、M-06、M-07、M-09、M-12、M-15属于高温干旱适应中等类型,菌株M-01、M-02、M-03、M-04、M-13、M-14,属于高温干旱适应较弱类型。
台湾相思;根瘤菌;抗干热;干热河谷
与黄土高原一样,干热河谷是我国特有的生态环境最脆弱的地区之一,也是我国生态建设的重点和难点。中国干热河谷面积约3.2万km2[1-2],主要分布在云南省、台湾省西北部、海南省西南部、四川省西南部的金沙江河谷地带,其中西南干热河谷是我国西南横断山脉地区具有特殊地理环境和自然气候的区域,分布最广,面积最大。由于受地理位置、地形深切、大气环流以及焚风效应的影响,具有土壤瘠薄、植被稀疏、热量充足、干湿季分明、水土流失严重等特点,是我国典型的生态脆弱带和特殊环境生态系统类型之一[3]。台湾相思Acacia richii是多年生的豆科Leguminosae木本植物,生长快,耐瘠薄,有根瘤,具有固氮作用,可改良土壤,且木材用途广等特性,是荒山荒地造林的先锋树种,已逐渐成为西部干热河谷地区的主要造林树种[4-5]。干热河谷地带由于其干旱、高温、土壤等立地条件的限制,决定了在该地区造林工作的特殊性和艰巨性。该研究对干热河谷台湾相思根瘤菌的耐高温干旱等抗逆性进行初步分析,为优良菌株的选育提供种质资源,同时为今后进行多样性和系统发育研究奠定基础。
1 材料与方法
1.1 根瘤的采集与保存
选取干热河谷地区台湾相思树种的适当生育期,用小铲挖去根部土,用剪刀从植物的根部(主根或侧根)上剪下生长着的根瘤,用纯净水将泥土洗净后放入装有50%的甘油液的20 mL离心管中,封口,按采集时间对根瘤编号。采集时注意根瘤的完整性,带回实验室后放入4℃冰箱里以备分离时使用[6-7]。
1.2 根瘤菌的分离,纯化保存及初步鉴定
本试验采用常用酵母汁甘露醇琼脂培养基来培养根瘤菌。固体培养根瘤菌时采用酵母汁甘露醇琼脂培养基(YMA培养基)[8],而液体培养根瘤菌时则采用不加琼脂的酵母汁甘露醇液体培养基(YMB)。将分离纯化得到的菌株保存到YMA斜面培养基上,置于4 ℃冰箱保存备用。
对选取的菌落进行革兰氏染色[9]:革兰氏阳性的细菌染成深紫色,革兰氏阴性的细菌染成浅红色,色泽鲜明。
1.3 根瘤菌菌株温度试验
以甘露醇酵母汁培养基(YMA)为基本培养基,将各根瘤菌菌株接种到YMA培养基中,于不同温度下恒温培养。每皿培养基上接种6个菌落,温度设为28℃、37℃ 2个温度级,每个菌株设3个重复。第2,4,6,8,10 d观察菌落生长的情况,记录菌落数和菌落横纵径。
1.4 根瘤菌菌株高温干旱试验
用聚乙二醇6 000(PEG 6 000)人工模拟干旱条件[10-11]。在甘露醇酵母汁(YMB)的液体培养基中加入不同量的PEG,使培养液的终浓度(w/v)分别为0,5%,10%,20%,30%等5个水平,每个水平设4个重复。在37℃时,各水平的渗透势分别为 0 bar,-0.342,-1.137 bar,-4.066 bar,-8.767 bar。取活化的菌株2环接种到各个不同PEG水平的YMB液体培养基(50 mL采样管)中,每试管内装有20 mL的培养液,于37℃下进行振荡培养,振荡频率为180 r/min,分别培养12 h、48 h。取一管菌悬液,用722分光光度计测定该菌悬液的OD600值[12-13]。测定前用蒸馏水对仪器进行调零,并用相应浓度PEG的YMB培养液作为对照(CK)。
2 结果与分析
2.1 根瘤菌的分离、纯化和鉴定
从采集的根瘤中分离所得的微生物纯菌落,经革兰氏染色反应后呈红色,表明此微生物菌落是阴性细菌[14];根瘤菌微生物的形态特征一般为短杆状,两端钝圆,或分叉状,为典型的类菌体形态;回接台湾相思树种可以结瘤的微生物。
本次试验分离、纯化并鉴定以及在台湾相思树种上进行回接接瘤试验,筛选出15株成功接瘤的根瘤菌菌株,其编号分别为M-01、M-02、M-03、M-04、M-05、M-06、M-07、M-08、M-09、M-10、M-11、M-12、M-13、M-14、M-15。
2.2 根瘤菌菌株温度试验
2.2.1 在28、37℃下菌株菌落数统计分析
由表1可以看出,各根瘤菌菌株经28℃、37℃ 2个温度梯度的处理可以发现,除M-03外,其他供试菌株均能在这2个温度下存活。高温处理能起到筛选活性菌株的作用,也能起到激发菌株利用不同机制来适应高温。
2.2.2 在28、37℃下菌株菌落面积统计分析
在试验温度下,各菌株取每皿接种的3个菌落进行定期测量,采用近似椭圆的方式看待,测量该菌落的横纵径,应用椭圆面积公式进行计算。
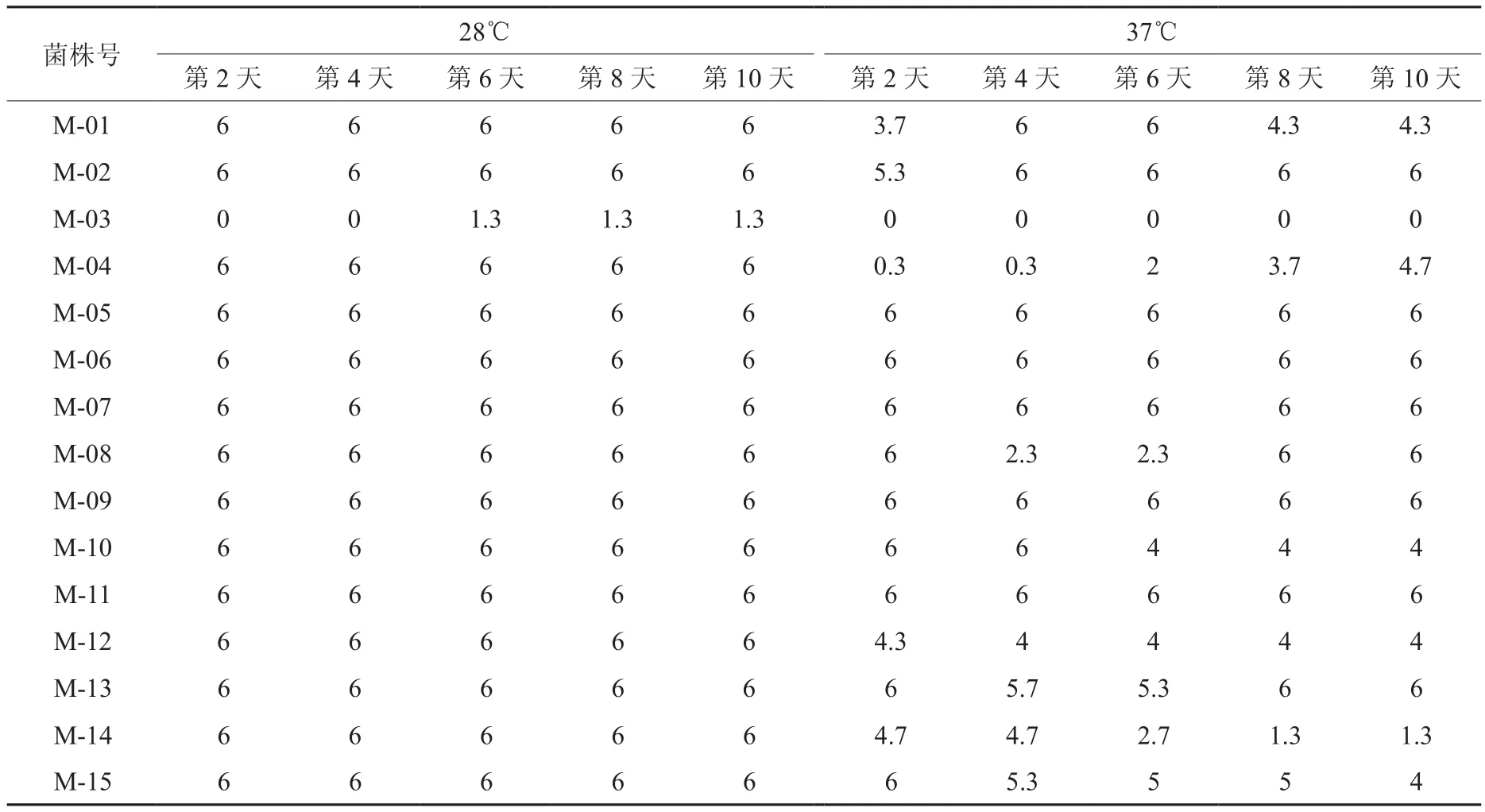
表1 28℃和37℃下菌株菌落数统计结果Table 1 Statistical results of colony numbers under 28℃ and 37℃
试验温度为28℃时,在6~8 d之间,各菌株增长速率都最大,尤其是M-04菌株。从菌落面积变化趋势的角度分析(如图 1-A)可得,M-04、M-05菌株在第6~8 d的面积迅速增长; M-11、M-12菌株在第2~4 d、第6~8 d面积增长率明显高于第4~6 d、第8~10 d;M-02、M-07、M-15菌株变化趋势基本一致;M-06、M-08、M-09、M-14菌株变化趋势也
基本一致。试验温度为37℃下,从菌落面积变化趋势的角度分析(如图1-B)可得,在第6~8 d M-04、M-05、M-07菌株面积明显增大,M-05、M-07两菌株几乎重合;M-01、M-04两菌株面积增长趋势近乎平行,和M-13一样整个试验时间内保持直线式的增长;M-02、M-08、M-09、M-11、M-12、M-14、M-15等菌株从试验开始到试验结束面积变化波动不大;M-10在第4~8 d面积急速减小。
对28℃、37℃两个温度梯度处理下的各菌株菌落面积进行比较可知,高温明显抑制菌落生长,不同温度处理下有些菌株的生长方式也发生改变。M-04、M-05、M-07、M-13菌株总是保持良好的生长势头,M-02、M-08、M-09、M-14、M-15等菌株随着温度的升高其仍会保持平缓的生长,而M-10、M-11、M-12菌株的生长优势会逐渐降低,甚至消失,菌株在设置的温度梯度范围内几乎不生长,究其原因可能是由于其在YMA培养基上生长不良所致。

图1 28℃和37℃下各菌株菌落面积Fig. 1 Areas of colonies under 28℃ and 37℃
2.3 根瘤菌高温干旱试验
对不同PEG浓度处理下的根瘤菌菌液在12 h和48 h的OD值进行差异显著性检验,其结果如表2所示。

表2 不同PEG浓度处理下菌液OD值差异显著性检验结果Table 2 ANOVA of OD values of rhizobium suspension under different PEG concentrations
从分析结果可以看出,PEG 0处理下12 h根瘤菌菌液OD值达到显著差异(0.01<p≤0.05),其他不同PEG浓度处理下对根瘤菌菌液OD值的影响均达到极显著水平(p<0.01)。从F值的比较来看,PEG 0处理下12 h、48 h菌液的OD值分别是1.947、2.419,是所有F值中最小的,表明其差异性最小。并且与PEG 10%处理下12 h、48 h菌液的OD值(5.982、6.403)相似,其间的差值都很小,均为12 h小于48 h,说明在这2个不同PEG浓度处理下12 h、48 h菌液间差异性略增大。PEG 5%、20%、30% 3个浓度梯度处理下的菌液OD值均为12h培养的大于48 h,且相差也很大,分别为10.54、7.455、15.888,说明在这3个不同PEG浓度处理下菌液的OD值差异性降低幅度大,可能是因为菌液经过48 h培养基本处于稳定状态。
从不同PEG浓度梯度逐渐增大的角度分析根瘤菌菌液OD值,其各菌株12 h、48 h的次序排列的顺序如表3。从中可以发现,在高温条件下不同的根瘤菌菌株随着干旱程度的加剧其生长也会表现出不同的适应表现。

表3 不同PEG浓度处理下菌株12 h、48 h菌液OD值从小到大排序Table 3 Sequencing of Rhizobium suspension’s OD values treated under different PEG concentrations at 12 and 48 hours
M-08菌株在PEG 0处理下排在次序的中间位置,生长一般,随着PEG浓度的增大,一直处于次序靠前位置,生长良好,说明适度的干旱能促进M-08菌株忍耐高温干旱条件;M-10菌株在0~20%浓度下排在次序靠前的位置,生长良好,但30%浓度下排在中间位置,生长减弱,说明M-10菌株能适应一定的高温干旱条件,但干旱过高时就抑制了其生长;M-01菌株随着PEG浓度的增大,在大小排列次序中的位置在逐渐上升,说明该菌株能随着干旱程度的加重,适应的提高相应的忍耐能力;M-06菌株在PEG 0浓度处理下排在次序靠前的位置,生长良好,而当PEG浓度为5%时期排在次序靠后的位置,生长减弱,而后随着PEG浓度的增大也能保持在前中的位置上,说明其在干旱条件下适应性还是比较强的;M-09菌株在PEG 0、5%、10%浓度下次序靠中后的位置,且比较平稳,说明其生长稳定,后随着PEG浓度的升高,次序位置也随着上升,说明当干旱条件达到一定程度后,M-09菌株的耐干旱的能力会被激发而提高;M-15菌株随着PEG浓度的增大,其排列次序基本都处于中间的位置,说明其生长随着干旱情况的加重也能保持基本平稳状态,但总体生长情况较弱;M-03菌株在PEG 5%时次序靠前,生长良好,但随着PEG浓度的增大,其次序位置越来靠下,生长减弱。
进一步可以说明,M-08菌株经一定的干旱刺激最能耐高温干旱条件,M-10菌株能适应高温,忍耐一定的干旱条件,但当干旱达到一定程度(渗透势为-8.767 bar)时生长会受到抑制。M-06菌株能在高温高干旱条件下表现出一定的适应能力;M-09菌株在干旱条件达到一定的程度(渗透势为-4.066 bar)的时候才能刺激其较强的生活能力;M-15菌株随着干旱的加剧生长保持基本的稳定状态,这也是一种对干旱适应的对策;M-01菌株能随着干旱情况的加剧会提高生活能力,增强其耐干旱能力;M-03菌株忍耐高温干旱的能力最弱。
对试验菌株的平均排序值进行聚类分析(如图2),该选标尺值为2为适宜。试验菌株因其平均排序大小被划分为3类[15]。第1类为M-08、M-10、M-11属于高温干旱适应较强类型;第2类为CK、M-05、M-06、M-07、M-09、M-12、M-15, 属 于高温干旱适应中等类型;第3类为M-01、M-02、M-03、M-04、M-13、M-14,属于高温干旱适应较弱类型。有些菌株OD值低于CK,一方面可能是由于培养液中产生的H2S对植株造成伤害所致,一方面可能是由于PEG浓度配制不均匀导致。
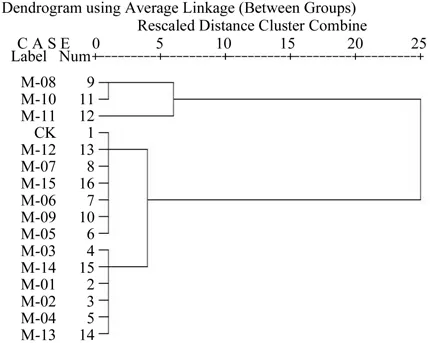
图2 菌液OD值平均排序值聚类分析结果Fig.2 Clustering analysis of average rank values of OD of rhizobium suspension
3 结论与讨论
温度是影响根瘤菌生长的重要生态因子之一。多数菌株生长的最适温度为18℃~32℃[16]。根瘤菌菌株在适宜的温度条件下生长随着时间的延长差异性会逐渐减小,可能会达到一个稳定的差异值;高温条件下各菌株间生长存在最小的差异值。
高温能明显抑制根瘤菌菌落生长。高温处理对根瘤菌菌株的耐高温性进行着有时间效应的筛选过程,并刺激根瘤菌菌株采用不同的适应对策。M-04、M-05、M-07、M-13菌株总是保持良好的生长势头,M-02、M-08、M-09、M-14、M-15等菌株随着温度的升高其仍会保持平缓的生长,而M-10、M-11、M-12菌株的生长优势会逐渐降低,甚至消失。这说明相思树种的根瘤菌对温度有较广范围的适应性,而且多数耐高温,这可能与相思树种原产热带,植株耐高温有关。
现多数研究是采用不同浓度的PEG溶液作为渗透胁迫剂,对种子萌发[17-18]、叶片[19]、苗木[20]等材料进行抗旱性研究,但具体表现原理尚未见到报道,对其中根瘤菌生长的具体情况还需要进一步的研究。
[1] 张荣祖. 改善自然环境生态,开发干热区土地资源.土地资源与土地资产研究论文集[A].长沙: 湖南科学出版社, 1996:395-401.
[2] 陈利顶,王 军,傅伯杰. 我国西南干热河谷脆弱生态区可持续发展战略[J]. 中国软科学(区域经济), 2001, 6: 95-99.
[3] 沙毓沧,纪中华,李建增,等. 西南地区干热河谷生态环境问题[J]. 西南农业学报报, 2006, 19(增): 312 - 318.
[4] 马焕成. 干热河谷造林新技术[M ]. 昆明: 云南科技出版社,2001:7-14..
[5] 黄宝灵, 吕成群, 韦原莲, 等. 相思树种根瘤菌的若干抗逆特性[J]. 南京林业大学学报: 自然科学版, 2004,28 ( 1): 29-32.
[6] F.J.伯杰森(陈冠维等译).生物固氮研究法[M], 北京:科学出版社, 1987: 241-252.
[7] Vincent J M. A Manual for the Practical Study of the Rootnodule Bacteria, IBP Handbook[M]. Oxford: Blackwell Scientifc Publications, 1970.
[8] 赵 斌,何绍江. 微生物实验[M]. 北京: 科学出版社 , 2002.
[9] 黄元桐, 崔 杰. 革兰氏染色三步法与质量控制[J]. 微生物学报, 1996, 36(1): 76-78.
[10] 黄明勇,张小平,李登煜,等.金沙江干热河谷区土著花生根瘤菌耐旱性初步研究[J].应用与环境生物学报, 2000,6(3):263-266.
[11] Bushby H V A, Marshall K C. Some factors affecting the survival of root – nodule bacteria on desiccation [J]. Soil Biol Biochem,1977, 9:143-147.
[12] 张 琴,李艳宾.六株耐酸苜蓿根瘤菌的筛选及生长特性研究[J].中国农学通报, 2007, 23(9): 435-439.
[13] 师尚礼,刘建荣,张 勃,等.甘肃寒旱区苜蓿根瘤菌抗逆性评价[J].草地学报,2007,15(1):1-6.
[14] 刘国生.微生物学实验技术[M]. 北京: 科学出版社,2008.
[15] 肖泽鑫, 彭剑华, 詹潮安, 等. 主成分分析在台湾相思优树选择标准和方法中的应用研究[J]. 中南林业科技大学学报,32(5): 54-58.
[16] 南宏伟,林思祖,曹光球,等.相思树根瘤菌优良抗逆性菌株的筛选[J].西北林学院学报,2009, 24(3):139-143.
[17] 李 娜,李 涛,李名扬. PEG6000渗透胁迫对画眉草种子萌发特性的影响[J].中国园艺文摘, 20l0,(2): 22-25.
[18] 张余洋,王文杰,郭玲,等.PEG胁迫下新疆主要加工番茄萌芽期耐旱性评价[J].中国农学通报, 2009, 25(24):269-275.
[19] 夏鹏云,吴 军,乔俊鹏,等.干旱胁迫对大叶冬青叶片生理特性的影响[J].河南农业大学学报, 2010, 44(1): 47-51.
[20] 陈郡雯,吴 卫,郑友良,等.聚乙二醇(PEG 6000)模拟干旱条件下白芷苗期抗旱性研究[J].中国中药杂志,2010,35(2):149-153.
Study on dry-hot tolerance of Rhizobium of Acacia confusa isolated from dry-hot valley
SHA Hua-xin1, WU Jian-rong1, ZHOU Li-ping2, WANG Fang2, ZHANG Dong-hua1, MA Huan-cheng2
(1. Key Lab.of Forest Disaster Warning and Control in Yunnan Province, College of Forestry, Southwest Forestry University, Kunming 650224, Yunnan, China; 2. Key Lab. of Biodiversity Conservation in Southwest Attached to China State Administration of Forestry,Kunming 650224, Yunnan, China)
Through studying the high temperature and drought resistance of Rhizobium sp. of Acacia confuse in the dry-hot valley, the Rhizobium’s growth rhythm under the condition of high temperature was revealed in order to provide a theoretical basis for screening out excellent Rhizobium germplasm resources. Through feld investigation, the Rhizobium sp. of A. confuse were collected from dryhot valley area, then were separated and purifed. The cultivation of symbiotic tumor of the purifed Rhizobium stains of A. confuse and aseptic seedlings of A. confuse was conducted, some new Rhizobium stains were selected and vaccinated to YMA culture medium, then cultured with constant temperature under different temperature gradients and the colony numbers and vertical and horizontal diameters were recorded. Through artificially simulating drought conditions, the Rhizobium stains were inoculated and cultured in the PEG culture fluid with concentration gradient of 0, 5%, 10%, 20%, 30% , the OD600values of the bacterial suspension was determined by using spectrophotometer and the corresponding curve fgure was drawn out. The experimental results show that the high temperature can significantly inhibit the growth of Rhizobium colonies; the OD values of YMA-PEG solution decreased with the increase of concentration; M-08, M-10, M-11 strains are the strains type that strongly adapted to high temperature and drought; CK, M-05, M-06,M-07, M-09, M-12, M-15 moderately adapted to high temperatures and drought; M-01, M-02, M-03, M-04, M-13 and M-14 strains had weaker adaptability to high temperatures and drought.
Acacia confuse; Rhizobia; dry-hot tolerance; dry-hot valley
S796
A
1673-923X(2013)08-0063-05
2013-01-16
国家林业公益行业研究专项“干热河谷木棉纤维人工林培育关键技术研究”(201104034),云南省高校干热河谷植被恢复创新团队;国家自然基金项目“干热河谷区木棉-丛枝菌根真菌共生系统的水分关系研究”(31260175);国家林业科技推广项目“干旱条件下木棉产业化栽培技术示范推广”(2011-35);“云南省重点学科森林保护学”(XKZ200905),云南省高等学校森林病虫害综合治理教学团队
沙桦欣(1987-),女,云南曲靖人,硕士研究生,主要从事资源微生物的研究
伍建榕(1963-),女,福建清流人,教授,博士,硕士研究生导师,主要从事森林保护与森林病理学的教学与科研工作;E-mail:wujianrong63@yahoo.com.cn
吴 彬]
