根部损伤及外源物质对红皮云杉幼苗酚酸含量的影响
2013-12-27马晓乾赵红盈宋小双范海娟
马晓乾 ,刘 欣,邓 勋,赵红盈 ,宋小双 ,范海娟
(1.黑龙江省林业科学院 森林保护研究所,黑龙江 哈尔滨 150040; 2.东北林业大学 林学院,黑龙江 哈尔滨150040)
根部损伤及外源物质对红皮云杉幼苗酚酸含量的影响
马晓乾1,刘 欣1,邓 勋1,赵红盈1,宋小双1,范海娟2
(1.黑龙江省林业科学院 森林保护研究所,黑龙江 哈尔滨 150040; 2.东北林业大学 林学院,黑龙江 哈尔滨150040)
以2年生红皮云杉幼苗为试验材料,利用高效液相色谱技术测定不同程度损伤模拟昆虫取食、外源物质茉莉酸(JA)、水杨酸(SA)、茉莉酸和水杨酸(JA+SA)(1:1)混合物处理后,分析不同时间内红皮云杉幼苗体内酚酸含量的变化情况。结果表明:不同程度损伤模拟昆虫取食红皮云杉幼苗后,25%损伤不能诱导红皮云杉幼苗体内酚酸类化合物含量发生显著的变化;除阿魏酸外,损伤50%和75%后,均不同程度地诱导了红皮云杉幼苗体内酚酸类化合物含量的变化,其中损伤75%诱导酚酸含量的变化较损伤50%持续时间长;外源物质处理后,JA、SA、JA+SA均不同程度地诱导了红皮云杉幼苗体内绿原酸、苯乙酸和水杨酸含量的降低,而苯甲酸、肉桂酸、没食子酸、阿魏酸及咖啡酸含量与对照相比无显著差异;经分析发现JA和SA处理对酚酸类化合物的合成具有拮抗作用,而JA+SA处理并没有体现2个信号物质的叠加,这与2个信号物质在酚酸类化合物合成途径中的拮抗作用的相互作用有关。说明利用不同诱导处理能够诱导启动信号物质防御系统,从而达到增强红皮云杉幼苗抗虫性是可行的。
红皮云杉;信号物质;酚酸;茉莉酸;水杨酸;根部损伤
寄主植物在长期的进化过程中形成自我防御机制,寄主植物对植食性昆虫的防御分为化学防御和物理防御,其中化学防御在抵抗植食性昆虫寄生行为的选择中起着主导作用[1-3]。寄主植物在受到机械损伤、昆虫取食、病原菌等其他生物因子侵扰及非生物因子胁迫时,其体内次生物质会发生变化[4-5]。酚酸是植物体内一种重要的次生性化合物,诸多研究表明,酚酸类化合物是寄主植物化学防御的重要物质之一,是合成植物毒素的前提物质,对植食性昆虫具有一定的抗性作用[6]。植物在受到不同种类的昆虫危害后,受害部位的酚类物质会呈现积聚现象[7-8],如一种尺蛾Epirrita autumnaffroy取食白桦Betula platyphylla和松黄叶蜂Neodiprion sertife危害松树均可导致寄主树木酚酸类化合物的增加[9],同时发现寄主植物体内酚酸含量的高低与植食性昆虫数量呈显著的负相关[10]。
红皮云杉Picea koraiensis是我国东北及华北地区主要的森林及城市绿化树种,其幼苗长期遭到地下害虫的危害,给林业生产和城市绿化造成严重的经济损失。目前关于红皮云杉幼苗经营技术、地下害虫对红皮云杉幼苗危害的发生规律及防治技术已有很多报道[11-12],但关于不同诱导处理对红皮云杉幼苗诱导产生抗性的研究极少,尤其是对不同诱导处理后红皮云杉幼苗酚酸含量变化的研究还未见报道。该项研究通过损伤模拟地下害虫取食、喷施外援物质茉莉酸(JA)、水杨酸(SA)、茉莉酸和水杨酸混合物(JA+SA)(1:1)诱导处理后,分析不同时间内红皮云杉幼苗酚酸含量的变化情况,以期从化学生态方面探索出一种调控红皮云杉幼苗地下害虫发生与危害的方法,应用于林业生产实践中。
1 材料与方法
1.1 试验材料与试验设计
于2012年6月上旬至7月下旬期间,在黑龙江省伊春市带岭区国家级实验苗圃基地(东经 128°37′44″~ 129°17′51″, 北 纬 46°50′10″~47°21′33″),选择2年生红皮云杉幼苗,进行根部损伤(幼苗根部25%、50%、75%的根须进行损伤)模拟昆虫取食、喷施浓度均为1 mmol·L-1的茉莉酸、水杨酸及茉莉酸和水杨酸混合物溶液处理,以无任何处理红皮云杉幼苗为对照(CK)。处理后分1、5、10、15、20、30、40 d采集标本(整株),置入便携式冰箱带回室内,而后放入-20℃冰箱内保存。
剪取采集的2年生红皮云杉幼苗针叶置入烘箱烘干后,用高速粉碎机粉碎,过60目筛后称取1.0 g样品,置入50 mL锥形瓶,加入1 mol·L-1NaOH 20 mL,摇匀。密封后水浴(40℃)24 h,超声振荡2 h,过滤,滤液静置24 h,而后加入1 mol·L-1HCl将滤液pH值调至2,再加入NaCl至饱和状态。然后加入乙醚并冷冻,离心机离心(0℃条件下,10 000 r·min-1离心5 min),提取3次,而后用旋转蒸发仪蒸干,加入无水硫酸钠脱水,最后加入2 mL色谱纯甲醇使其完全溶解,接着用0.22 µ滤膜将其过滤,作为待测液的提取液[13-14]。
1.2 酚酸标样的配制
选择与林木抗虫性密切相关的酚酸类物质原儿茶酸、绿原酸、咖啡酸、没食子酸、水杨酸、肉桂酸、对香豆酸、阿魏酸、丁香酸、香草酸、苯乙酸和苯甲酸为标准样品[3,15],分别称取12种酚酸标准样品各1 mg,用色谱纯甲醇稀释定容至10 mL后配制成12种酚酸混合标准母液,接着将其依次稀释为5倍、10倍、25倍、50倍、100倍和1 000倍,配成一系列的酚酸混标溶液,按上述液相色谱测定待测液。
1.3 酚酸含量的分析测定
方法参照文献[16-19]略作改动,采用Waters高效液相色谱仪测定待测液中的酚酸含量,色谱柱为C18柱,温度为23℃,2695二极管阵列检测器检测,检测波长为256 nm,自动进样,进样速度为0.9 mL·min-1。流动相(V/V/V):I为甲醇∶H2O∶冰乙酸(12∶80∶8);Ⅱ为甲醇∶H2O∶冰乙酸(90∶8∶2)。待测样品酚酸含量根据12种酚酸混合标液最大吸收峰和峰面积来确定,依据外标曲线计算酚酸的含量(mg·g-1),每个待测液样品的酚酸含量测定重复3次。
1.4 数据统计及分析方法
实验所得数据均利用Microsoft Off i ce Excel和SPSS18.0软件进行分析和处理。采用ANOVA单因素方差分析不同诱导处理间红皮云杉幼苗针叶内酚酸类化合物的差异显著性。
2 结果与分析
2.1 不同程度损伤模拟昆虫取食后红皮云杉幼苗酚酸含量的时序变化
通过不同程度损伤模拟昆虫取食红皮云杉幼苗后,对红皮云杉幼苗体内酚酸含量分离测定,共检测到苯甲酸、苯乙酸、没食子酸、肉桂酸、阿魏酸、绿原酸、水杨酸和咖啡酸8种酚酸类化合物,实验结果表明其诱导了红皮云杉幼苗体内酚酸含量的变化,因损伤程度不同表现出一定的差异。如图1所示,25%损伤处理的红皮云杉幼苗体内8种酚酸含量在不同时间内与对照相比差异均不显著,表明25%损伤模拟昆虫取食未对红皮云杉幼苗体内酚酸含量起到明显的诱导作用。而50%损伤处理的红皮云杉幼苗体内阿魏酸在1~5 d的含量与对照相比较差异不显著,而其他6种酚酸类化合物均呈现显著变化;处理1 d后,苯甲酸、肉桂酸、苯乙酸、咖啡酸与对照相比较均显著高于对照,绿原酸、水杨酸低于对照;处理5 d后,苯甲酸、肉桂酸、苯乙酸、没食子酸、咖啡酸含量均高于对照,绿原酸与对照相比较差异不显著,而水杨酸显著低于对照;处理10 d后,绿原酸、肉桂酸、咖啡酸显著高于对照,苯甲酸、苯乙酸、阿魏酸与对照相比较差异不显著,没食子酸、水杨酸含量显著高于对照;处理15 d后,绿原酸、肉桂酸、咖啡酸显著高于对照,苯甲酸、苯乙酸、没食子酸、阿魏酸与对照相较差异不显著,而水杨酸低于对照;处理20 d后,绿原酸、苯乙酸、阿魏酸明显高于对照,其他5种酚酸类化合物与对照相比较均不显著;处理30 d后,绿原酸、肉桂酸、咖啡酸略高于对照,而其余5种酚酸类化合物与对照相比较均不显著;处理40 d后,除咖啡酸略高于对照外,其余7种酚酸类化合物均与对照无明显差异。以上说明50%损伤模拟昆虫取食诱导了红皮云杉幼苗体内酚酸含量的变化并且比较显著。75%损伤处理的红皮云杉幼苗体内苯甲酸、苯乙酸、没食子酸、咖啡酸在1 d后的含量显著高于对照,而绿原酸、水杨酸显著低于对照,阿魏酸、肉桂酸与对照相比较差异不显著;处理5 d后,苯甲酸、肉桂酸、苯乙酸、没食子酸、咖啡酸显著高于对照,绿原酸、水杨酸、阿魏酸显著低于对照;处理10 d后,苯甲酸、肉桂酸、苯乙酸、咖啡酸均显著高于对照,绿原酸、没食子酸、水杨酸、阿魏酸均显著低于对照;处理15 d后,苯甲酸、肉桂酸显著高于对照,绿原酸、苯乙酸、水杨酸、咖啡酸与对照相比较均无明显差异,水杨酸、阿魏酸显著低于对照;处理20 d后,绿原酸、阿魏酸较显著高于对照,而其他6种酚酸类化合物含量与对照相比较均无明显差异;处理30~40 d后,除绿原酸及肉桂酸显著高于对照外,其余6种酚酸类化合物含量与对照相比较均无明显差异。说明75%损伤模拟昆虫取食迅速诱导了红皮云杉幼苗体内酚酸含量的变化,并且这种变化呈现出随时间的增加出现由强变弱的过程。

图1 不同程度损伤模拟昆虫取食红皮云杉幼苗后其体内酚酸含量的变化Fig.1 Changes of phenolic acids contents in P. koraiensis seedlings induced by different damage degrees of simulation insect feeding
2.2 外源物质诱导红皮云杉幼苗体内酚酸含量的变化
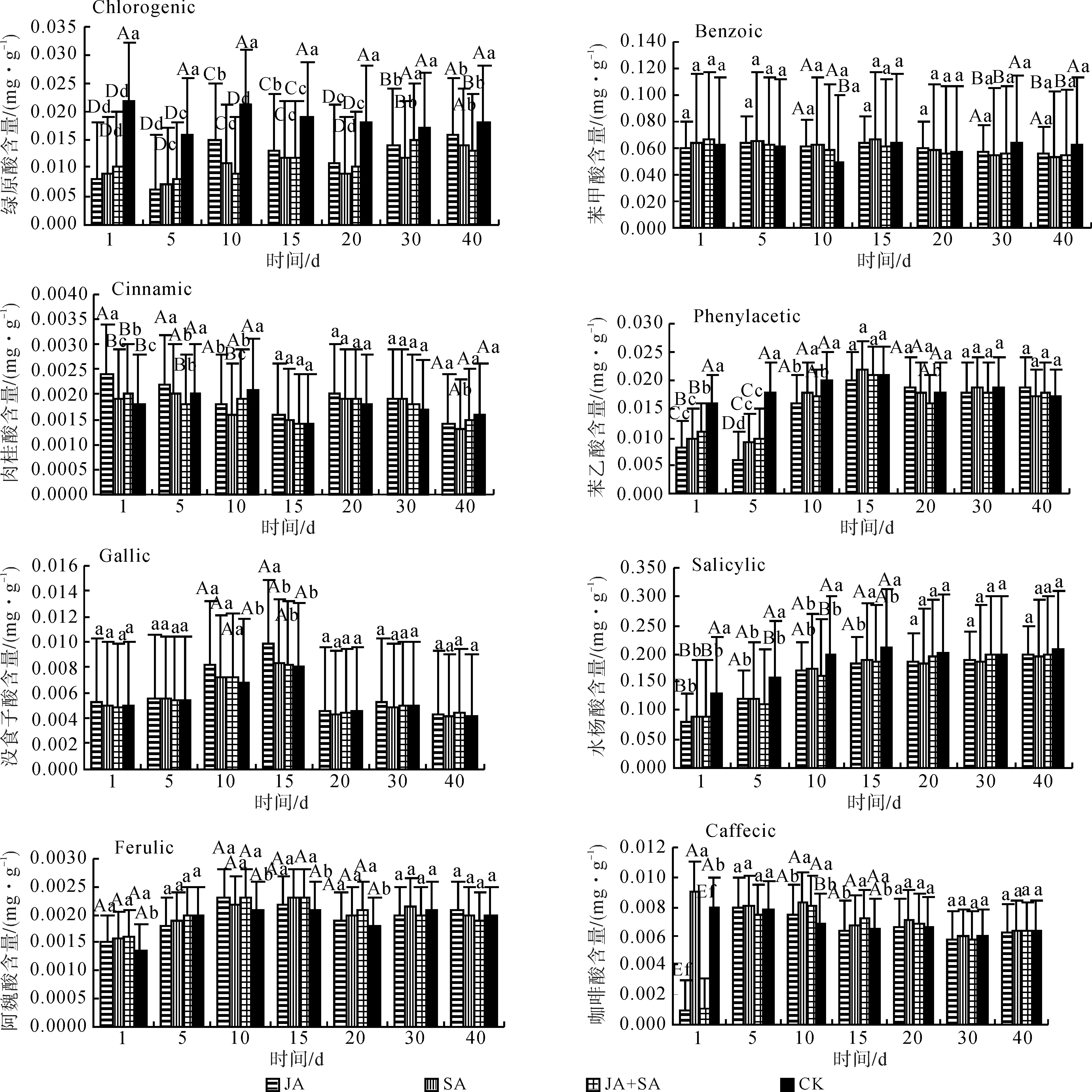
图2 外源物质诱导红皮云杉幼苗体内酚酸含量的变化Fig.2 Changes of phenolic acids contents in P. koraiensis seedlings induced by exogenous substances
通过对红皮云杉幼苗喷施外源物质茉莉酸、水杨酸、茉莉酸和水杨酸混合物(1∶1)处理后,对红皮云杉幼苗不同时间内酚酸类化合物进行测定,共检测到苯甲酸、苯乙酸、没食子酸、肉桂酸、阿魏酸、绿原酸、水杨酸和咖啡酸8种酚酸类化合物,实验结果表明,不同诱导处理导致红皮云杉幼苗体内酚酸含量随时间呈现波动变化,并在同一时间段内不同诱导处理表现出一定的差异。如图2所示,喷施JA处理的红皮云杉幼苗体内绿原酸、苯乙酸、水杨酸、咖啡酸含量在1 d后较对照显著降低,而苯甲酸、没食子酸含量与对照相比较无明显差异,肉桂酸、阿魏酸较对照有所升高;处理5 d后,绿原酸、苯乙酸、水杨酸含量亦显著低于对照,苯甲酸、肉桂酸含量、没食子酸、阿魏酸、咖啡酸含量与对照相比较无明显差异;处理10 d后,绿原酸、肉桂酸、苯乙酸、水杨酸含量显著低于对照,苯甲酸、没食子酸、阿魏酸、咖啡酸含量较对照有所升高;处理15 d后,绿原酸、水杨酸含量较对照显著降低,苯甲酸、肉桂酸、苯乙酸、阿魏酸、咖啡酸含量与对照相比较无明显差异,没食子酸含量显著高于对照;处理20 d后,绿原酸、水杨酸含量与对照相比较亦明显低于对照,其余6种酚酸类化合物与对照相比较均无明显差异;处理30~40 d后,除绿原酸、肉桂酸、苯甲酸含量略低于对照外,其余5种酚酸类化合物与对照相比较亦无明显差异。说明绿原酸、水杨酸和苯乙酸在明显降低,表明JA对红皮云杉幼苗体内绿原酸、水杨酸及苯乙酸的积累具有拮抗作用,抑制了绿原酸、水杨酸及苯乙酸化合物的合成。喷施SA处理的红皮云杉幼苗体内绿原酸含量在处理1~40 d后均低于对照,苯乙酸、水杨酸含量在1~15 d后亦低于对照,而后与对照无明显差异;肉桂酸含量在1、5 d后显著高于对照,10 d后低于对照,在15~40 d与对照相比较无明显差异;其余4种酚酸类化合物与对照相比较无明显差异。说明绿原酸、水杨酸和苯乙酸均表现为明显降低,表明喷施SA抑制或者阻止了红皮云杉内绿原酸、水杨酸及苯乙酸化合物的合成。喷施JA+SA处理的红皮云杉幼苗体内绿原酸含量在1~40 d后均低于对照,苯乙酸含量在1~10 d时显著低于对照,之后与对照无明显差异;肉桂酸含量在1 d后显著高于对照,5~10 d后低于对照,而后与对照无明显差异;水杨酸含量在1~15 d 后显著低于对照,而后与对照基本一致;咖啡酸含量1 d后显著低于对照,而后与对照无明显差异;其余3种酚酸类化合物含量与对照相比较亦无明显差异。
3 讨 论
本项研究以不同诱导处理对红皮云杉幼苗体内酚酸类化合物含量的变化为研究目的,探明不同处理后酚酸类化合物在红皮云杉幼苗诱导抗虫性中的表达。酚酸的种类及其含量与寄主植物的抗虫性密切相关,酚酸的种类和作用方式因植物的种类不同而不同。如抗性强的银白杨Populus alba和毛白杨Populus tomentosa树皮内的香豆酸、邻二苯酚和对羟基苯甲酸的含量,前者低于后者[20]。杨树韧皮部中的咖啡酸、肉桂酸、丁香酸对青杨脊虎天牛Xylotrechus rusticus具有较明显的趋避作用,而苯甲酸、苯乙酸、咖啡酸是兴安落叶松中重要的防御物质[3,21]。在本项研究中,通过不同程度损伤模拟昆虫取食后,红皮云杉幼苗体内苯甲酸、肉桂酸、苯乙酸、没食子酸及咖啡酸含量均较对照显著增加,这一现象说明这几种酚酸很有可能是红皮云杉幼苗抗虫性的表达物质。
同时,在本项研究中不同程度损伤模拟昆虫取食红皮云杉幼苗后,25%损伤不能诱导红皮云杉幼苗体内酚酸类化合物含量发生显著的变化;除阿魏酸外,损伤50%和75%后,均不同程度地诱导了红皮云杉幼苗体内酚酸类化合物含量的变化,其中损伤75%诱导酚酸含量的变化较损伤50%持续时间长,说明植物体内酚酸含量的变化与损伤程度具有一定的相关性[22]。这一结果与损伤是诱导植物体内酚酸类化合物合成的重要因子的观点一致[23]。
通过喷施不同外源物质诱导红皮云杉幼苗后发现,茉莉酸、水杨酸、茉莉酸+水杨酸均不同程度地诱导了红皮云杉幼苗体内绿原酸、苯乙酸和水杨酸含量的降低,有研究资料显示,绿原酸有利于提供昆虫抗氧化的保护,其防御作用较弱[24-25],如果是这样,那么绿原酸含量的降低在某种程度上是减弱了昆虫抗氧化的保护,从而不利于植食性昆虫对寄主植物的取食。水杨酸是在植物体内表达抗性的酚酸类化合物之一,在该项研究中发现,喷施水杨酸使得红皮云杉幼苗体内水杨酸的含量反而降低,这一现象可能是由于过量的外源物质水杨酸抑制了水杨酸在植物体内的合成或表达以及其他与其相关的防御物质的合成,喷施茉莉酸、茉莉酸+水杨酸与喷施水杨酸结果相似,这些信号物质能够诱导一系列次生物质的合成和基因的表达,其中有些是相同的,它们之间彼此联系和互相交流[26]。从研究结果看,喷施茉莉酸、水杨酸、茉莉酸+水杨酸后,红皮云杉幼苗体内苯甲酸、肉桂酸、没食子酸、阿魏酸及咖啡酸含量与对照相比较无显著差异,但笔者发现茉莉酸处理的酚酸类化合物含量略高于水杨酸处理,这种差异可能源于对苯丙氨酸解氨酶诱导的差异,苯丙氨酸解氨酶是苯丙烷生物代谢途径中的第一个酶,苯丙烷能够调节酚酸类化合物的合成[27-28]。从以上分析可以看出,茉莉酸和水杨酸处理对酚酸类化合物的合成具有拮抗作用,而茉莉酸+水杨酸处理并没有体现2个信号物质的叠加,这与2个信号物质在酚酸类化合物合成途径中的拮抗作用的相互作用有关。
[1] 谢 辉,王 燕,刘银泉,等.植物组成防御对植食性昆虫的影响[J].植物保护,2012,38(1):1-5.
[2] 马晓乾,滑 莎,宋小双,等.模拟昆虫取食对红皮云杉幼苗根部酶活性的影响[J].中南林业科技大学学报,2012, 32(9):37-40.
[3] 严善春,袁红娥,王 琪,等.叶损伤诱导兴安落叶松针叶中10种酚酸的变化[J].应用生态学报, 2010, 21(4):1000-1006.
[4] Gogoi R, Singh D V, Srivastava K D. Phenols as a bio-chemical basis of resistance in wheat against Karnal bunt[J]. Plant Pathology, 2001, 50:470-476.
[5] Joyce C P, Sam C, Cecil S. Relationship of cold accli-mation,total phenolic content and antioxidant capacity with chilling tolerance in petunia(Petunia×hybrida) [J].Environmental and Experimental Botany, 2005,53:225-232.
[6] Seneviratne G, Jayasinghearachchi H S. Phenolic acids: Possible agents of modifying N2-fixing symbiosis through rhizobial alteration[J]. Plant and Soil, 2003,252(2):385-395.
[7] Bennett M, Gallagher M, Fagg J, et al. The hypersensitive reaction membrane damage and accumulation of autof l uorescent phenolics in lettuce cells challenged by Bremia lactucae[J]. Plant Journal, 1996,9(6):851-865.
[8] Silva M C, Nicole M, Guerra-Guimaraes L, et al. Hypersensitive cell death and post-haustorial defense responses arrest the orange rust(Hemileia vastatrix) growth in resistant coffee leaves[J].Physiological and Molecular Plant Pathology,2002,60(4):169-183.
[9] 邓文红,沈应柏,李镇宇,等.虫食与熏蒸对马尾松苗木针叶酚酸含量的影响[J].北京林业大学学报, 2010,31(1):39-43.
[10] 程春龙,李俊清.植物多酚的定量分析方法和生态作用研究进展[J].应用生态学报, 2006,17(12):2457-2460.
[11] 陈广辉,杨红旗,张守攻,等.修剪和生长调节剂对青海云杉苗芽生长发育的影响[J].林业科学研究,2007, 20(3): 375-380.
[12] 胡英阁,陈洪君,孙长刚,等.红皮云杉苗造林地除草技术探讨[J].中国西部科技, 2009,8(22):52-53.
[13] 徐 伟.兴安落叶松诱导抗虫性研究[D].哈尔滨:东北林业大学,2006.
[14] 任 琴.马尾松快速诱导抗性及化学信号物质的研究[D].北京:北京林业大学,2006.
[15] 何冬明.黄檗主要防御蛋白活力和酚酸含量的时序变化[D].哈尔滨.东北林业大学,2011.
[16] Appel H M. Phenolics in ecological interactions: the importance of oxidation[J]. Journal of Chemical Ecology, 1993,19(7):1521-1552.
[17] Mèlanìe Louband, Wouter G van Doorn. Wound-induced and bacteria-induced xylem blockage in roses, Astibe and Viburnum[J]. Postharvest Biology and Technology, 2004, 32(3):281-288.
[18] John T Christeller. Evolutionary mechanisms acting on Proteinase inhibitor variability[J]. European Journal of Biochemistry, 2005,272(22): 5710-5722.
[19] Guerra D J, Cothren J T, Phillips J R. Influence of selected phenolic compounds on development of bollworm (Lepidoptera:Noctuidae) Larvae[J]. Journal of Economic Entomology, 1989,83(5): 2115-2118.
[20] 王 蕤,巨关升,秦锡祥.毛白杨树皮内含物对光肩星天牛抗性的探讨[J].林业科学,1995,31(4):185-187.
[21] 左彤彤,迟德富,王牧原,等.不同品系杨树酚酸类物质对青杨脊虎天牛的驱避作用[J].植物保护学报, 2008,35(2):161-164.
[22] Myster R W. Foliar pathogen and insect herbivore effects on two landslide tree species in Puerto Rico[J]. Forest Ecology and Management, 2002,169:231-242.
[23] Campos-Vargas R, Saltiveit M E. Involvement of putative chemical wound signals in the induction of phenolic metabolism in wounded lettuce[J]. Physiologia Plantarum, 2002,114:73-84.
[24] Rice-Evans C A, Miller N J, Paganga G. Antioxidant properties of phenolic compounds[J]. Trends in Plant Science, 1997, 2(4):152-159.
[25] Johnson K S, Felton G W. Plant phenolics as dietary antioxidants for insects: a test with genetically modif i ed tobacco [J]. Journal of Chemical Ecology, 2001,27(12):2579-2597.
[26] Appel H M. Phenolics in ecological interactions: the importance of oxidation[J]. Journal of Chemical Ecology, 1993,19(7):1521-1552.
[27] Cheong Y H, Chang H S, Gupta R, et al. Transcriptional prof i ling reveals novel interactions between wounding, pathogen,abiotic stress, and hormonal responses in Arabidopsis[J]. Plant Physiology, 2002,129 (2):661-677.
[28] Scotz H U, Koch T, Biedermann A, et al. Evidence for regulation of resistance in Arabidopsis to Egyptian cotton worm by salicylic and jasmonic signaling pathways[J]. Planta, 2002, 214(4):648-652.
Effects of root damage and exogenous substances on phenolic acids content in Picea koraiensis seedlings
MA Xiao-qian1, LIU Xin1, DENG Xun1, ZHAO Hong-ying1, SONG Xiao-shuang1, FAN-Hai-juan2
(1. Institute of Forest Protection, Heilongjiang ForestryAcademy, Harbin 150040, Heilongjiang, China; 2. College of Forestry,Northeast Forestry University, Harbin 150040, Heilongjiang, China)
By taking 2-year-old Picea koraiensis seedlings as tested materials, using high performance liquid chromatography, the phenolic acids content changes in P. koraiensis seedlings in different times were determined after simulating insects feeding under different degree of seedling injury and treated with Jasmonate(JA), salicylic(SA) or Jasmonate and salicylic mixture(JA+SA)(1∶1).The results show that after the seedlings were damaged by 25%, the trauma could not induced the phenolic acids content signif i cant change in the seedlings; Except ferulic, after damaged by 50% and 75%, the traumas induced the phenolic acids content signif i cant change in different degree, the trauma 75% induced the phenolic acids content change lasting more time than the trauma 25%. After treated with exogenous substances, JA, SA, JA + SA induced the reduction of P. koraiensis seedlings chlorogenic acid, phenylacetic acid and salicylic acid by varying degrees, while benzoic acid, cinnamic acid, gallic acid, ferulic acid and caffeic acid contents in the seedlings had not signif i cant differences compared with the photography; The analysis results proved that the JA, SA treatments had antagonism on synthesis of phenolic compounds, while JA + SA treatments did not ref l ect the substance of the superposition of the two signals, and this ascribes the mutual effects of two signal substances in phenolic acids synthesis pathway antagonism interactions, and indicates that different induction treatments can induce to start the signal substances defensive system, so as to achieve the feasibility of enhancing P. koraiensis seedlings’ insect-resistance.
Picea koraiensis; signal substances; phenolic acids; jasmonate acid; salicylic acid; root damage
2012-11-15
黑龙江省森林工业总局应用研究项目(sgzjY2010017)
马晓乾(1979-),男,宁夏人,助理研究员,硕士,主要从事森林虫害综合治理和昆虫化学生态研究;E-mail: 369086324@qq.com
S763
A
1673-923X(2013)03-0051-06
[本文编校:谢荣秀]
