固体发酵体系中白腐菌Echinodontium spp.的产酶特性研究
2013-12-27黄慧艳余洪波张晓昱
黄慧艳,刘 波 ,余洪波,张晓昱
(1. 华中科技大学 a.武昌分校;b.生命科学与技术学院,湖北武汉 430064;2.武汉市粮油食品中心检验站,湖北 武汉 430021)
固体发酵体系中白腐菌Echinodontium spp.的产酶特性研究
黄慧艳1a,刘 波2,余洪波1b,张晓昱1b
(1. 华中科技大学 a.武昌分校;b.生命科学与技术学院,湖北武汉 430064;2.武汉市粮油食品中心检验站,湖北 武汉 430021)
研究了固体发酵体系中选择性降解白腐菌株Echinodontium spp.在杉木(裸子植物)、毛竹(单子叶植物)和垂柳(双子叶植物)木质纤维素基质上木质素降解酶系、纤维素降解酶系的产生特性。结果表明:基质种类对白腐菌的纤维素酶产生特性没有较大影响;而木质素降解酶均呈现出培养前期高于后期的现象,且不同基质中酶活力水平差异明显,杉木基质上的酶活力水平明显低于毛竹和垂柳基质中的状况。木质素降解酶系的活力水平与木质素降解速率的变化趋势一致,但纤维素酶系的活力水平和纤维素降解速率之间并未呈现必然关联。木质素酶系对底物基质的有效降解,可能有利于纤维素酶在木质纤维素复合物体系中的渗透,从而增效纤维素的酶解。
白腐菌;木质素降解酶系;纤维素降解酶系;固体发酵
白腐菌可以分泌一系列木质纤维素降解酶系,是自然界中植物残体的主要降解者之一[1]。至今,纤维素内/外切酶、漆酶、锰过氧化物酶等白腐菌降解酶系已获得充分研究[2-6],但大多数降解酶系相关研究均在液体培养条件下进行[7],由于自然环境中白腐菌降解木质纤维素基质是一个固态发酵过程,故液体深层培养条件下降解酶系的产生特性难以表征白腐菌在自然状态下的降解特性[8]。
例如,木质素过氧化物酶(LiP)在液体发酵体系中被明确是木质素的主要降解酶之一,然而至今仍难以证实其在天然状态木质纤维素基质上的表达,其在木质纤维素降解中的作用特性也不清楚。另一方面,白腐菌固体培养体系中的降解酶产生模式不仅与菌株相关,且与木质纤维素基质的特异性也有着很大关联,如灵芝菌种于杨木基质上培养可合成锰过氧化物酶而于杉木基质中培养则不合成。所以,研究固体培养条件下白腐菌降解酶系的产生特性很有必要。
研究了选择性降解木质素的白腐菌株Echinodontium spp.在毛竹(单子叶植物)、垂柳(双子叶植物)和杉木(裸子植物)木质纤维素基质降解过程中合成的木质素酶系、纤维素酶系,初步探讨了不同基质上降解酶系的产生特性与白腐菌降解性能之间的关系。
1 材料与方法
1.1 菌 株
白腐菌株Echinodontium spp.。
1.2 药品及仪器
(1)主要药品
下列药品购自Sigma公司(分析纯):ABTS[2,2’-连氮-二-(3-乙基苯并噻唑-6-磺酸)]、CMCNa、微晶纤维素。
下列药品均为常规国产(分析纯):Tween80、DNS试剂、丙二酸钠、丙二酸、醋酸钠、醋酸、葡萄糖。
(2)主要设备与仪器
可见/紫外分光光度计:尤尼柯(上海)有限公司,UNICO-UV-2000。
其他微生物培养、生物化学分析测试的常规设备与仪器。
1.3 菌种培养和基质降解
种子培养基:85%(m/V)玉米秸秆粉、2%(m/V)蔗糖、10%(m/V)麸皮粉、3%(m/V)棉籽壳、300%(V/V)蒸馏水。混匀,分装至90 mm平板中,每个平板分装4 g,121 ℃灭菌20 min。接种白腐菌株Echinodontium spp.,于25 ℃条件下培养约10 d。
分别将已烘干的毛竹、垂柳和杉木茎秆木粉5.0 g放于125 mL三角瓶中,各加入蒸馏水10、12.5和15 mL,于121 ℃下灭菌20 min。每瓶接入直径为1 cm的Echinodontium spp.种子菌块2块,塑料膜封口且当菌丝长满三角瓶后将其倒置,以防止水分流失。未接种菌块的三角瓶作为空白。三角瓶置于25 ℃条件培养,分别于不同的培养时间 10、20、30、40、50、60、90、120 d时取样,小心剥去木质纤维素基质表面的接种块,备测定用。
1.4 酶液提取与测定
(1)酶液提取
在设定的培养时间点取样,向每个三角瓶内加入含0.01% Tween80的0.05 mol醋酸缓冲液(pH5.0)45 mL,将培养物搅散后置摇床上150 r/min持续振荡6 h,过滤得滤液备测木质素降解酶、纤维素降解酶的活力。
(2)纤维素降解酶活力测定
利用滤纸酶活表征总纤维素酶的活力,并分别测定了纤维素降解酶系的二个主要组分:纤维素内切酶(Endoglucanase,EG)、纤维素外切酶(Cellobiohydrolase,CBH)的活力。
总纤维素酶测定(滤纸酶活FPU法)[9]:底物为1 cm×3 cm的滤纸条,将其以电子天平称重使质量保证为(25±1) mg,放入试管中。酶液用0.05 mol醋酸缓冲液(pH5.0)稀释至一定浓度,取0.5 mL稀释酶液加入1.0 mL醋酸缓冲液(pH4.8),置50 ℃水浴1 h,然后迅速冷却并加入2.0 mL DNS试剂终止反应,试管以塑料纸封口后再置沸水浴内10 min,迅速冷却并于540 nm测定吸光值。酶活力以反应进行1 h内的还原糖变化量表示。1个酶活单位定义为每分钟使葡萄糖转化的微摩尔数。
纤维素内切酶、纤维素外切酶的测定分别采用CMCNa法[10]、微晶纤维素法[10]。酶液用0.05 mol醋酸缓冲液(pH5.0)稀释至一定浓度,取0.5 mL稀释酶液迅速加入1.0 mL 0.5%底物(CMCNa、微晶纤维素)溶液,置50 ℃水浴0.5 h后,迅速加入2.0 mL DNS试剂终止反应,试管以塑料纸封口后再置沸水浴内10 min,迅速冷却并于540 nm测定吸光值。1个酶活单位定义为每分钟使底物转化的微摩尔数。
(3)木质素降解酶活力测定
两种主要的木质素降解酶:漆酶(Lac)、锰过氧化物酶(MnP)被测定。
漆酶测定(ABTS法):酶液用0.05 mol醋酸缓冲液(pH5.0)稀释至一定浓度,取1.0 mL稀释酶液加入1.5 mL 1 mmol的ABTS底物液,于420 nm测定吸光值,每15 s钟记录一次数据。1个酶活单位定义为每分钟使底物转化的微摩尔数[11]。
锰过氧化物酶测定(丙二酸法):酶液用0.05 mol醋酸缓冲液(pH5.0)稀释至一定浓度,取1.5 mL稀释酶液加入1.0 mL 4 mmol的MnSO4溶液、1.0 mL 0.2 mol丙二酸缓冲液(pH4.0),随后加入1.0 mL 0.4 mmol的H2O2溶液,并立即于270 nm测定吸光值,每15 s记录一次数据。1个酶活单位定义为每分钟使底物转化的微摩尔数[12]。
2 结果与分析
2.1 基质种类对Echinodontium spp.产木质素降解酶的影响
前期研究确认,在Echinodontium spp.的固体培养体系中也无法检测到木质素过氧化物酶活性,因此仅测定了漆酶和锰过氧化物酶的活力。如图1~2所示,从整体水平来看,均以毛竹基质上的漆酶和锰过氧化物酶活力最高,以杉木基质上的两种酶活力最低,三种基质间的酶活力水平差异明显。漆酶活性于降解初期(前10 d)已达到最高水平,随后下降。毛竹基质上漆酶活力下降较缓,至降解的末期仍保持有较高酶活,杉木基质上漆酶活力下降最快,至降解后期酶活已极低。菌株在毛竹基质上产生的锰过氧化物酶活力显著高于其在杉木和垂柳基质上的酶活,最高达1 158 IU/g,而杉木和垂柳基质中的锰过氧化物酶活力均低于500 IU/g。三种基质上的锰过氧化物酶活力均在降解前期30 d内达峰值,之后逐渐降低,于降解末期至低酶活甚至无法检测。

图1 Echinodontium spp.在毛竹(▲)、垂柳(■)和杉木(●)木质纤维素机制上的Lac活力Fig.1 Lac activities of Echinodontium spp.: to P. pubescens(▲), S. babylonica (■) and C. lanceolata (●)
2.2 基质种类对Echinodontium spp.产纤维素酶的影响
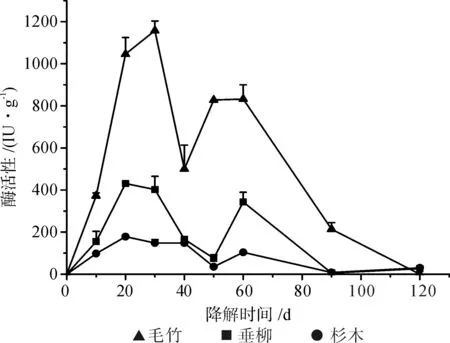
图2 Echinodontium spp.在毛竹(▲)、垂柳(■)和杉木(●)木质纤维素基质上的MnP活力Fig.2 MnP activity of Echinodontium spp.to P. pubescens(▲), S. babylonica (■) and C. lanceolata (●)

图3 Echinodontium spp.在毛竹(▲)、垂柳(■)和杉木(●)木质纤维素基质上的总纤维素酶活Fig.3 Total cellulase activities of Echinodontium spp. to P. pubescens (▲), S. babylonica (■) and C. lanceolata (●)
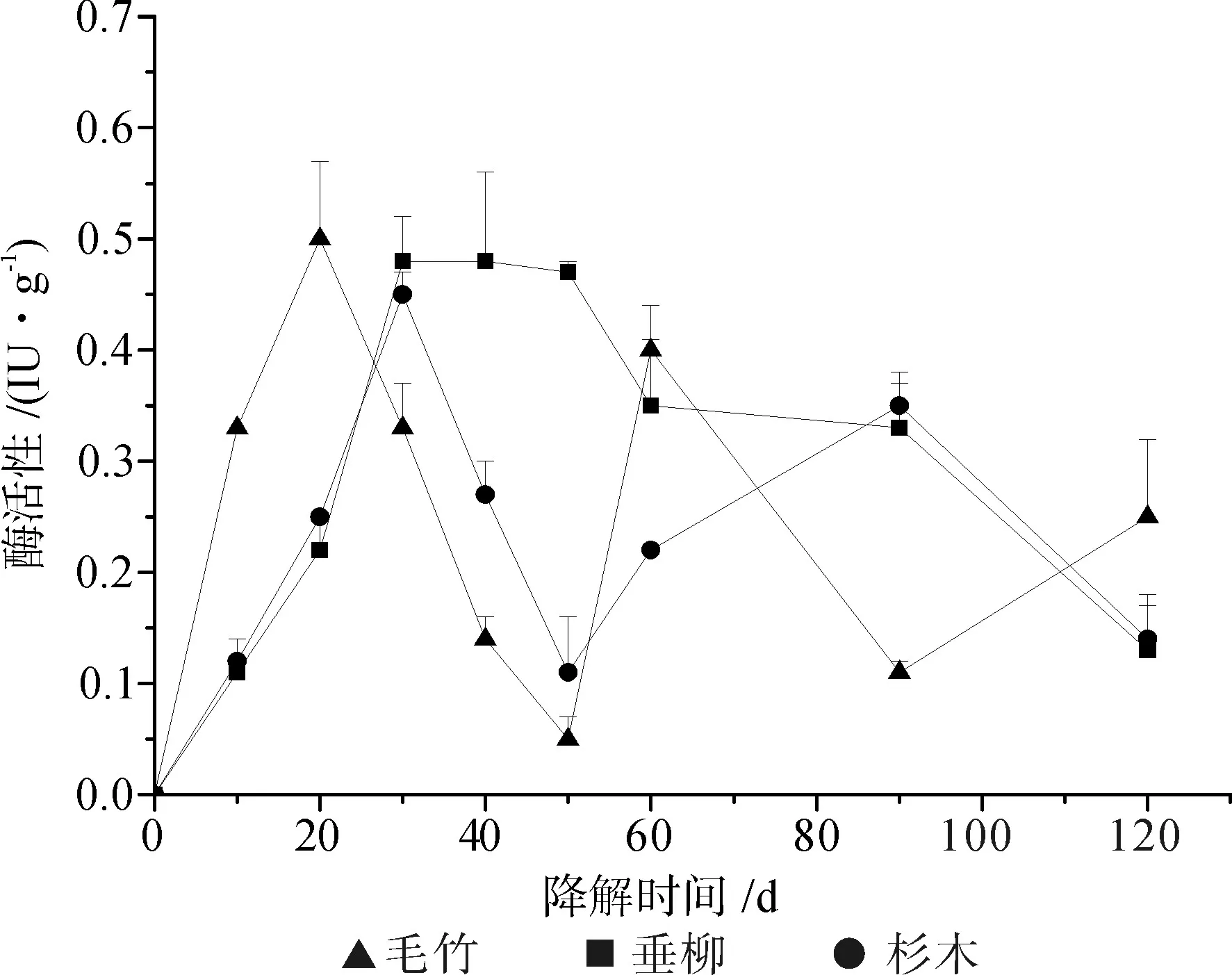
图4 Echinodontium spp.在毛竹(▲)、垂柳(■)和杉木(●)木质纤维素基质上的EG活力Fig.4 EG activity of Echinodontium spp. to P. pubescens(▲), S. babylonica (■) and C. lanceolata (●)
图3~5显示了Echinodontium spp.在三类不同的木质纤维素基质上培养,其降解过程中产生的纤维素酶活力。结果表明:三种基质上纤维素酶的活力水平均呈现前高后低的趋势。Echinodontium spp.在三类基质上表现的总纤维素酶活力无显著差异(P<0.01),因此基质种类对菌株总纤维素酶的产生并没有很大影响;Echinodontium spp.在毛竹基质中较早获得较高的纤维素内切酶活力(于培养第20 d时达峰值),随后垂柳与杉木基质上也产生较高的纤维素内切酶活力(均于培养第30 d获得峰值),三种基质上的纤维素内切酶活力水平变化规律与总纤维素酶的活力变化相似;而三种基质上产生的纤维素外切酶活力在整个降解过程中均呈很低水平,尤其在降解后期基本无活性表现。
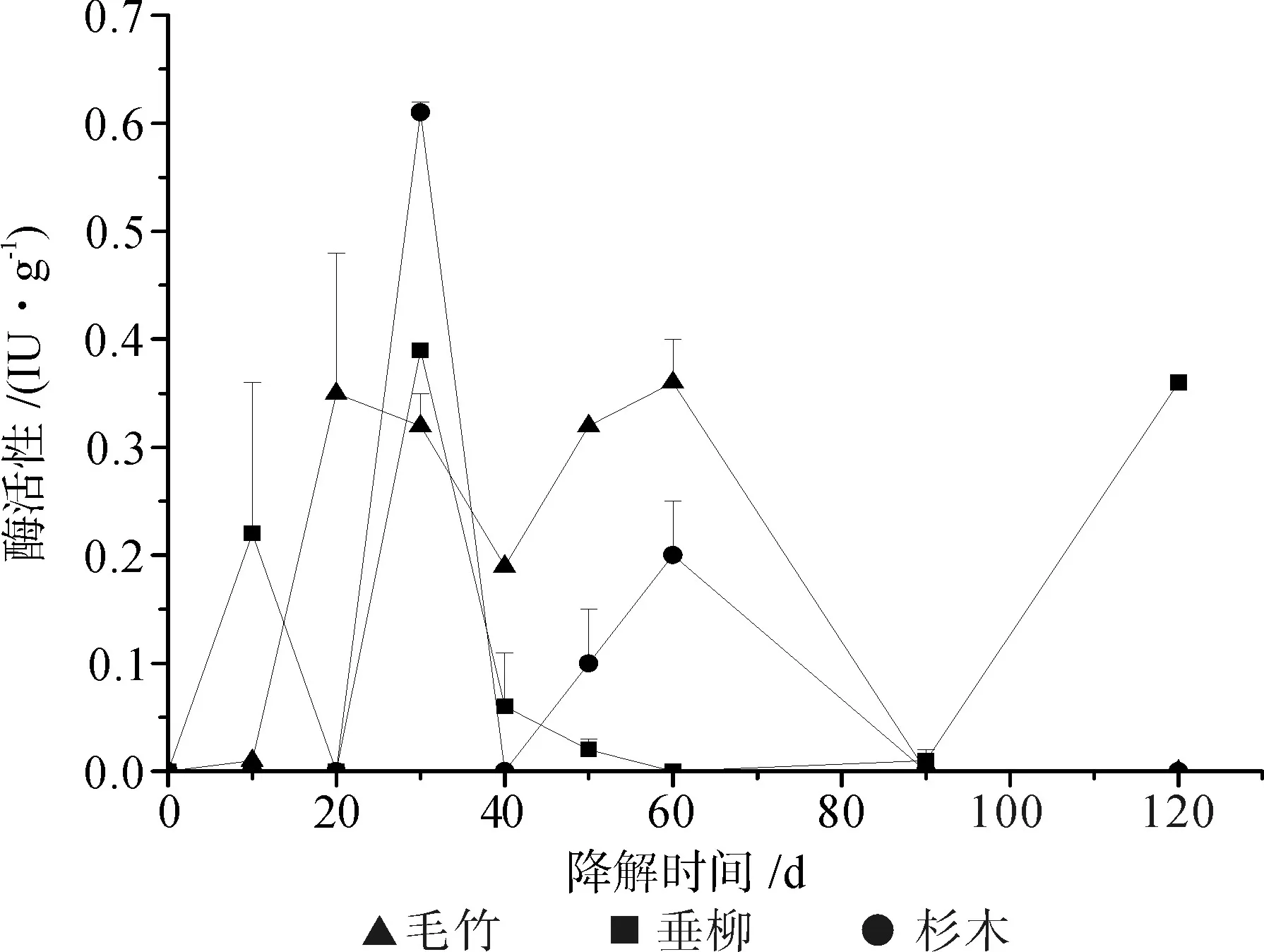
图5 Echinodontium spp.在毛竹(▲)、垂柳(■)和杉木(●)木质纤维素基质上的CBH活力Fig.5 CBH activity of Echinodontium spp. to P. pubescens(▲), S. babylonica (■) and C. lanceolata (●)
2.3 酶活产生与木质纤维素降解之间的关系
固体培养体系中Echinodontium spp.表现了很高的锰过氧化物酶与漆酶活力水平,且在降解中期之前高于降解中期之后,至降解后期时各酶活均已很低甚至未能检测,这与前期工作中发现的三种基质中木质素降解速率“前期快、后期缓”的变化规律相一致。此外,Echinodontium spp.在杉木基质上的两种木质素降解酶活力均低于垂柳与毛竹基质上的酶活水平,白腐菌株对杉木基质中木质素的降解率总体上也低于其他两类基质(另文发表),这也显示了木质素降解酶系和木质素降解率之间的相关性。另一方面,木质素的化学组成与结构对其降解酶系作用的抗性影响也不可忽视,研究表明:裸子植物(如杉木)木质素含量几乎为被子植物(如垂柳和毛竹)的两倍且G单体的含量较高,因此比被子植物的木质素更不易被降解[13-14]。
先期工作中已发现(另文发表),以菌株Echinodontium spp.处理三种木质纤维素基质,毛竹和垂柳基质上至培养中期后纤维素的降解将由低速转变为高速,而杉木基质上纤维素一直呈低速降解状态。上文数据显示:菌株在三种木质纤维素基质上产生的纤维素酶系活力并无显著差异,且表现为降解早期高于降解晚期。这说明白腐菌株在降解不同类型木质纤维素的过程中,其纤维素酶系的活性水平和基质中纤维素的降解速率之间并未呈现必然关联。
由于物质的酶促降解涉及酶与底物两项因素,因此底物的特性差异即可能是造成纤维素降解速率改变的原因所在。已知,做为木质纤维素复合物组分之一的纤维素,其降解过程并非是孤立的[15-17]。在酶促反应过程中,其他组分的存在状态将影响纤维素的降解,天然木质纤维素基质通常比纯的纤维素(例如滤纸、棉花等)更难于降解也正是因此。另外,虽然不同来源纤维素的组成与结构并没有太大差异,但木质素与半纤维素组分的化学组成与结构却往往存在显著区别,所以不同木质纤维素基质的降解过程也是有差异的。研究即证实,裸子植物(如杉木)木质纤维素基质中的纤维素组分更难于受纤维素酶降解[15,18-20]。从这一角度考虑,毛竹和垂柳基质上木质素酶活水平高,早中期木质素降解能力较强,因而可能有利于纤维素酶于培养中后期时在木质纤维素基质中的渗透,从而在中后期纤维素酶活力水平下降时仍增强了纤维素的降解;杉木基质上木质素酶活水平低,同时受到木质素化学组成与结构对其降解的抗性影响,故木质素降解能力弱,因而可能阻碍了纤维素酶于培养中后期在木质纤维素基质中的渗透,所以在整个培养过程中纤维素始终处于低速降解状态。
3 结 论
在固体发酵过程中,木质纤维素基质种类对白腐菌的纤维素酶产生特性没有较大影响,纤维素酶系活力水平均呈现降解前期高于降解后期的规律;而不同基质上木质素降解酶的产生则差异明显,酶活力水平由高到低可概括为:毛竹>垂柳>杉木。木质素降解酶系的活力水平与木质素降解“前高后低”的趋势相一致,但纤维素酶系的活力水平和纤维素降解速率之间并未呈现必然关联,其原因可能在于木质素酶系对底物基质的有效降解,有利于纤维素酶在木质纤维素复合物体系中的渗透,从而增效纤维素的酶解。
[1] Ferraz A. Biodegradation of Pinus radiata softwood by white-and brown-rot fungi[J]. World Journal of Microbiology and biotechnology, 2001,17: 31-34.
[2] Arai Y. The stimulation of extracellular carbohydrases of edible mushrooms by the hot water-soluble fraction from corn fi ber[J].Mycoscience, 2005,46(4):235-240.
[3] Asiegbu F O, Paterson A, Smith J E. Inhibition of cellulose saccharification and glycolignin-attacking enzymes of five lignocellulose-degrading fungi by ferulic acid[J].World Journal of Microbiology and Biotechnology, 1996,12(1):16-21.
[4] Barrasa J M. Electron and Fluorescence Microscopy of Extracellular Glucan and Aryl-Alcohol Oxidase during Wheat-Straw Degradation by Pleurotus eryngii[J]. Applied and Environmental Microbiology, 1998, 64(1):325-332.
[5] Reddy C A. An overview of the recent advances on the physiology and molecular biology of lignin peroxidases of Phanerochaete chrysosporium[J]. Journal of Biotechnology,1993, 30(1): 91-107.
[6] Khalil A I. Production and characterization of cellulolytic and xylanolytic enzymes from the ligninolytic white-rot fungus Phanerochaete chrysosporium grown on sugarcane bagasse[J].World Journal of Microbiology and Biotechnology,2002,18(8):753-759.
[7] Masaphy S, Levanon D.The effect of lignocellulose on lignocellulolytic activity of Pleurotus pulmonarius in submerged culture[J]. Applied Microbiology and Biotechnology, 1992,36(6): 828-832.
[8] Hatakka A. Biodegradation of lignin, in Lignin, Humic Substances and Coal, M. Hofrichter and A. Steinbüchel,Editors[J]. WILEY-VCH: Helsinki,2001:129-167.
[9] Cai Y J. Production and distribution of endoglucanase,cellobiohydrolase, and beta-glucosidase components of the cellulolytic system of Volvariella volvacea, the edible straw mushroom[J]. Applied and Environmental Microbiology, 1999,65(2):553-9.
[10] Mata G, Hernndez D M M, Andreu L G I. Changes in lignocellulolytic enzyme activites in six Pleurotus spp. strains cultivated on coffee pulp in confrontation with Trichoderma spp.[J].World Journal of Microbiology and Biotechnology, 2005, 21(2):143-150.
[11] Hakalaa T K. Manganese peroxidases, laccases and oxalic acid from the selective white-rot fungus Physisporinus rivulosus grown on spruce wood chips[J].Enzyme and Microbial Technology, 2005,36(4):461-468
[12] Steffen K T, Hofrichter M, Hatakka A. Mineralisation of 14C-labelled synthetic lignin and ligninolytic enzyme activities of litter-decomposing basidiomycetous fungi[J]. Appl Microbiol Biotechnol, 2000,54(6):819-25.
[13] Vanea C H, Drageb T C, Snapeb C E. Bark decay by the white-rot fungus Lentinula edodes: Polysaccharide loss, lignin resistance and the unmasking of suberin[J]. International Biodeterioration and Biodegradation, 2006,57(14-23).
[14] Martinez A T. Studies on wheat lignin degradation by Pleurotus species using analytical pyrolysis. Journal of Analytical and Applied Pyrolysis, 2001,58-59:401-411.
[15] Ramos L P.The effect of Trichoderma cellulases on the fine structure of a bleached softwood kraft pulp[J].Enzyme and Microbial Technology, 1999,24(7):371-380.
[16] Yoshimoto M. Effects of ultrasonic intensity and reactor scale on kinetics of enzymatic saccharification of various waste papers in continuously irradiated stirred tanks[J]. Ultrasonics Sonochemistry, 2005,12 (5):373-384.
[17] Wyman C. Features of promising technologies for pretreatment of lignocellulosic biomass[J]. Bioresource Technology,2005,96(6):673-686.
[18] Gregg D J, Saddler J N. Factors affecting cellulose hydrolysis and the potential of enzyme recycle to enhance the efficiency of an integrated wood to ethanol process[J]. Biotechnology and Bioengineering, 1996,51(4):375-383.
[19] Ziemer C, Ragauskas A J. CP/MAS 13C NMR analysis of cellulase treated bleached softwood kraft pulp[J]. Carbohydrate Research, 2006, 341(5):591-597.
[20] 刘 波,黄慧艳,余洪波,等.木质纤维素各类对白腐菌降解选择性的影响[J].中南林业科技大学学报,2012,32(8):108-111.
Study on enzyme-producing properties of white rot fungus(Echinodontium spp.) on solid lignocellulose-degradation
HUANG Hui-yan1a, LIU Bo2, YU Hong-bo1b, ZHANG Xiao-yu1b
(1a. Wuchang Branch Campus; 1b. School of Life Science and Technology, Huazhong University of Science and Technology,Wuhan 430064, Hubei, China; 2. Wuhan Central Inspection of Grain and Food, Wuhan 430021, Hubei, China)
The characteristics of lignolytic and cellulolytic enzymes production by white rot fungi Echinodontium spp. based on lignocellulose such as Chinese fir, bamboo and Chinese willow were studied. The results show that the cellulytic enzymes did not affect obviously by the type of substrates while the lignolytic enzymes based on different materials had remarkably differences, all the lignolytic activities were higher at early stage of culture than later, the enzymatic activities based on Chinese fi r were much lower than those based on bamboo and Chinese willow; the changeing trend of lignin degradation rate coincided with the variation of lignolytic activities, but there was no necessarily relationship between the cellulose degradation rate and the cellulytic activities; the effective degradation of substrates by lignolytic enzymies may promote the penetration of cellulases into lignocellulose which may contribute to the improvement of cellulose degradation.
Echinodontium spp.; lignolytic enzyme; cellulolytic enzyme; solid degradation
S789.8
A
1673-923X(2013)03-0025-05
2012-07-06
国家自然科学基金青年项目(30901137)
黄慧艳(1977-),女,湖南溆浦人,讲师,博士,主要从事木质纤维素生物降解研究;E-mail: hyhuang@mail.hust.edu.cn
刘 波(1979-),男,湖北黄石人,工程师,硕士,主要从事生化分析工作与研究;E-mail:huanyueyuji@sina.com
[本文编校:吴 毅]
