TiO2-MDEA-H2O纳米流体中CO2的界面吸收特性
2013-12-26李舒宏张小松
李舒宏 丁 一 杜 垲 张小松
(东南大学能源与环境学院,南京210096)
强化气液传质也可以提高吸收速率,在溶液中加入细微固体颗粒就是一种重要的强化吸收方法[5].细微固体颗粒的存在可以增强气液传质[6],Lu等[7]研究了微米级的颗粒对不同溶液吸收CO2的影响,与不加颗粒的实验相比,吸收都得到了强化.自Choi[8]提出纳米流体的概念后,学者们对纳米颗粒在传热传质领域的应用进行了研究.Kim等[9]进行了SiO2-H2O纳米流体鼓泡吸收CO2的实验,发现纳米颗粒的加入对吸收起到了强化作用.Olle等[10]对氧气在纳米流体中的传质特性做了研究,Pang 等[11]研究了加入纳米颗粒后的氨水对氨气的吸收特性,发现纳米颗粒的加入可以强化吸收.
但是现有的研究大多数是在鼓泡反应器或者搅拌反应器中进行的.为了排除其他影响因素,观察纳米颗粒对气液界面上的吸收影响,本文在选用纳米TiO2颗粒制备了分散稳定性良好的纳米流体基础上,对TiO2-MDEA-H2O纳米流体静止液面吸收CO2的特性进行了实验研究,为纳米颗粒强化MDEA溶液吸收CO2的研究提供一些参考数据.
1 实验
1.1 试剂和仪器
采用的试剂:锐钛型TiO2颗粒(南京埃普瑞纳米材料有限公司),平均粒径为15 nm,比表面积为120 m2/g;N-甲基二乙醇胺(四川省精细化工研究设计院)的纯度大于99%;蒸馏水(南京东南纯净水厂);CO2气体(南京特种气体厂有限公司),纯度大于99.9%.采用的仪器为MPM4730压力传感器(麦克传感器有限公司),量程为0~200 kPa(绝对压力),精度为 0.15%FS;高精度低温恒温槽(上海比朗仪器有限公司),控温精度为±0.1 ℃;5622型快速响应铂电阻(Fluke公司),精度为±0.1 ℃;安捷伦34970A数据采集仪;JA5003电子天平(上海上平仪器有限公司),精度为1 mg;QBZY-1数字式表面张力仪(上海方瑞仪器有限公司),精度为0.1 mN/m.
1.2 实验装置及流程
气体吸收实验装置如图1所示,实验流程如下:① 先将整个系统抽真空并充入CO2.关闭阀门6,将三通阀9开至吸收室10,与真空泵相连,打开真空泵抽真空并将阀门13关闭,保持5 min,检查系统密封性.将三通阀9转至吸收室10与储气室7相通,打开阀门6和阀门8,充入CO2,关闭阀门6和阀门8,保温一段时间,通过温度传感器监测气体温度,当CO2气温上升至实验温度后,开始实验.② 将40 mL保温至实验温度的溶液用注射器加入吸收室,打开阀门8通入CO2,使吸收室10内压力至预定压力(0.14 MPa),关闭阀门8开始实验,用压力传感器和数据采集仪记录吸收室内压力变化.
实验中使用恒温水浴来保持实验温度.本实验中吸收室内液体不加搅拌,使其保持静止,仅由溶液表面来吸收CO2,从而考察界面吸收特性.
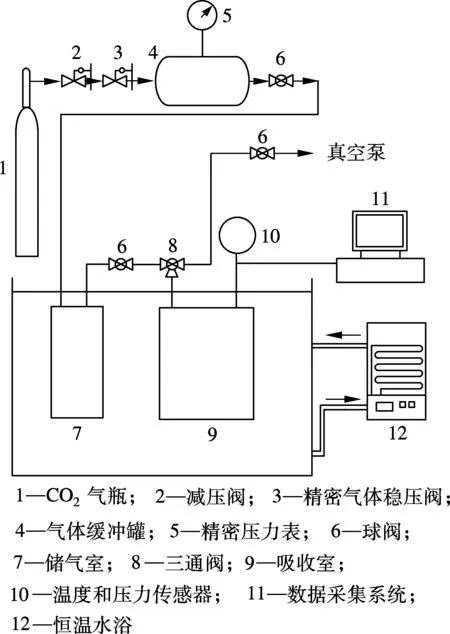
图1 气体吸收实验装置
2 实验结果与讨论
2.1 实验数据处理
用有效吸收比来表征纳米TiO2颗粒对MDEA溶液静止液面吸收CO2总量的影响,即
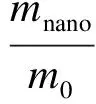
(1)
式中,mnano为加入纳米颗粒后MDEA溶液对CO2的吸收总量;m0为不加颗粒MDEA溶液对CO2的吸收总量.E>1,说明颗粒的加入对吸收有强化效果.
吸收室体积(0.991×10-3m3)在实验前用水标定;吸收室内径为10 cm,传质面积为7.854×10-3m2.在0.14 MPa(绝对压力)下进行了不同温度和不同纳米颗粒质量分数下的吸收实验,每次实验加入40 mL MDEA溶液.
④局地暴雨多发。汛期多次发生局部短历时强降雨。黑龙江省欧根河、海伦河等支流最大日降雨量113~140 mm,为多年少见。吉林省安图县四道白河最大1小时降雨量135 mm,内蒙古自治区鄂伦春旗东方红农场最大日雨量172mm,均创历史纪录。
由阻尼膜理论可知[12],在恒温吸收过程中,CO2分压力随时间的变化关系可以由下式表示:
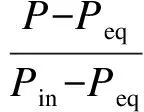
(2)
式中,Pin为吸收过程刚开始时的CO2分压力,Pa;Peq为吸收平衡时的CO2分压力,Pa;k为表观吸收速率常数,s-1;t为吸收时间,s.
由文献[13]可知,阻尼膜理论可以精确地描述MDEA吸收CO2体系的反应过程.图2(a)为10 ℃时溶液吸收CO2过程中的压力-时间关系图,将图2(a)的压力-时间数据拟合成形式为y=Be-(x/b)+y0的指数曲线,相关系数分别为0.999 1,0.999 3,0.999 3,由此可见,曲线的拟合精度很高,说明式(2)能很好地描述本文中的吸收过程.
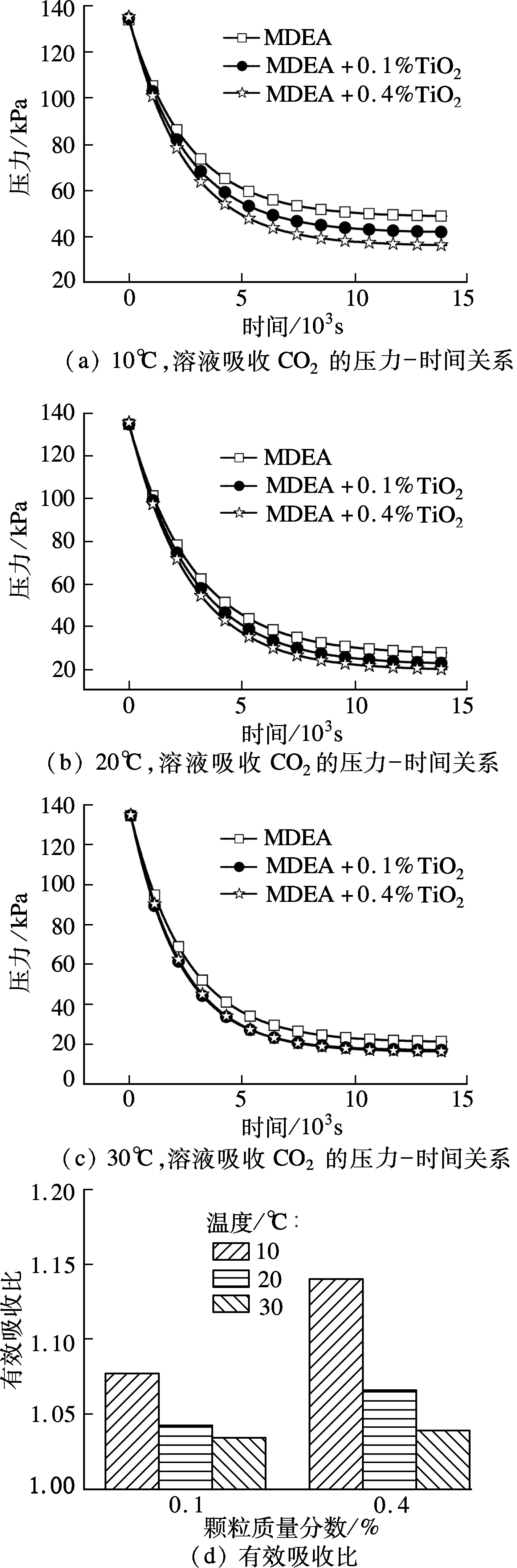
图2 不同温度、不同颗粒质量分数对吸收的影响
本文中实验压力较小,根据吸收室体积和加入的溶液量,可由下式计算得到纳米流体吸收的CO2量:
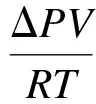
(3)
式中,n为纳米流体吸收的CO2摩尔数,mol;ΔP为吸收室内的压降,Pa;V为气体体积,m3;R为普适气体常数,8.314 J/(mol·K);T为气体温度,K.
由于表观吸收速率常数是体现整个吸收过程的参数,无法反映某一段时间内的吸收情况,因此经由下式计算得到某一段吸收过程的平均吸收速率[14]为
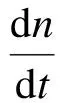
(4)
式中,φ为溶液对CO2的吸收速率,mol/(m2·s);A为气液界面面积,m2;Δn为一段时间内的吸收量,mol;Δt为吸收时间间隔,本文取Δt=100 s.
2.2 纳米颗粒质量分数和温度对吸收的影响
本文进行了不同温度、不同颗粒质量分数下的吸收实验.图2(a)、(b)、(c)分别为10,20,30 ℃下溶液对CO2的吸收情况.图2(d)为不同温度与颗粒质量分数下溶液的有效吸收比.由图可见,在实验的温度区间内,随着温度的升高,不同质量分数纳米颗粒之间强化效果的差距逐渐减小.
表1为溶液在20 ℃时吸收CO2的表观吸收速率常数,表观吸收速率常数由实验数据根据式(2)计算得到,由表可见,随着颗粒的加入,表观吸收速率常数也随着增大.

表1 溶液20℃吸收CO2的表观吸收速率常数
2.3 纳米颗粒强化吸收的机理探讨
在传质过程中,颗粒的存在引起的多种因素变化对传质产生了影响.图3为各温度下溶液在0~3 000 s吸收CO2的吸收速率-时间关系,由图可见,刚开始吸收时,未加纳米颗粒的溶液对CO2吸收速率比加纳米颗粒的快.这可能是由于刚开始吸收时,表面那层溶液还未吸收CO2,对CO2的吸收速率较快,而刚制备的纳米流体由于其分散稳定性较好,纳米颗粒处于均匀混合状态,颗粒悬浮于气液界面,造成有效传质面积的下降,从而使得吸收速率变慢.但是随着吸收的进行,表层的溶液吸收CO2越来越多,其吸收能力逐渐下降,纳米颗粒对溶液吸收CO2的强化效果逐渐显现出来.
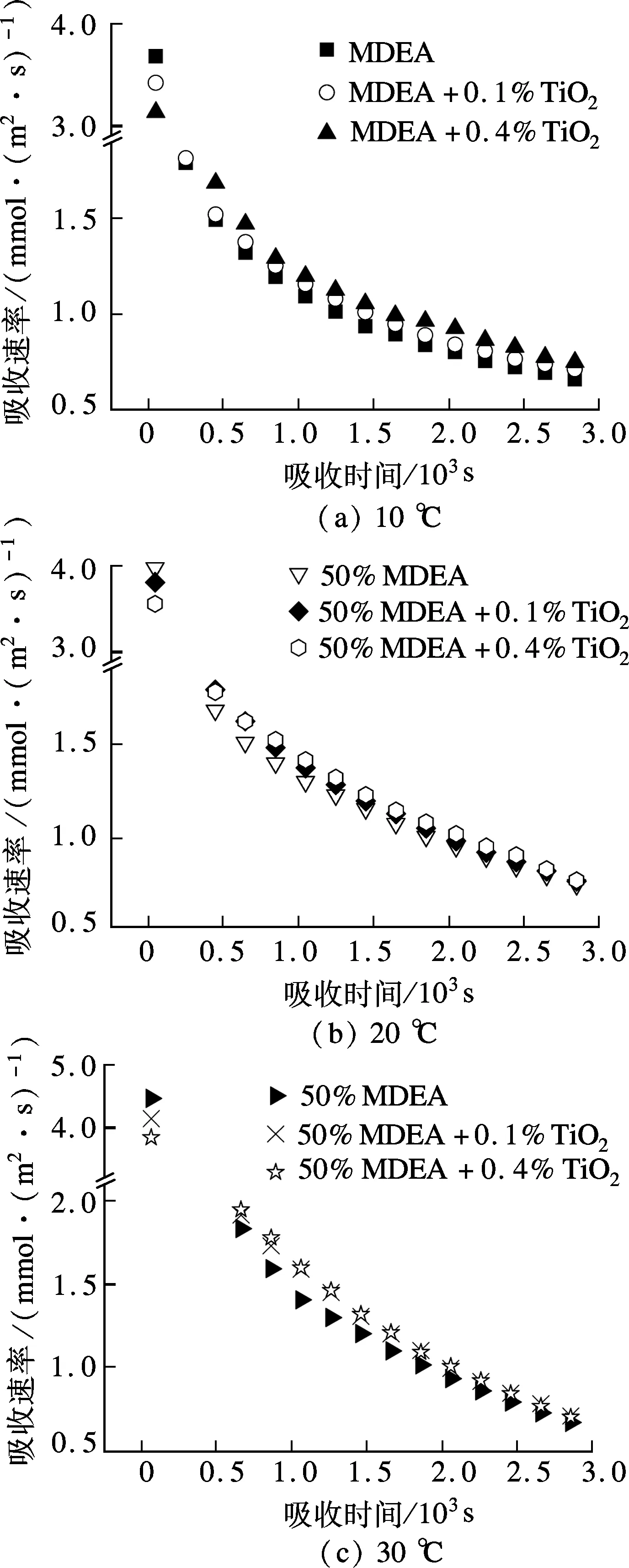
图3 前3000s溶液吸收CO2的吸收速率-时间关系
图4为实验中各溶液的表面张力值,由图可见,纳米颗粒的加入使得溶液表面张力增大,但纳米颗粒对溶液表面张力的影响很小(溶液未添加分散剂的情况下),这与文献[15]中的结论相同.
根据双膜理论,MDEA溶液吸收CO2过程属于液膜控制,其传质阻力主要存在于液相,Krishnamurthy等[16]根据实验结果认为,颗粒的布朗运动虽然不会直接对传质起强化作用,但是会造成流体的局部对流,这会使溶质在液相的扩散系数变大,从而使得溶质在气液相界面中的平衡浓度增大,增加了传质驱动力,使传质速率变大.随着温度的升高,颗粒的布朗运动越强,也使得不同纳米颗粒质量分数下强化效果的差别逐渐减小.
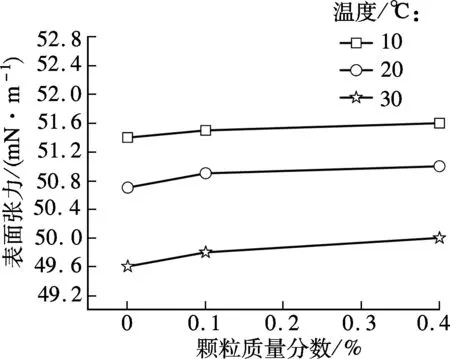
图4 温度和颗粒质量分数对溶液表面张力的影响
marangoni效应[17]指的是由于传热或者传质的不均匀性引发相界面上局部表面张力梯度变化,从而在相界面上引发一种流体力学不稳定现象,它可以对液体界面的流动产生强烈的影响,从而改变相界面处的热量与质量传递规律.在气-液体系中,物质的蒸发、溶解等都可能导致表面张力梯度的出现.在乙醇胺和二乙醇胺吸收CO2的过程中,Marangoni效应能强化传质速率[18].纳米颗粒布朗运动引起的局部对流会使得纳米颗粒附近的CO2传质速率变大,加剧了气液界面的传质不均匀性,从而增强Marangoni效应,强化传质速率.
唐忠利等[19]发现在纳米流体中,Marangoni效应的湍动强度和湍动范围比不加纳米颗粒的流体大.由于MDEA溶液与CO2的反应速率较慢,同时本实验中的溶液未加搅拌,仅由气液界面吸收CO2,使得溶液下部的MDEA不能有效地参与反应.Marangoni效应的增强和液体内部由纳米颗粒运动引起的微对流也加快了液体内部反应与未反应溶液之间的混合,使得反应更加充分,因而加纳米颗粒溶液的最终吸收量大于未加颗粒的吸收量.
3 结论
1) 在不扰动溶液的情况下,考察了温度和纳米颗粒质量分数对MDEA溶液界面吸收CO2特性的影响.MDEA溶液对CO2的吸收速率随着溶液温度的升高而增大,加入纳米颗粒后,溶液对CO2的吸收速率得到了强化,强化吸收的有效吸收比范围为1.03~1.14.
2) 纳米颗粒的加入使得溶液的表面张力增大,但增加量很小,最大增加约0.8%.
3) 当刚开始吸收时,未加纳米颗粒的溶液对CO2吸收速率要比加纳米颗粒的快,但是随着吸收的进行,纳米颗粒对溶液吸收CO2的强化效果逐渐显现出来.在10 ℃时,CO2的吸收速率随着颗粒质量分数的上升而增大,但是在20和30 ℃时,纳米颗粒质量分数为0.1%和0.4%的纳米流体对CO2吸收速率的差别逐渐减小.
)
[1] Rochelle G T. Amine scrubbing for CO2capture[J].Science, 2009,325(5948): 1652-1654.
[2] 薛全民, 周亚平, 苏伟. 甲基二乙醇胺水溶液吸收CO2的研究[J]. 化学工程, 2009, 37(9): 1-4.
Xue Quanmin, Zhou Yaping, Su Wei. Study on absorption of CO2into aqueousN-methyldiethanolamine[J].ChemicalEngineering(China), 2009,37(9): 1-4. (in Chinese)
[3] Jou F Y, Mather A E, Otto F D. Solubility of hydrogen sulfide and carbon dioxide in aqueous methyldiethanolamine solutions[J].Industrial&EngineeringChemistryProcessDesignandDevelopment, 1982,21(4): 539-544.
[4] 王渊涛, 方诚刚, 张锋, 等. 氨基酸离子液体-MDEA混合水溶液的CO2吸收性能[J]. 化工学报, 2009, 60(11): 2781-2786.
Wang Yuantao, Fang Chenggang, Zhang Feng, et al. Performance of CO2absorption in mixed aqueous solution of MDEA and amino acid ionic liquids[J].CIESCJournal, 2009,60(11): 2781-2786. (in Chinese)
[5] 成弘, 周明, 余国琮. 强化气液两相传质的研究进展[J]. 化学进展, 2001, 13(4): 315-322.
Cheng Hong, Zhou Ming, Yu Guocong. Recent development of enhancement of gas-liquid mass transfer[J].ProgressinChemistry, 2001,13(4): 315-322. (in Chinese)
[6] 卢素敏, 马友光, 沈树华, 等. 微细固体颗粒对CO2吸收速率的影响[J].高校化学工程学报, 2008, 22(2): 356-360.
Lu Sumin, Ma Youguang, Shen Shuhua, et al. Effect of fine solid particles on gas absorption rate of CO2[J].JournalofChemicalEngineeringofChineseUniversities, 2008,22(2): 356-360. (in Chinese)
[7] Lu Sumin, Ma Youguang, Zhu Chunying, et al. The enhancement of CO2chemical absorption by K2CO3aqueous solution in the presence of activated carbon particles[J].ChineseJournalofChemicalEngineering, 2007,15(6): 842-846.
[8] Choi S U S. Enhancing thermal conductivity of fluids with nanoparticles [C]//Proceedingsofthe1995ASMEInternationalMechanicalEngineeringCongressandExposition. San Francisco, CA, USA, 1995:99-105.
[9] Kim W, Kang H U, Jung K, et al. Synthesis of silica nanofluid and application to CO2absorption[J].SeparationScienceandTechnology, 2008,43(11/12): 3036-3055.
[10] Olle B, Bucak S, Holmes T C, et al. Enhancement of oxygen mass transfer using functionalized magnetic nanoparticles[J].Industrial&EngineeringChemistryResearch, 2006,45(12): 4355-4363.
[11] Pang Changwei, Wu Weidong, Sheng Wei, et al. Mass transfer enhancement by binary nanofluids (NH3/H2O+Ag nanoparticles) for bubble absorption process[J].InternationalJournalofRefrigeration, 2012,35(8): 2240-2247.
[12] Cadours R, Bouallou C, Gaunand A, et al. Kinetics of CO2desorption from highly concentrated and CO2-loaded methyldiethanolamine aqueous solution in the range 312-383 K[J].IndEngChemRes, 1997,36(12): 5384-5391.
[13] 艾宁, 陈健, 费维扬. MDEA+2,3-丁二酮水溶液对CO2吸收速率的测定[J]. 天然气化工, 2004, 29(3):10-12.
Ai Ning, Chen Jian, Fei Weiyang. Absorption rate measurement of CO2in MDEA+2, 3-butanedione aqueous solution[J].NaturalGasChemicalIndustry, 2004,29(3):10-12. (in Chinese)
[14] Pani F, Gaunand A, Cadours R, et al. Kinetics of absorption of CO2in concentrated aqueous methyldiethanolamine solution in the range 296 K to 343 K[J].JournalofChemicalandEngineeringData, 1997,42(2): 353-359.
[15] Das S K, Putra N, Roetzel W. Pool boiling characteristics of nanofluids[J].InternationalJournalofHeatandMassTransfer, 2003,46(5): 851-862.
[16] Krishnamurthy S, Bhattacharya P, Phelan P E, et al. Enhanced mass transport in nanofluids[J].NanoLetters, 2006,6(3): 419-423.
[17] Sears F W.Mechanics,wavemotionandheat[M]. Massachusetts, USA: Addison-Wesley, 1958.
[18] Buzek J. Some aspects of the mechanism of cellular convection[J].ChemicalEngineeringScience, 1983,38(1): 155-160.
[19] 唐忠利, 湛波, 张树杨, 等. CO2在纳米流体解吸过程中的微对流现象[J]. 化工学报, 2012, 63(6): 1691-1696.
Tang Zhongli, Zhan Bo, Zhang Shuyang, et al. Microconvection phenomena accompanying CO2desorption from nanofluids[J].CIESCJournal, 2012,63(6): 1691-1696. (in Chinese)
