高浓度CO2在MEA溶液中平衡溶解度的实验研究
2013-12-25谭雅倩张翠珍张四宗
谭雅倩,刘 洋,张翠珍,张四宗,张 辉
(北京科技大学机械工程学院,北京 100083)
我国沼气资源分布区域广,局部产能过剩,由于其中含有大量的CO2,无法实现高压储运及管网运输,不得不直接排空,造成能源浪费及环境污染。可再生清洁能源沼气中甲烷占55% ~70%[1],其余主要是CO2,为了提高沼气的热值,扩大沼气利用范围,需对沼气进行脱碳处理,近年来对沼气提纯已成为科研热点[2]。国内外现有的CO2的吸收方法有化学吸收法、物理吸附法[3]、分离法、低温分离法等[4-5]。其中,利用有机胺溶液对溶液进行吸收的化学吸收法是当前最适用的CO2脱除技术[6-7]。
平衡时的吸收负荷,衡量了吸收液吸收CO2的最大量,为对比各种吸收液的吸收性能提供了参考,同时,也为工程塔设备的设计提供了依据,是设计和研发新型吸收剂的重要参数。已有学者研究了CO2在 MDEA-PZ-H2O 溶液[8]和活化 MDEA 水溶液[9]中的溶解度,但对工业应用较广的MEA吸收剂的CO2溶解度因素影响的研究较少。MEA吸收剂具有反应活性高,溶剂成本低,分子质量小,热稳定性和热降解速率适中等优点,缺点则包括与CO2反应焓高,在高压下汽化损失大,腐蚀作用高[10]。为了增强MEA溶液对CO2的吸收,需了解各参数条件对其的影响,对生产过程中的工艺进行合理的配置。目前,Aroonwilas[11-12]等用微分法在填料塔中测出了NaOH、MEA、AMP等水溶液吸收CO2的体积总传质系数,也有部分学者对醇胺溶液的改性进行研究[13]。但这些研究基本都是针对低CO2浓度的化学吸收过程[14],对于高浓度CO2的研究尚鲜见报导。
因此,针对MEA溶液吸收CO2的影响因素较多的现象,本文采用正交试验设计,对MEA吸收CO2的各影响因素进行实验研究,改变反应温度、二氧化碳分压力和MEA质量浓度等条件,考察操作条件对CO2在MEA中的平衡溶解度的影响,并对数据进行分析,所得结论对CO2捕集工艺的开发和应用有重要参考价值。
1 实验部分
1.1 MEA与CO2实验机理
MEA吸收CO2的反应实质是弱酸与弱碱溶液的中和反应。MEA的分子结构中含有一个羟基和一个胺基,一般认为羟基能降低化合物的蒸汽压,并且加强其在水中的溶解,而胺基中则含有活泼的氢原子,在水中离解会使得溶液呈现碱性,提供了溶液的碱度[15]。
一般认为,MEA与CO2的反应包括两个过程,MEA首先与CO2生成两性离子,然后再进行脱质子反应。MEA水溶液与CO2的总反应如下:
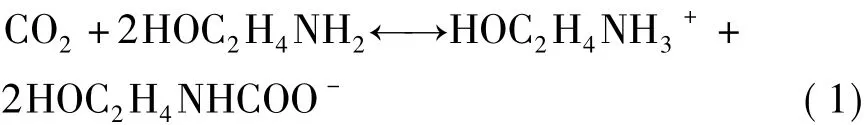
上述反应是可逆放热反应,在温度较低时,反应向正反应方向进行,放出热量,温度较高时,反应向逆反应方向进行,溶液再生。
其分步反应如下[16]:
第一步,CO2与MEA反应生成中间产物——两性离子:

第二步,两性离子与溶液中的物质发生去质子化反应。
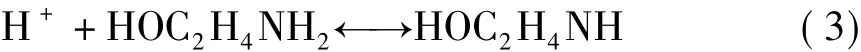
第一步反应是二级反应,平衡常数的数量级为10-5L/(mol·s),是速率控制步骤;第二步反应是瞬时反应,其平衡常数的数量级为1010L/(mol·s)。
1.2 实验装置
为测定醇胺溶液对CO2的吸收负荷的特点,设计了如图1所示的装置。实验采用搅拌反应器法,利用酸碱法和皂泡流量计分析CO2在醇胺溶液中的溶解度。气体吸收反应器为圆柱形密封筒体,反应器外包有加热套并与温控装置相连,温度传感器采用Pt100,液体控温精度±0.1℃。磁力搅拌装置可保证气、液相物质充分接触。电子天平测量精度为±0.001 g。实验使用分析纯MEA溶液和硫酸溶液,溶液的配制均采用去离子水。
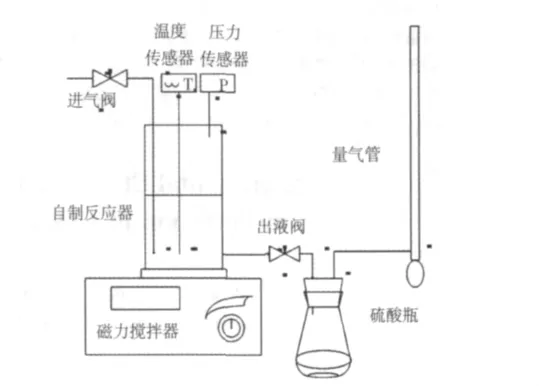
图1 实验装置示意图Fig.1 Schematic diagram of the experimental equipment
1.3 实验概述
在实验过程中,首先将配制好的溶液装入反应罐,关闭所有阀门,将温度控制到实验所需温度,记录此时的压力P0。其次,将高纯CO2通入反应罐,等待3~4 h,使反应罐中气液达到平衡,记录此时的反应罐压力P1。然后,测量硫酸瓶的质量,记作m0,打开出液阀放出2~3 g液体至硫酸瓶,关闭出液阀,同时用量气管测量释放出的CO2体积,记作V。最后,待硫酸瓶中反应不再进行,没有气体释放出来时,称量硫酸瓶的质量,记作m1。重复上述操作,直至得到所需压力范围内的数据为止。
实验对液样分析的方式采用酸解法。其原理是采用过量5N硫酸与液样反应,解吸出液样中的CO2,然后测定解吸出的全部CO2体积,推知已知质量的液样中CO2的含有量。为了使CO2完全解吸,用磁力搅拌器对盛有稀硫酸的硫酸瓶进行搅拌以减少误差。
从实验中得到反应时CO2分压力为P1-P0,取得的液样质量为m1-m0,由已知的初始溶液浓度和所测得的 CO2体积 V,得到溶液中用(mol CO2/mol醇胺)所表示的溶解度。
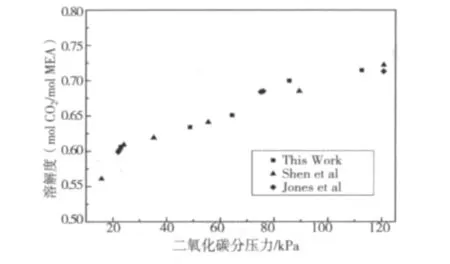
图2 15.3%(W/W)MEA溶解度曲线Fig.2 The solubility curve of 15.3%(W/W)MEA
为检验实验装置的可靠性,特测定了15.3%(W/W)MEA水溶液在40℃时的溶解度数据,并与文献[12]中的做了比较,其结果如图2所示。对实验得到的数据进行拟合,得到ln(P)与溶解度a的关系式:
式(4)中P是CO2分压,a是(mol CO2/mol MEA)形式下的溶解度。从图2中通过比较发现数据与文献[17]当中的数据能够较好吻合,说明本文的实验装置所测得的实验数据是可信的。
2 实验结果与分析
影响MEA中CO2平衡溶解度的因素较多,本文结合实验现有条件以及前人已做的研究,主要研究温度、CO2分压力和MEA溶液质量浓度三个因素对实验指标的影响,实验采用L9(34)正交表,正交实验的表头设计以及实验结果如表1。
2.1 实验结果直观分析
从表1结果可知,因素 B的极差为0.125,最大,C次之,A最小。为了更加直观地了解三因素对MEA中CO2溶解度的影响,找出实验范围内的最优搭配,画出因素趋势图如图3所示。
从图3可知,实验所测三因素中,B因素的改变对实验结果的改变最大,C、A次之,与极差分析中所得结果一致,即CO2的分压力对MEA溶液中二氧化碳的平衡溶解度影响最大,其次为MEA溶液的质量浓度,最后为实验的反应温度。从图中可得在实验范围内因素的最优组合为A1B3C1。
2.2 实验结果方差分析
对L9(34)正交实验结果进行方差分析和显著性检验,计算结果如表2。
由表2可知,由于 FB和 FC大于 F0.05(2,2)=19,FA大于 F0.10(2,2)=9,因此因子 B 与 C 在显著性水平0.05上是显著的,而A是在显著性水平0.1上是显著的因素,因素B、C影响较为显著,因素A次之,在吸收二氧化碳的工艺研究中应该作为重要因素考虑。根据计算所得F值,确定影响二氧化碳在MEA溶液中的平衡溶解度的因素显著性顺序为:B>C>A。方差分析的结果与直观分析一致,从显著性水平更进一步得出,二氧化碳分压力、MEA溶液浓度和反应温度对CO2的平衡溶解度的影响均较显著,在工程应用中不能忽略。
图3 因素A B C趋势图Fig.3 Tendency of factors A B C

表2 因素A B C方差分析表Table 2 Variance analysis of the data of factor A B C
2.3 实验因素对MEA中CO2溶解度的影响
从上述正交实验分析可知,CO2分压力、温度和MEA质量浓度对CO2的溶解度都有影响。为进一步确定各因素对其的影响规律,实验测定了在一定MEA浓度下,二氧化碳分压力在0~150 kPa内变化,温度分别为303 K、313 K、323 K、353 K 时,CO2在MEA溶液中的溶解度变化,实验中选取的MEA溶液质量浓度为10%、20%、30%。其结果分别如图4、5、6 所示。
从图4可以看出,CO2在MEA水溶液中的溶解度随二氧化碳分压的增大而增大。MEA溶液吸收CO2过程存在两个热力学平衡,一个为气液溶解解吸平衡,是物理的溶解过程,另一个是化学反应平衡。当CO2分压增加时,浓度梯度将增大,传质推动力增大,两个平衡过程都将向正反应方向移动,进入液相MEA溶液中的CO2增大,溶解度增大。同时化学反应的存在降低了溶液中CO2的含量,促使物理溶解平衡向右移动。因此,气相分压的提高,进入液相主体MEA溶液中的CO2的量增大,CO2在溶液中的平衡溶解度也增大。
由图4~6可知,在不同的质量浓度下,CO2的平衡溶解度的变化趋势基本相同,比较三个图形可知,在实验所选择的MEA质量浓度范围内,CO2在MEA溶液中的溶解度随其质量浓度的增大而降低。理论上,由于吸收液中MEA的浓度增大,吸收CO2速率必然提高,进入液相后CO2迅速被吸收,使气液界面与液相主体间的传质推动力增强,从而使更多的CO2被吸收;但是,另一方面,MEA浓度的增加会使得吸收液的粘度提高,降低了湍流强度,对气液间的传质作用有削弱效果,降低CO2的溶解度。图4的CO2溶解度变化曲线表明,在本组测试的MEA质量浓度范围内,溶液中MEA浓度的增加对液体粘度的增大作用比对反应速率的提高作用明显,因此总体的变化趋势表现为溶解度随溶液浓度的提高而降低。所以,在进行CO2脱除工艺设计时,应注意并非吸收液的浓度越大越好,设计时应选择最佳吸收液浓度。
温度是实验所研究的三因素中对CO2平衡溶解度影响相对较小的因素,F值为16.229,但其对溶解度的影响不能忽略。对于吸收CO2的工业应用来说,反应温度是反应吸收剂能耗的一个比较直观的参数。为了研究不同温度下MEA吸收液的吸收能力,分别设计了在313 K、323 K和353 K温度下进行的吸收实验,实验结果曲线如图4~6所示。
从图可知,在实验所研究的温度段,CO2在MEA溶液中的溶解度随温度的升高而降低。由于MEA溶液吸收CO2的方式是放热反应,当温度升高时,正逆反应速率均增大,但是逆反应速度的增大明显超过生成盐的正反应,足以使反应偏向逆反应的方向进行,使得CO2的溶解度减小。在实验的低温段,溶解度改变比高温段小,是因为温度改变使得正逆反应速率的改变不能使溶解度特性表现出很显著的变化。所以,在设计脱碳工艺的时候,也应考虑解吸温度。
3 结论
本文考察温度、CO2分压力、MEA溶液质量浓度三因素对MEA吸收CO2能力的影响,丰富了有机醇胺溶液的物性数据。在考察的参数范围内,得出以下结论:
1.CO2分压力、温度和MEA质量浓度对MEA中CO2平衡溶解度都有影响,其大小顺序为:CO2分压力>MEA质量浓度>温度。
2.MEA溶液中CO2的溶解度随压力的增大而增大,随MEA质量浓度的增大而减小,随温度的增大而减小。
符号说明:
Ti——各列在i水平下的实验结果总和
ti——各列在i水平下的实验结果平均值
R——各列的极差
Sj——正交实验表数据列偏差平方和
MSj——正交实验表数据列方差
f——正交实验表的列自由度
F——实验数据F统计量
Fα——在显著性水平α下F统计量的临界值
[1]李东,袁振宏,孙永明,等.中国沼气资源现状及应用前景[J].现代化工,2009,29(4):1-4.
[2]江皓,吴全贵,周红军.沼气净化提纯制生物甲烷技术与应用[J].中国沼气,2012,30(2):6-19.
[3]张辉,刘应书,刘文海,等.烟气中低浓度二氧化碳吸附捕集中试试验研究[J].低温与特气,2009,27(1):9-13.
[4]周丽艳,晋梅,蔡素芝,黄璐.MDEA溶液吸收烟气中CO2的实验研究[J].江汉大学学报(自然科学版),2012,40(6):34-37.
[5]李兰廷,解强.温室气体CO2的分离技术[J].低温与特气,2005,23(4):1-6.
[6]韩永嘉,王树立,张鹏宇,朴文英.CO2分离捕集技术的现状与进展[J].天然气工业,2009,29(12):79-82.
[7]黄绍兰,童华,王京刚,戎丽.CO2捕集回收技术研究[J].环境污染与防治,2008,30(12):77-82
[8]刘华兵,吴勇强,张成芳.MDEA-PZ-H2O溶液中CO2溶解度及其模型[J].华东理工大学学报,2000,26(2):121-125.
[9]刘华兵,徐国文,张成芳,吴勇强.活化MDEA水溶液中二氧化碳溶解度[J].华东理工大学学报,1999,25(3):242-246.
[10]司南.乙醇胺(MEA)溶液吸收CO2的试验研究[D].哈尔滨工业大学:能源科学与工程学院,2009.
[11]AROONWILASA,VEAWAB A,TONTIWACHWUTHIKUL P.Behavior of the mass transfer coefficient of structured packings in CO2absorbers with chemical reactions[J].Ind Eng Chem Res,1999,38(5):2044-2050.
[12]AROONWILAS A,TONTIWACHWUTHIKUL P.Mass transfer coefficients and correlation for CO2absorption into 2-amino-2-methyl-1-propanol(AMP)using structured packing[J].Ind Eng Chem Res,1998,37(2):569-575.
[13]杜敏,张力,FENG Bo.己二酸对MEA吸收-解析 CO2过程的影响[J].化工学报,2011,62(2):450-454.
[14]骆培成,焦真,张志炳.填料塔中碳酸钾/哌嗪混合吸收液脱除CO2的体积传质系数[J].化工学报,2005,56(1):53-56.
[15]张亚萍,江金正,季芹芹,罗红情.混合醇胺溶液吸收烟气中 CO2[J].化工生产与技术,2012,19(1):22-24.
[16]陆诗建,李清方,张建,等.醇胺溶液吸收二氧化碳方法及反应原理概述[J].科技创新导报,2009(13):4-5,7.
[17]SHEN KehPeng,LI Meng-Hui.Solubility of Carbon Dioxide in Aqueous Mixtures of Monoethanolamine with Methyldiethanolamine[J].J Chem Eng Data,1992,37,100-104.
