简单快速的多糖植物双生病毒核酸提取方法
2013-12-23郭灵芳张长青鲁红学孙正祥章松柏张友军吴祖建
郭灵芳,张长青,鲁红学,孙正祥,章松柏,张友军,吴祖建
(1.长江大学工程技术学院,湖北荆州 434020;2.长江大学农学院,湖北荆州 434025;3.福建农林大学植物病毒研究所,福建福州 350002;4.中国农业科学院蔬菜花卉研究所,北京 100081)
1 双生病毒
双生病毒(geminiviruse)是植物病毒中唯一的一类具有孪生颗粒形态的单链环状DNA 病毒,病毒粒子的大小约为18nm×30nm,无包膜,基因组为单组分或双组分结构,大小为2.5~3.0kb,通常由昆虫介体以持久性方式传播,大多侵染寄主植物的韧皮部组织[1-3]。双生病毒一般发生在热带、亚热带地区,温带地区也偶有发生。20世纪90年代后该病毒在世界范围内大面积爆发,并在多种重要作物上引起严重危害,其中番茄、木薯、棉花和烟草是遭受双生病毒危害最严重的作物,给种植者造成巨大经济损失[4]。20世纪90年代以前,双生病毒引起的病害在我国发生范围小、危害不大。但90年代以后,广西、云南等地相继发现烟草、番茄、南瓜和番木瓜等作物遭受双生病毒危害,并且发生范围逐年扩大,危害程度日益加深,如:广西的番木瓜和番茄发病普遍,发病严重地区病株率高达30%~50%[5-8];2006年上海和浙江先后发现双生病毒危害番茄后,该病害在华东地区迅速蔓延开来,造成严重危害[9]。
随着双生病毒危害的加重,快速检测和鉴定病原十分必要。目前应用于双生病毒的检测手段主要有血清学方法、核酸杂交、聚合酶链式反应(PCR)、RCA(rolling circle amplifieation)等方法。尽管已经得到了一些双生病毒的多克隆抗体或单克隆抗体,但由于双生病毒血清关系有远有近,限制了血清学方法的应用[10]。核酸杂交、PCR、RCA 3种方法都基于双生病毒基因组核酸的方法,比较特异和灵敏,广泛应用于双生病毒的检测和鉴定。双生病毒基因组核酸的提取质量对检测结果影响很大,特别是从富含多糖、多酚、单宁、色素及其他次生代谢物质的植物中提取的双生病毒基因组核酸。从这些植物中分离出的DNA 由于多酚被氧化成棕褐色,多糖、单宁等物质与DNA 会结合成黏稠的胶状物,获得的DNA 常出现产量低、质量差、易降解等问题,影响DNA 质量和纯度,不能被限制性内切酶酶切,严重的甚至不能作为模板进行PCR 扩增[11-13]。此外,双生病毒基因组是单链环状的DNA,在大小和性质上都与寄主基因组DNA 不同,完全用植物基因组DNA 的提取方法提取双生病毒基因组,可能会对其产率有一定的影响。基于此,在传统双生病毒基因核酸提取方法的基础上,结合总DNA 提取的CTAB 法和质粒提取的离心柱方法,探索一种简单快速的多糖多酚植物双生病毒基因组核酸的提取方法。
2 材料与方法
2.1 材料
植物样品:朱槿曲叶病病株和朱槿健株,病株和健株叶片采集于福建省福州市郊区,经过鉴定(病毒为Cotton leaf curl Multan virus)后保存于-70 ℃超低温冰箱中备用。
2.2 CTAB法提取植物的总DNA
取约0.1g朱槿叶片(病株叶片3 份,即3 次重复),在液氮中研磨成粉末,加入700μL、65 ℃预热的2×CTAB提取缓冲液,温和混匀;65 ℃保温30~60 min,期间不时摇动,使其充分混匀;用等体积的24∶1氯仿/异戊醇抽提匀浆液,颠倒使充分混合,于室温下10 000r/min离心10min,回收水(上)相;用等体积的氯仿/异戊醇抽提,颠倒混匀,离心,回收上层水相;取上清,加入等体积的异丙醇,混匀,-20 ℃放置20min后12 000r/min离心10min以沉淀DNA;弃掉上清,加入适量的75%乙醇清洗、沉淀一次,随后12 000 r/min离心10min;弃掉上清液,干燥后加入50μL 的TE溶液以溶解DNA,-20 ℃贮存备用。
2.3 离心柱法提取植物的总DNA
选用特别适用于多酚、多糖含量高的植物组织的植物总DNA 提取试剂盒DP305-02(北京天根生化科技有限公司),具体操作见说明书,朱槿叶片取0.1g(健株叶片1份、病株叶片3份,即3次重复),最后用50μL TE溶液溶解DNA,-20 ℃贮存备用。
2.4 改进后的植物总DNA提取方法
取约0.1g 朱槿叶片(病株叶片3 份即3 次重复),在液氮中研磨成粉末,加入700μL、65 ℃预热的2×CTAB提取缓冲液,温和混匀;65 ℃保温30min,期间不时摇动,使其充分混匀;用等体积的24∶1 氯仿/异戊醇抽提匀浆液,颠倒使充分混合,于室温10 000r/min离心10min,回收水(上)相;加入0.7倍体积的A 溶液(4~5 mol/L 盐酸胍,0.75 mol/L KAc,pH=4.2~4.6),混匀;将混匀后的溶液加入离心柱(质粒小提试剂盒DP103,北京天根生化科技有限公司)中,后面步骤参照质粒小提试剂盒说明书;最后用50μL TE溶液溶解DNA,-20 ℃贮存备用。
2.5 PCR 检测和灵敏性分析
以上述3种方法提取的植物总DNA 为模板,进行PCR 检测,引物引用谢艳等根据双生病毒共同区及外壳蛋白基因保守序列设计的简并引物PA 和PB,扩增片段大小为500bp。
PCR 检测:PCR 反应体系按照TaKaRa的rTaq酶使用说明进行,反应程序为:94 ℃变性4min,35个循环的扩增(94 ℃30s,52 ℃20s,72 ℃30min),最后72 ℃延伸10min,8 ℃保存20h。
灵敏性分析:取2.4节中获取的DNA 4μL,进行1、10、100、1 000、10 000 倍稀释,然后按上述的PCR程序进行实验,以检测改进后的植物总DNA 提取方法的灵敏性。产物经1%琼脂糖凝胶电泳,EB 染色后BioRad凝胶成像系统观察记录。
2.6 Real Time PCR 反应
根据实验室已测定的木尔坦棉花曲叶病毒DNAA 组分设计荧光定量引物,筛选得到扩增效率高、反应特异性强的一对引物 DLF/DLR(5′-CTGCCGAAGTTCAGACGCC-3′ 和 5′-CAGGATTATTCACCGGATACCCTA-3′),扩增片段大小为147 bp。上述3种方法提取的DNA 各取2μL,稀释100倍后使用。根据SYBR Premix Ex TaqTMII(TaKaRa Code:DRR081)试剂盒操作说明配制反应液。用离心机快速离心含有反应液的PCR 反应管后,放入Eppendorf Realplex System 中,然后运行程序,采用两步法进行Real Time PCR 反应。反应条件如下:预变性,95 ℃30s,95 ℃5s,60 ℃30s,40个循环。为了建立PCR 产物的熔解曲线,扩增反应结束后继续从60 ℃缓慢加热到95℃(每2s升高0.2 ℃)。
3 结果与分析
3.1 PCR 检测结果
以上述3种方法提取的植物总DNA 为模板,进行PCR 检测,引物引用谢艳等[7]设计的通用简并引物PA 和PB,结果如图1(a),均能扩增到预期的500bp大小的片段。说明3种方法均有效地抽提到双生病毒的基因组核酸,改进的方法和另外两种方法一样可以应用。为了验证改进方法的灵敏性,以改进后的方法提取的植物总DNA 为模板,依次稀释1、10、100、1 000、10 000后进行PCR 扩增,扩增结果如图1(b),在PCR 反应程序为35 个循环的条件下,模板稀释1 000倍的情况下依然可以得到预期的片段,显示改进的方法有较高的灵敏度。
图1中M 为DNA 标记。图1(a)中:1为阳性对照;2为阴性对照;3—5 为以CTAB 法提取植物的总DNA为模板进行的PCR扩增;6—8为以离心柱法提取植物的总DNA为模板进行的PCR扩增,9—11为改进后的方法提取的植物总DNA为模板进行的PCR扩增。图1(b)中:1-5为以改进后的方法提取的植物总DNA为模板,依次稀释1、10、100、、10 000后进行的PCR扩增。
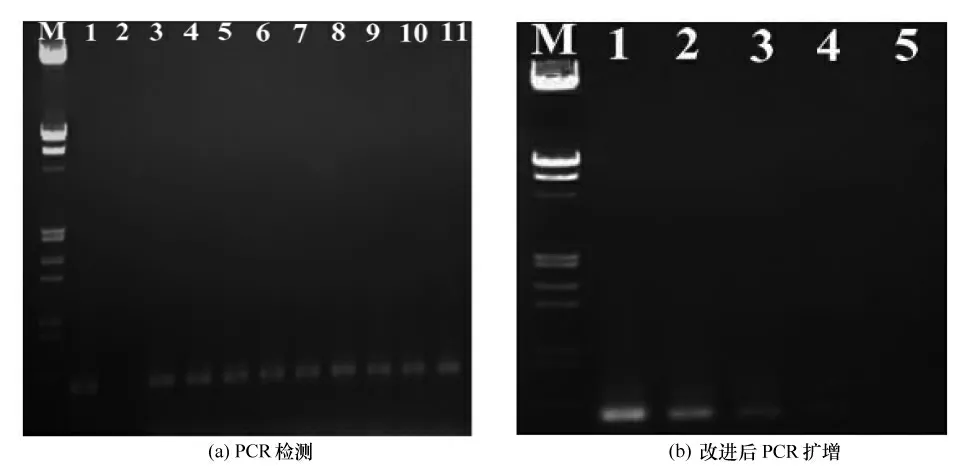
图1 PCR 检测
3.2 Real Time PCR 反应结果
灵敏度分析只能定性地说明改进后的方法可行,有较高的灵敏度,但无法比较3种方法的优劣。为了比较3种方法提取双生病毒基因组核酸的效率,采用荧光定量PCR 的方法进行分析,结果见图2。从图2中可知,对于双生病毒基因组产率来说,3 种方法中CTAB法效率最低,离心柱法次之,改进方法最高。时间和价格比较见表1。从表1的数据来看,改进后的方法在价格和时间上也有一定优势。
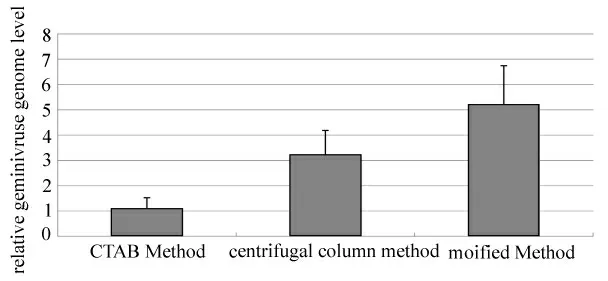
图2 3种方法提取双生病毒基因组核酸的效率比较

表1 3种方法提取双生病毒基因组核酸的比较
4 讨论
一些植物,如番茄、朱槿等,都富含多糖物质,从富含多糖、多酚、单宁、色素及其他次生代谢物质的植物中提取总DNA 的方法难度相对大于大多数的禾谷类及蔬菜类植物。从富含多糖的植物中提取DNA 时,由于多糖、单宁等物质与DNA 会结合成黏稠的胶状物,不易分离,常导致总DNA 产量低、质量差、易降解等问题,影响了DNA 质量和纯度,严重的甚至不能作为模板进行PCR 扩增。因此,一旦处理不好,对实验检测或鉴定结果影响较大。传统的CTAB 法提取总DNA 时,为了获得更多的病毒基因组,多采用增加实验材料,先大量抽提、随后浓缩的方法[14],这样对仪器和实验时间的要求必然增加。植物总DNA 提取的离心柱法提取总DNA 的效果较好,但是处理每个样品的价格较贵(7 元/样品),因而每个样品质量受限制(小于0.1g),最后得到的双生病毒基因组量也有限。此外,植物总DNA 提取的离心柱法主要针对寄主的染色体DNA,而双生病毒基因组是单链环状的DNA,在大小和性质上都与寄主基因组DNA 有一定的差异,跟双链环状的质粒更接近,所以用该方法提取双生病毒基因组可能会对其产率有一定的影响。考虑到以上两个方面的因素,在传统双生病毒基因核酸提取方法的基础上,结合总DNA 提取的CTAB 法和质粒提取的离心柱方法,发展了简单快速的多糖植物双生病毒基因组核酸的提取方法。从所得的数据来看,改进后的方法无论在灵敏度、时间、价格和产率上都具有一定的优势,说明更适合于双生病毒基因组核酸的提取和应用。
(
)
[1]Goodman R M.Single-stranded DNA genome in a whitefly-transmitted plant virus[J].Virology,1977,83:171-179.
[2]Rock K R,Guthrie R J,Woods R D.Purification of maize streak virus and its relationship to streak diseases of sugar cane and Panicum maximum[J].Ann Appl Biol,1994,77:289-296.
[3]洪健,李德葆,周雪平.植物病毒分类图谱[M].北京:科学出版社,2001:28-38.
[4]Boulton M I.Geminiviurses:Major threats to world agriculutre[J].Ann Appl Biol,2003:142(4):143.
[5]张颖,殷勤燕,刘玉乐,等.中国烟草曲叶病毒广西株的初步研究[J].中国病毒学,2000,15(4):405-408.
[6]Zhou X P,Xie Y,Zhang Z K.Molecular characterization of a distinct begomovirus infecting tobacco in Yunnan,China[J].Archives of Virology,2001,146(9):1599-1606.
[7]Xie Y,Zhou X P.Molecular characterization of squash leaf curl Yunnan virus,a new begomovirus and evidence for recombination[J].Archives of Virology,2003,148(10):2047-2054.
[8]Li Z H,Zhou X P,Zhang X,et al.Molecular characterization of tomato-infecting begomoviruses in Yunnan,China[J].Archives of Virology,2004.149(9):1721-1732.
[9]Wu J B,Dai E M,Zhou X P.First Report of Tomato yellow leaf curl virus in China[J].Plant Disease,2006,90(10):1359.
[10]杨彩霞.福建省六种双生病毒的分子鉴定及RaMoV NSP互作蛋白的筛选[D].福州:福建农林大学,2009.
[11]易庆平,罗正荣,张青林.植物总基因组DNA 提取纯化方法综述[J].安徽农业科学,2007,35(25):7789-7791.
[12]魏胜华,孟娜.改良CTAB法提取大戟属药用植物叶片总DNA 试验[J].湖北农业科学,2011,50(16):3148-3150.
[13]黄萱,高丽美,张永彦,等.一种优化的植物总DNA 提取方法[J].西北植物学报,2004,24(6):1103-1106.
[14]李静.我国六种双生病毒的分子鉴定及两种病毒的致病性研究[D].杭州:浙江大学,2010.
