合浦珠母贝基质蛋白KRMP-3对二价金属离子选择性的研究
2013-12-23苏境坦谢莉萍张荣庆
吴 晨, 苏境坦, 梁 健, 梁 晓, 谢莉萍, 张荣庆
(清华大学 生命科学学院, 北京 100084)
合浦珠母贝(Pinctada fucata)的贝壳分为角质层、棱柱层和珍珠层[1], 是典型的生物矿化产物。虽然棱柱层和珍珠层的组成成分都以碳酸钙为主(大于95%), 不同的是, 棱柱层中的碳酸钙晶体为方解石, 而珍珠层中则主要是文石。这种构成上的差异主要是由于贝壳中不同矿化蛋白所致。虽然基质蛋白只占钙化层总重量的5%, 但其对生物矿化却起到非常重要的作用。
基质蛋白按其去矿化溶液中的溶解性来分, 可分为可溶性基质蛋白(soluble matrix protein)和不可溶性基质蛋白(insoluble matrix protein), 按其等电点来分又可分为极酸性基质蛋白(等电点小于4.5), 中度酸性基质蛋白(等电点为4.5~7)和碱性基质蛋白(等电点大于7)[2]。已知的合浦珠母贝基质蛋白多为酸性的(Nacrein, Prismalin-14, MSI7等), 碱性基质蛋白知之甚少。
KRMP-3基因是从合浦珠母贝外套膜组织中克隆得到的[3], 免疫荧光实验表明, KRMP-3蛋白分布于棱柱层中。体外碳酸钙结晶实验结果表明, 其能使文石体系结晶出的碳酸钙晶貌发生改变, 同时出现了少量的方解石小颗粒, 故推测其很可能诱导棱柱层中方解石的形成[6]。
本实验拟在此研究基础上, 探究KRMP-3基质蛋白诱导方解石形成的机制, 利用圆二色谱和荧光光谱的方法, 探究KRMP-3基质蛋白对不同二价离子的选择性, 从而初步解释其能够参与生物矿化的原因。圆二色谱是研究蛋白二级结构的常用手段[4]。荧光淬灭法也是研究生物大分子与外界离子相互作用的常用方法之一[5], 通过荧光淬灭法计算出离子与蛋白的结合常数K以及结合位点数n, 据此分析蛋白与离子结合能力的强弱, 从而探究基质蛋白在矿化过程中可能起到的作用。
1 材料与方法
1.1 基质蛋白KRMP-3的表达与纯化
利用大肠杆菌BL21表达含有GST标签的KRMP-3蛋白[6]。其中KRMP-3基因是张岑于2006年从合浦珠母贝外套膜组织中克隆得到的, 表达载体为pGEX-4T-1(Novagen), 培养基采用含有氨苄(100 mg/L)的LB培养基, IPTG浓度为1mmol/L, 诱导温度为16°C, 诱导时间为30 h。重组蛋白的纯化按GST Gene Fusion System Handbook(Amersham Bioscience)中的方法进行操作, 采用GSTrapTMFF (GE Healthcare)柱进行分离纯化, 其中上样buffer为50 mmol/L Tris-HCl, 200 mmol/LNaCl, pH 8.0, 洗脱buffer为50 mmol/L Tris-HCL(pH 8.0), 并在其中加入10 mmol/L还原性谷胱甘肽(GSH), 脱盐buffer为10 mmol/LTris-HCl(pH 8.0), 蛋白的分离纯化均用AKATA完成。最后利用试剂盒BCA Protein Assay Kit(Pierce)测量蛋白浓度。
1.2 圆二色谱实验方法
利用Jasco J-715型圆二色谱仪[7]研究钙, 镁离子对基质蛋白KRMP-3二级结构的影响。将200 μL含GST标签的KRMP蛋白加入到1 mmol/L比色皿中, 通过圆二色谱仪测其Cd值。之后, 分别加入1 mol/L的CaCl2溶液0.2 μL(钙离子终浓度为1 mmol/L), 1 mol/L的CaCl2溶液2.0 μL(钙离子终浓度为10 mmol/L), 1 mol/L的MgCl2溶液0.2 μL(镁离子终浓度为1 mmol/L), 1 mol/L的MgCl2溶液2.0 μL (镁离子终浓度为10 mmol/L), 通过圆二色谱仪分别得到其圆二色谱, 通过比较来分析其二级结构的变化。其中J-715型圆二色谱工作参数为: 波长范围190~250 nm(有效波长200~250 nm), 25°C, 比色皿光径1 mm, 分辨率0.2 nm, 扫描速率100 nm/min, 扫描3次取平均值。
1.3 荧光淬灭法
用F-4500 FL Spectrophotometer 研究不同浓度, 不同二价金属离子对KRMP-3的影响, 根据其荧光淬灭程度分析KRMP-3的离子选择性。将200 μL含GST标签的KRMP蛋白加入到荧光杯中, 测其荧光强度, 之后在蛋白中加入1 mol/LCaCl2溶液, 每次加0.2 μL, 共加6次, 并逐一测其荧光强度, 即可分别得到含不同浓度钙离子(1~6 mmol/L)的KRMP-3的荧光光谱。同样方法, 将氯化钙溶液换成氯化镁, 氯化锶, 氯化钡, 即可得到含不同浓度镁, 锶, 钡的KRMP-3的荧光光谱。其中F-4500 FL Spectrophotometer的工作参数为: 波长扫描荧光发射谱, 激发波长为280 nm, 扫描范围300~400 nm, 扫描速率 1 200 nm/min, 激发狭缝和发射狭缝宽度为10 nm, 电压400 V, 反应时间2.0 s。
2 结果与分析
2.1 基质蛋白KRMP-3的表达结果
用表达纯化获得的重组蛋白进行SDS电泳, 在36 kD处可以看到一条清晰的电泳条带(图1)。由于KRMP-3的预测分子质量为9.8 kD, GST标签约为26 kD, 故目标蛋白带GST标签的KRMP-3分子质量约为36 kD, 即图中箭头所指位置。应用BCA法测得蛋白浓度约为0.47 g/L。
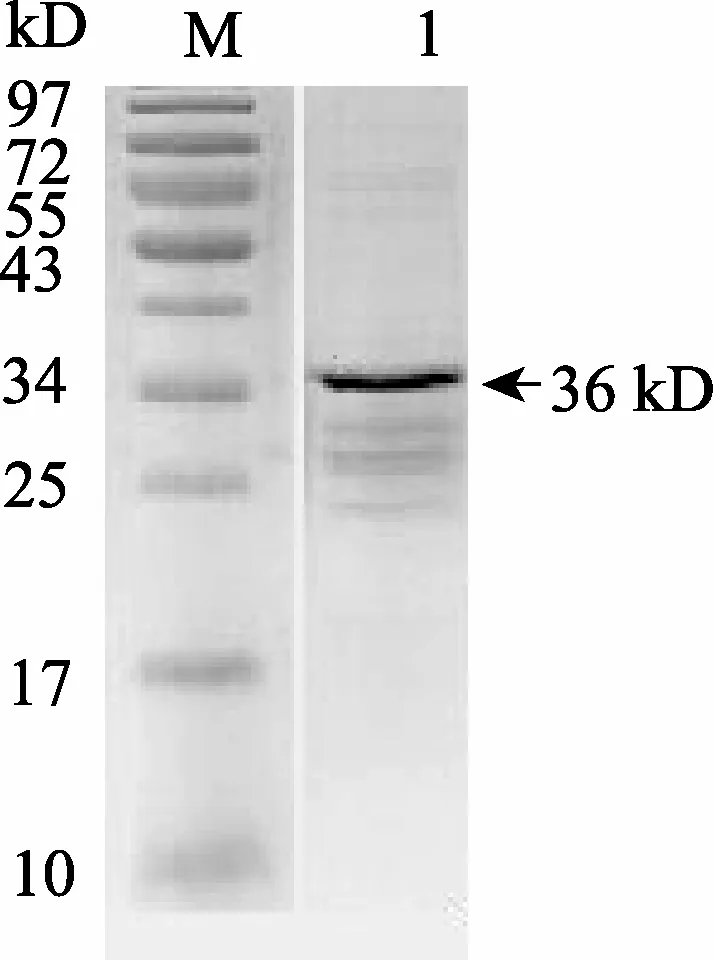
图1 用大肠杆菌表达含GST标签的KRMP-3蛋白的SDS-PAGE电泳图 Fig. 1 SDS-PAGE of KRMP-3 protein with GST expressed by E.coli M.marke
2.2 钙, 镁离子对基质蛋白KRMP-3二级结构的影响
已有实验结果显示[6], 在文石结晶体系(含钙, 镁离子)中加入高浓度KRMP-3蛋白时, 会产生少量的方解石。为了确认哪种离子起到主要作用, 本实验利用圆二色谱来研究其与KRMP-3相互作用的情况, 并采用GST蛋白(0.34 g/L)作为空白对照。图2中显示的是在KRMP-3蛋白及GST蛋白溶液中分别加入1 mmol/L钙离子和10 mmol/L钙离子时的圆二色谱图。由图中可以看到, 当加入钙离子之后, 蛋白质的CD值发生了明显的变化, 尤其当加入高浓度钙离子时, 蛋白质的CD值变化也极为明显。圆二色谱图可以反映蛋白的二级结构, CD值变化大说明其二级结构改变较大。从KRMP-3的圆二色谱图的变化可以看到, 钙离子的加入明显影响了KRMP-3的二级结构, 表明钙离子与KRMP-3蛋白很可能发生相互作用。相反, 镁离子对KRMP-3蛋白的圆二色谱图却没有影响(图3)。从对照组可以看到, 无论加入钙离子还是镁离子, 其对GST蛋白的圆二色谱图都基本没有改变。由此可以说明, 钙离子可能同KRMP-3蛋白发生相互作用, 从而改变其二级结构。
2.3 荧光淬灭法研究KRMP-3蛋白的离子选择性
圆二色谱实验显示了KRMP-3蛋白对钙离子具有结合能力, 为了进一步确认其对钙离子是不是具有选择性, 本文另外选取了与钙同族的镁, 锶, 钡等 二价金属离子作为淬灭剂, 利用荧光淬灭法研究KRMP-3蛋白对离子的选择性。
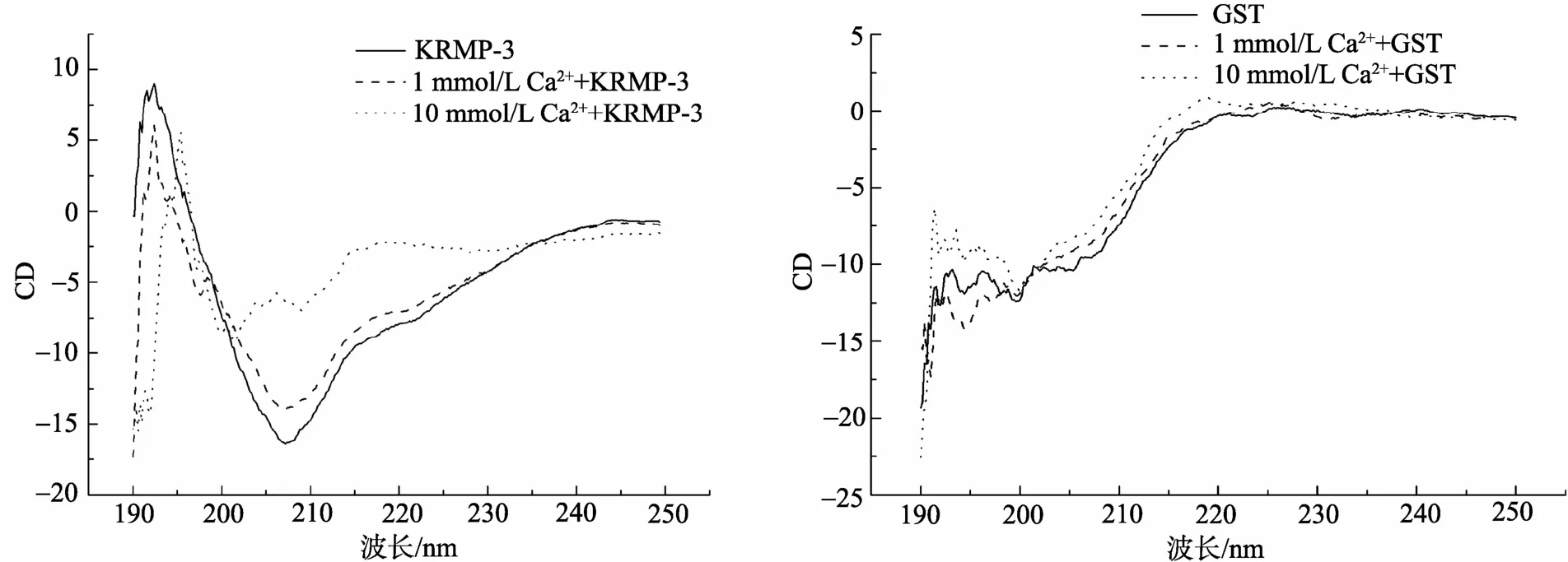
图2 不同浓度钙离子对KRMP-3蛋白及GST二级结构的影响 Fig. 2 Effect of different concentrations of Ca ion on the secondary structure of KRMP-3 protein and GST
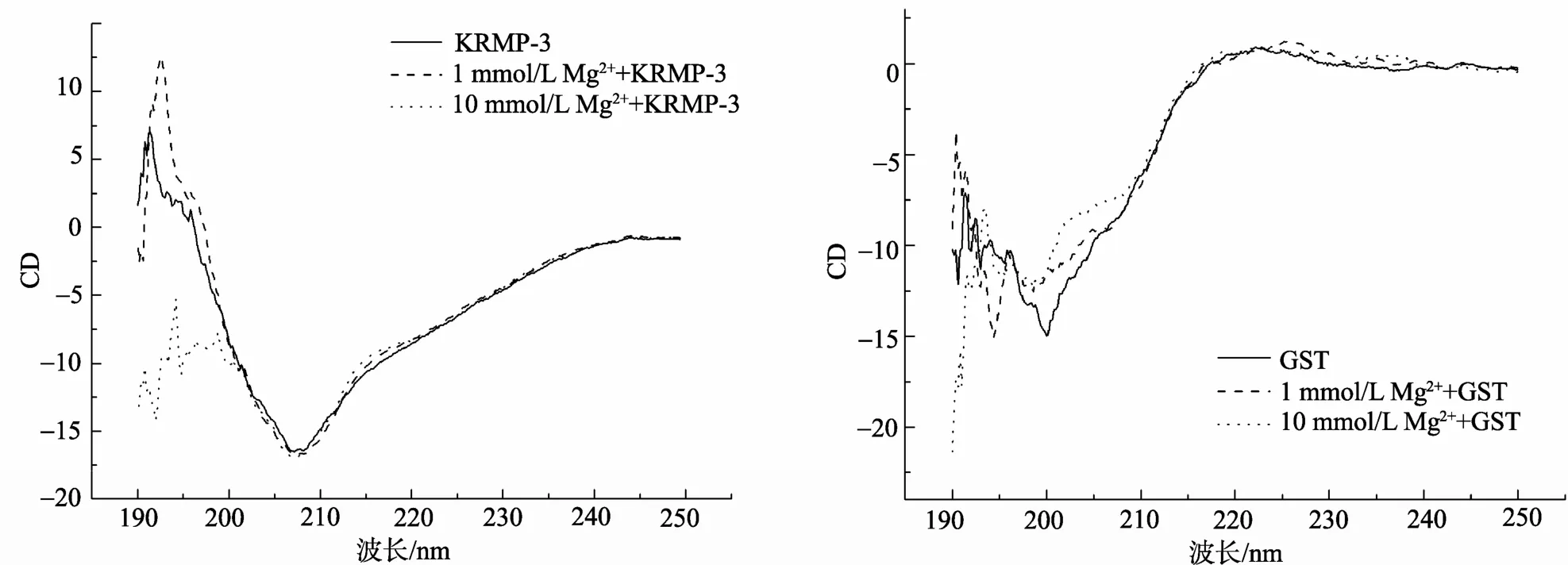
图3 不同浓度镁离子对KRMP-3蛋白及GST二级结构的影响 Fig. 3 Effect of different concentrations of Mg ion on the secondary structure of KRMP-3 protein and GST
生物大分子含有荧光基团(KRMP-3中主要是色氨酸), 加入外界离子后可能发生荧光淬灭现象, 这种现象可以间接说明蛋白与离子相互作用的强弱[5]。图4~图7分别显示了在KRMP-3蛋白溶液中加入了不同浓度的钙, 镁, 锶, 钡离子后荧光淬灭程度的变化。从图中可以清楚地看到, 在加入了一系列浓度梯度的钙离子后, KRMP-3的荧光强度发生了显著的淬灭现象, 且其峰值随着浓度的增加有规律的递减; 而加入镁, 锶, 钡等离子后, 虽然也发生了小幅度的荧光淬灭, 但其淬灭程度要小于钙离子, 且其峰值并没有出现规律性的递减。对照组为GST蛋白的荧光光谱图, 从图中可以看到, 当加入钙, 镁, 锶, 钡离子后, 其荧光强度基本不发生变化, 说明前面的荧光淬灭是由KRMP-3蛋白引起的, 钙离子更容易与KRMP-3蛋白结合, 从而使得荧光强度降低。由此可见, KRMP-3蛋白确实更“偏爱”于钙离子。结合圆二色谱的实验结果, 我们发现, 钙离子对KRMP-3的结构影响要大于其他离子, 说明KRMP-3对钙离子可能具有一定的选择性。
2.4 KRMP-3蛋白与钙离子结合常数K和结合位点数n的计算
为了确认KRMP-3与钙离子结合能力的强弱, 本实验对钙离子结合常数K和结合位点数n进行了计算。荧光淬灭的机理可以分为动态淬灭和静态淬灭[8-9]。动态淬灭遵循Stern-Volmer方程:I0/I=1+Kqτ0[Q]=1+Ksv[Q]。其中I0和I分别表示未加入淬灭剂(本实验中的二价离子)和加入淬灭剂之后的荧光强度, [Q]表示淬灭剂浓度,Kq为双分子淬灭过程速率常数,τ0为无淬灭剂时的分子平均寿命,Ksv为Stern-Volmer淬灭常数。由此可见, 假设钙离子使KRMP-3蛋白发生荧光淬灭是由动态淬灭引起的, 那么I0和I比值会和钙离子浓度成正比, 故选取波长为346 nm的荧光强度, 以钙离子浓度为横坐标, 荧光强度比值为纵坐标作图, 得到图8。

图4 含有不同浓度钙离子的KRMP-3蛋白及GST的荧光光谱 Fig. 4 The fluorescence spectra of KRMP-3 protein and GST with different concentrations of Ca ion
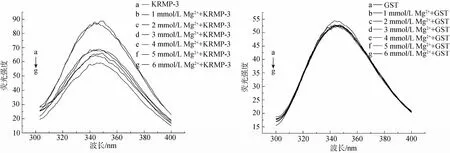
图5 含有不同浓度镁离子的KRMP-3蛋白及GST的荧光光谱 Fig. 5 The fluorescence spectra of KRMP-3 protein and GST with different concentrations of Mg ion
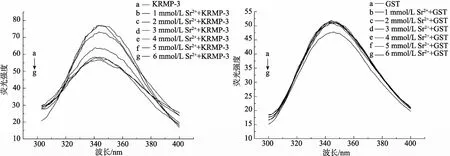
图6 含有不同浓度锶离子的KRMP-3蛋白及GST的荧光光谱 Fig. 6 The fluorescence spectra of KRMP-3 protein and GST with different concentrations of Sr ion

图7 含有不同浓度钡离子的KRMP-3蛋白及GST的荧光光谱 Fig. 7 The fluorescence spectra of KRMP-3 protein and GST with different concentrations of Ba ion
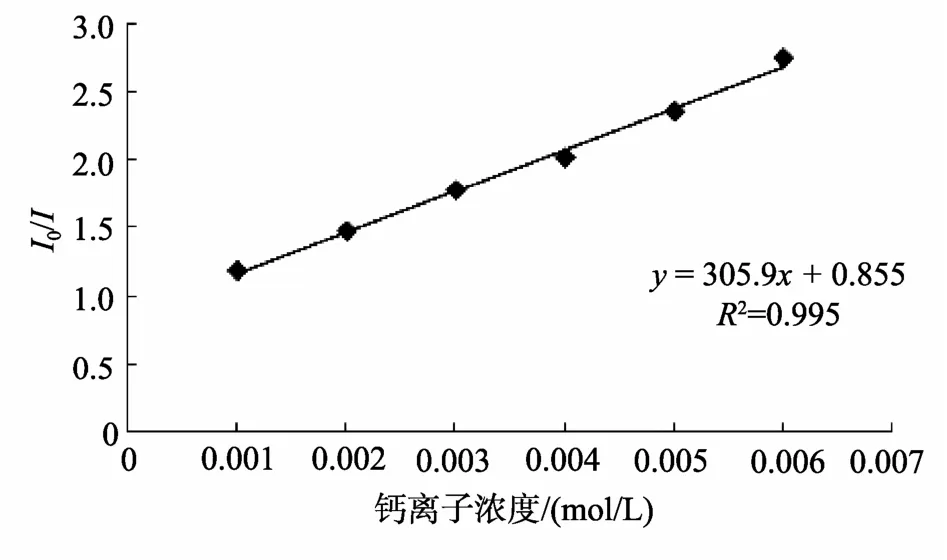
图8 动态淬灭拟合曲线 Fig. 8 The fitting curve of dynamic quenching
由图中拟合的线性方程可以得到Ksv为305.9 L/mol, 而生物大分子理论最大值Ksv是小于100 L/mol的, 故可认为由钙离子导致的荧光淬灭不是动态淬灭, 而是由静态淬灭。
仿照文献[10-11]中的方法来计算结合常数K和结合位点数n。假设游离的KRMP-3蛋白的浓度为[P], 淬灭剂钙离子的浓度为[Q], 假设蛋白与钙离子有n个独立的结合位点, 则当加入钙离子之后, 蛋白与n个钙离子形成蛋白复合体, 即QnP, 其结合常数

设加入钙离子后, 蛋白的总浓度为[P0], 即[P0]=[P]+[QnP], 由于蛋白的摩尔浓度远小于钙离子, 故平衡时钙离子的浓度近似等于初始浓度, 因此(1)式可改写为

在静态淬灭中, 由于生成的配合物是非荧光性的, 故荧光强度与溶液中游离的蛋白质浓度成正比, 即

结合(2)和(3)可以得到

从(4)中可以看到, lg(I0/I-1) 和lg[Q]成线性关系, 以lg[Q]为横坐标, lg(I0/I-1)为纵坐标作图, 可以得到图9。
由图中拟合的线性方程可以得知,n≈1.23 ,K≈103L/mol,R2=0.997 。
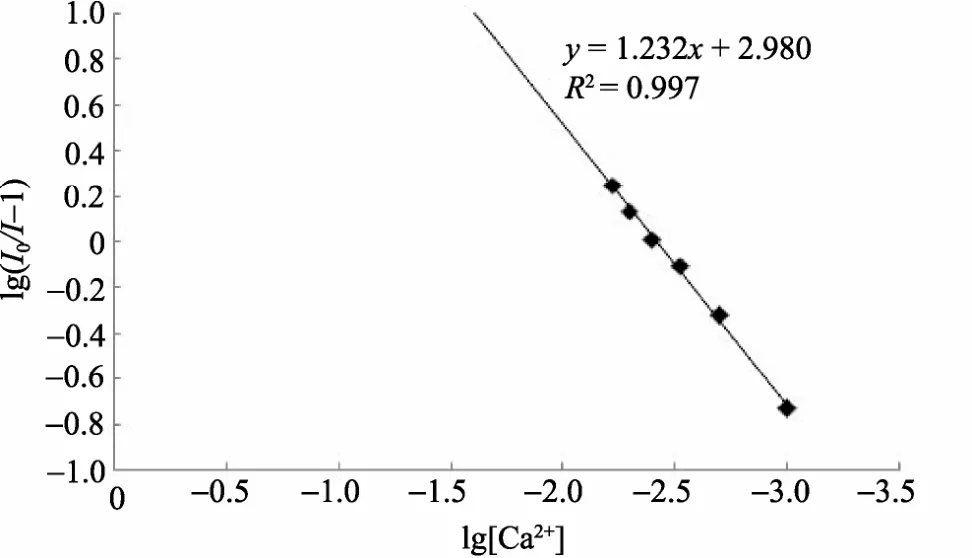
图9 静态淬灭拟合曲线 Fig. 9 The fitting curve of static quenching
3 讨论
KRMP-3是位于合浦珠母贝棱柱层的一种碱性基质蛋白, 圆二色谱和荧光光谱的实验结果显示了KRMP-3对钙离子具有选择性。利用方程计算得到KRMP-3与钙离子的结合位点数近似为1, 结合常数约为103L/mol, 说明KRMP-3与钙离子的结合程度并不是很强, 这或许可以解释KRMP在贝体内的生理功能。这种与钙离子中等的结合强度使得KRMP-3既可以从海水中特异性地捕捉钙离子, 又可以在一定条件下释放出所结合的钙离子以促进碳酸钙方解石晶体的形成, 从而从结构方面说明了KRMP-3是有可能参与棱柱层的形成的。
此外, 实验结果显示, KRMP-3对钙离子是具有明显的选择性的。当碳酸钙结晶体系中的镁离子含量达到一定程度时, 结晶出来的碳酸钙晶体是文石, 而在海水中钙, 镁离子都存在的条件下, 贝壳中的棱柱层依然能形成这种棱柱状的方解石晶体, 这很有可能是棱柱层存在着一些蛋白, 他们能特异性的识别钙离子, KRMP-3就很有可能具有这种功能。有结果显示[6], 当在含有镁离子的碳酸钙结晶体系中加入KRMP-3时, 文石的晶貌会出现明显的变化, 同时还有少量小颗粒的方解石产生。而本实验显示的KRMP-3对钙离子的选择性可以初步解释这种现象。
根据上述实验结果推测, KRMP-3之所以具有调节棱柱层中方解石形成的作用原因在于KRMP-3对钙离子的选择性, 它能够特异地捕捉海水中的钙离子, 将其“搬运”到贝壳中, 并在合适的条件下释放出钙离子, 使在棱柱层形成的微区间内形成一个类似于方解石形成的体系(无镁), 从而诱导方解石的形成。
[1] Addadi L, Weiner S. Biomineralization: A pavement of pearl [J]. Nature, 1997, 389(6653): 912-915.
[2] Marin F, Luquet G, Marie B, et al. Molluscan shell proteins: primary structure, origin, and evolution [J]. Curr Top Dev Biol, 2008, 80: 209-276.
[3] Zhang C, Zhang R. Matrix proteins in the outer shells of molluscs [J].Mar Biotechnol (NY), 2006, 8(6): 572-586.
[4] 赵南明, 周海梦. 生物物理学[M]. 北京: 高等教育出版社, 2000.
[5] 丘冠英, 彭银祥.生物物理学[M]. 武汉: 武汉大学出版社, 2000.
[6] 梁健. 合浦珠母贝基质蛋白KRMP-3的功能研究 [D]. 北京: 清华大学, 2009.
[7] Wang Q, Zhang R. The extra C-terminal tail is involved in the conformation, stability changes and the N/C-domain interactions of the calmodulin-like protein from pearl oyster Pinctada fucata [J]. BBA-Proteins and Proteomics, 1784(11): 1514-1523.
[8] 陈国珍. 荧光分析法(第二版)[M]. 北京: 科学出版社, 1990.
[9] 郭兴家. 荧光猝灭法研究胆红素与牛血清白蛋白的相互作用[J]. 分析实验室, 2007, 26(4): 11-15.
[10] 吴文华, 赵妍, 燚曹 . 荧光猝灭法对葫芦巴碱与人血清白蛋白间相互作用的研究[J]. 中医药学报, 2010, 36(8): 57-59.
[11] WangY P, Wei Y L, Chuan D. Study on the interaction of 3,3-bis (4-hydroxy-1-naphthyl)-phthalide with bovine serum albumin by fluorescence spectroscopy[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2006, 177(1): 6-11.
