SKF 38393 对伏隔核神经元兴奋性突触后电流的作用研究
2013-12-23刘宇炜陈晓青许晓利艾永循
刘宇炜,黄 丹,陈晓青,许晓利,艾永循
(江汉大学 医学院,湖北 武汉 430056)
伏隔核位于前脑基底,属边缘系统,主要接受来自中脑腹侧被盖区的多巴胺能及内侧前额叶皮质的谷氨酸能神经支配[1-2],传出纤维主要投射至腹侧苍白球,是边缘系统和锥体外运动系统的整合中枢,在行为、动机、奖赏和毒品成瘾等多种功能活动中起重要作用,并与多种神经精神疾病的发生密切相关[3]。
在伏隔核,多巴胺作为一种关键性神经递质,在控制奖赏基础上的认知活动中发挥着重要的作用[4]。目前已分离出5 种多巴胺受体,根据它们的生物化学和药理学性质,可分为D1 类和D2 类受体。D1 类受体包括D1 和D5 受体,D2 类受体包括D2、D3 和D4 受体。有报道指出多巴胺可激活突触前D1 受体而抑制诱发兴奋性突触后电流[5]。
在本实验中,笔者采用全细胞膜片钳技术,记录D1 受体选择性激动剂SKF 38393 对大鼠伏隔核棘状神经元自发兴奋性突触后电流的影响。研究表明其作用随着药物浓度的变化而发生改变,其对大鼠伏隔核棘状神经元谷氨酸受体介导的突触传递起双向的调节作用。
1 材料与方法
1.1 材料
Sprague-Dawley 大鼠,鼠龄17~32 天,雌雄不限,由江汉大学医学院医学实验动物中心提供。该中心获得湖北省科学技术厅颁发的《实验动物使用许可证》(许可证号:syxk(鄂)2012-0042,有效期为2012. 3. 5- 2017. 3. 4)。实验经过江汉大学医学伦理委员会批准,严格遵守实验动物处理的伦理学标准,尽可能减少动物的痛苦及使用数量。
D1 受体的选择性激动剂(SKF 38393),荷包牡丹碱(bicuculline)和6-氰基-7-硝基喹恶啉土卫四(6,7-dinitroquinoxaline-2,3-dione,DNQX)购自Sigma 公司,其余试剂为国产分析纯。
孵育液(mmol/L):glycerol 250,KCl 1.6,NaH2PO41.2,MgCl21.2,CaCl22.4,NaHCO325,glucose 11,调pH 值至7.3。
人工脑脊液(ACSF)(mmol/L):NaCl 125,KCl 1.6,NaH2PO41.2,MgCl21.2,CaCl22.4,NaHCO325,glucose 11,调pH 值至7.3。
电极内液(mmol/L):CsF 135,KCl 5,MgCl22,Hepes 10,Mg ATP 2,GTP 0.2,调pH 值至7.2。
1.2 方法
1.2.1 大鼠伏隔核脑片的制备 参照笔者以前的实验方法[6],并在此基础上稍加改进:无菌条件下迅速将大鼠断头取脑,置于混合气(95% O2/5% CO2)饱和的冰冷(0~4 ℃)孵育液中约5 min。在0 ℃通混合气条件下,采用振动切片机(VF-300,美国Precisionary 公司)将伏隔核脑组织切成250 μm 厚的冠状切片,置于混合气饱和的孵育液中,室温(22~24 ℃)下孵育至少1 h 以上。
1.2.2 电生理记录 玻璃微电极由P-97 电极拉制仪(美国Sutter 公司)分两步拉制,充灌电极内液后阻抗为4~6 MΩ。将脑片置于操作台正中约0.4 mL 凹槽内,用一铂金环压住。BX51 正置显微镜(日本奥林巴斯公司)下选大鼠伏隔核神经元。全细胞膜片钳记录所用仪器为Axopatch 700B 膜片钳放大器(美国Molecular 公司),在电极与细胞膜之间形成高阻(1 GΩ~5 GΩ)封接后,进一步将膜吸穿,调节电容和串联电阻补偿。数据以5 kHz 过滤,使用Axonscope 1.1.1 acquisition 软件通过Axon DigiData-1440A 记录于电脑上。整个记录过程中采用混合气饱和的人工脑脊液持续灌流,灌流速度约2 mL/min。
1.2.3 统计学分析 采用Sigmaplot 11.0(Jandel Scientific)和SPSS 16.0 进行处理、统计分析和制图。实验结果以均值±标准误(mean ± Ssem)表示,统计结果采用配对t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 D1 受体激动剂在较低浓度(100 nmol/L)时,增加sEPSC 频率,对幅度没有影响
伏隔核神经元大致分两种类型:投射神经元和中间神经元,其中投射神经元在数量上占绝大多数(约95 %),其特征为具有中等大小的胞体(直径约15 μm),树突上分布着大量树突棘,也被称为棘状神经元(medium spiny neuron,MSN)。在荷包牡丹碱(10 μmol/L)存在条件下,膜电位(VH)钳制于-75 mV 时,在棘状神经元上可记录到自发兴奋性突触后电流(sEPSCs),这些电流可被二硝基喹酮(6,7-Dinitro-1,4-dihydro-quinoxaline-2,3-dione,DNQX)(20 μmol/L,未作图示)所完全阻断,证明其为α-氨基羟甲基恶唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid,AMPA)受体所介导。如图1A所示,在较低浓度SKF 38393(100 nmol/L)作用下,自发兴奋性突触后电流频率增加了(15.3 ±1.7)%(n = 7;P <0.05,图1A 和图1C),幅度未发生明显改变((6.2 ± 1.1)%,n= 7;P >0.05,图1A 和图1B),10%~90%激活时间和衰减时间常数均未改变(n= 7;P >0.05,图1 B)。以上统计结果详见表1。
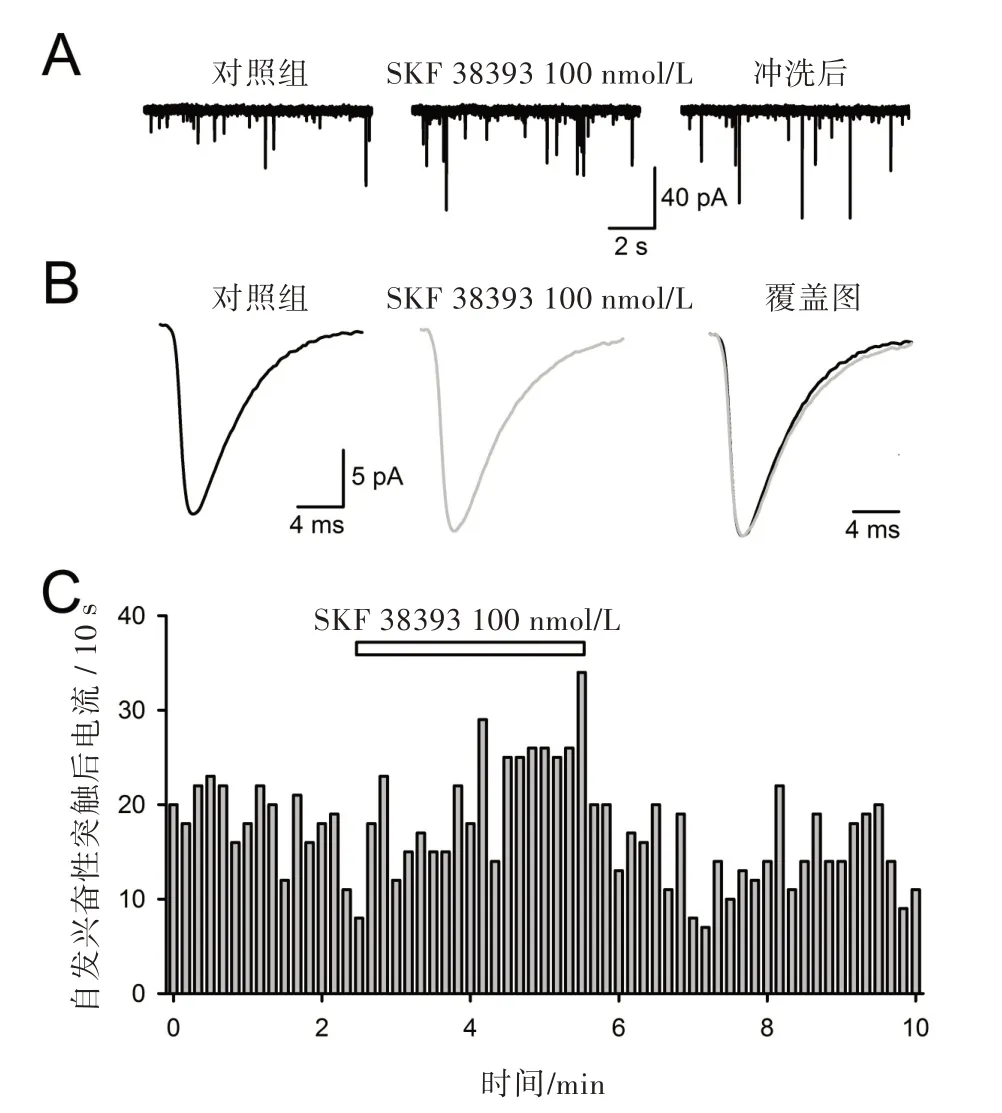
图1 100 nmol/L SKF 38393 对伏隔核神经元兴奋性突触后电流的作用
2.2 D1 受体激动剂在较高浓度时(10 μmol/L)时,对sEPSC 频率无明显影响,而显著升高其幅度
接下来将SKF 38393 浓度增加到10 μmol/L。在浓度条件下,SKF 38393 大幅增加自发兴奋性突触后电流幅度((48.5 ± 5.1)%,n = 8;P <0.001,图2A 和图2B),而不改变其频率((5.2 ±1.0)%,n= 8;P >0.05,图2A 和图2C)。对电流特性的进一步分析表明,其10%~90 %激活时间未发生明显改变,而其衰减时间常数增加了(26.0±2.4)%(n=8;P <0.01,图2B 和表1)。
3 讨论
中枢神经系统内存在着奖赏系统(rewarding system),该系统主要涉及弓状核、杏仁核、蓝斑、中脑导水管周围灰质、腹侧被盖区(VTA)、伏隔核(nucleus accumbens,NAcc)等脑区。目前认为,依赖性药物及其所有的天然奖赏性刺激(如美食等)都是通过作用于该系统最终引起伏隔核多巴胺释放增多,从而产生奖赏效应;腹侧被盖区和伏隔核是依赖性药物引起奖赏作用的最后通路[1-3]。
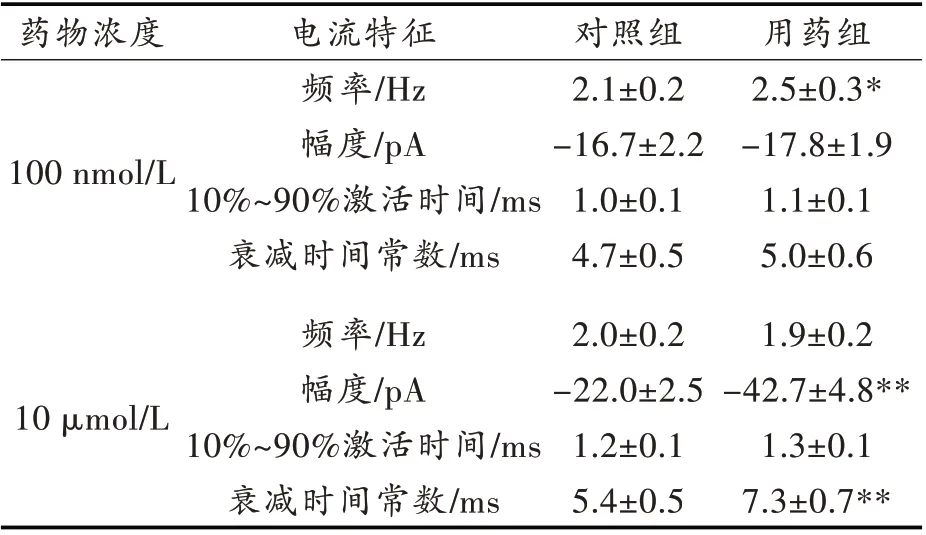
表1 SKF 38393 对伏隔核神经元兴奋性突触后电流的影响
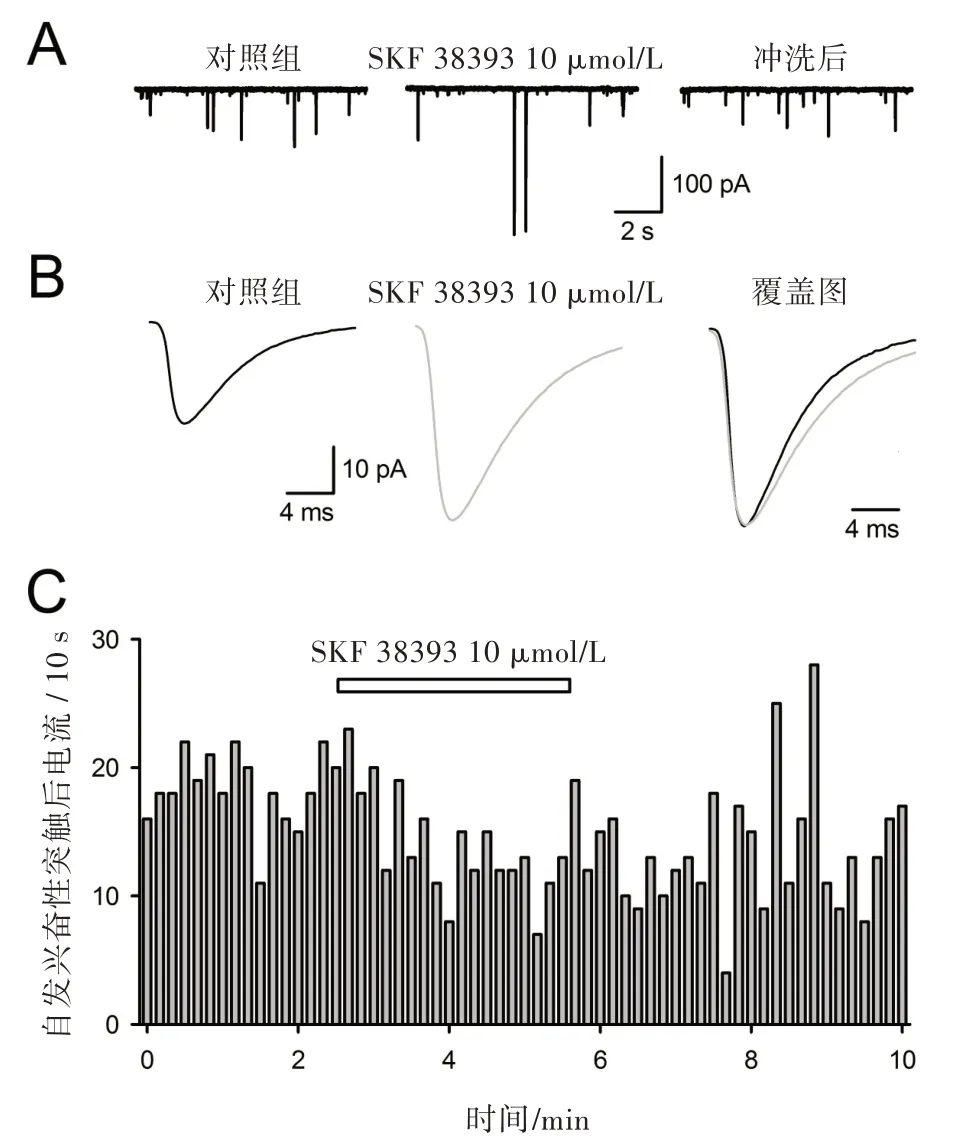
图2 10 μmol/L SKF 38393 对伏隔核神经元兴奋性突触后电流的作用
动物在伏隔核内注入多巴胺受体激动剂后可表现出运动增多,这是由于机体的“易化”作用所引起的。动物出现激励、准备反应。中脑边缘多巴胺系统被认为是奖赏效应的神经基础,伏隔核在奖赏效应中的作用很早就被人们所重视,支持伏隔核在奖赏效应中作用的最直接证据是动物自我给予多巴胺类似物(即直接用多巴胺受体激动剂)或增加细胞外多巴胺的药物。这些奖赏物质可作为强化剂使动物不断地重复某种行为以获得奖赏或欣快的感觉。作为奖赏通路的中脑边缘多巴胺系统也是成瘾药物产生依赖的神经基础,许多促进多巴胺释放的药物都通过促进多巴胺神经元活动而获得奖赏和强化效应。为伏隔核多巴胺与动物对环境刺激学习记忆形成的初期有关,给予多巴胺受体拮抗剂可降低动物对环境的学习能力,但对已经形成的记忆没有影响。
本次全细胞膜片钳研究表明,作用于伏隔核脑片时,D1 受体选择性激动剂SKF 38393 的作用表现出双向性。在较低浓度(100 nmol/L)时,SKF 38393 可增加自发兴奋性突触后电流频率,不改变其幅度;在较高浓度时(10 μmol/L)时,对自发兴奋性突触后电流频率无明显影响,而显著升高其幅度。而进一步对其10%~90%激活时间和衰减时间常数的分析表明,低浓度SKF 38393不改变这些参数,而高浓度SKF 38393 可使衰减时间常数显著增加。综合分析表明,在较低浓度条件下,多巴胺可作用于突触前D1 受体,增加突触前兴奋性递质的释放;而在较高浓度条件下,sEPSCs 频率无显著性改变,但有一定下降趋势(表1,图2C),这很可能是在此条件下,多巴胺对D1 受体的作用有增加和减少兴奋性递质释放的双向性,其作用可相互抵消。但衰减时间常数显著增加则表明药物作用的短时间内微小兴奋性突触后电流叠加在一起,这很可能是sEPSC 幅度大幅增加的原因之一。
本研究结果与Harvey 等[5]的报道不尽一致,他们的研究表明多巴胺可激活突触前D1 受体而抑制诱发兴奋性突触后电流。这是因为:第一,他们将膜电压钳制在-80~-90 mV,而本研究钳制在-75 mV。他们的实验鼠龄为4~5 周,本研究选用的实验鼠为生后17~32 天,基本相同。而根据赵妍君等[3]的研究表明,大鼠伏隔核神经元出生后15~21 天与22~30 天的静息膜电位分别为(-74 ± 9)mV 与(-73 ± 9)mV。钳制电压的不同可在一定程度上影响其电流的大小、离子进出细胞膜的比例等。第二,Harvey 等只研究了10 μmol/L SKF 38393 的作用。本研究结果表明SKF 38393 的浓度大小会影响其作用效果。在高浓度条件下,D1 受体激动剂的作用更加复杂。
综上所述,随着药物浓度的变化,D1 受体选择性激动剂SKF 38393 对大鼠伏隔核棘状神经元自发兴奋性突触后电流的影响也发生改变,其对大鼠伏隔核棘状神经元谷氨酸受体介导的突触传递起双向的调节作用。其作用的复杂性也反映了多巴胺在中枢神经系统内奖赏系统作用的复杂性,进一步对其作用机制的研究将有助于我们在行为、动机、奖赏和毒品成瘾等多种功能活动与神经精神疾病的药物治疗方面提供新的理论依据。
[1] Ikemoto S. Brain reward circuitry beyond the mesolimbic dopamine system:a neurobiological theory[J].Neurosci Biobehav Rev,2010,35(2):129-150.
[2] Morales M,Pickel V M. Insights to drug addiction derived from ultrastructural views of the mesocorticolimbic system[J].Ann N Y Acad Sci,2012,1248:71-88.
[3] 赵妍君,刘应兵,阴正勤,等.大鼠发育过程中伏隔核神经元的电生理学和形态学特性[J]. 神经解剖学杂志,2004,20(1):60-64.
[4] Yawata S,Yamaguchi T,Danjo T,et al. Pathway-specific control of reward learning and its flexibility via selective dopamine receptors in the nucleus accumbens[J]. Proc Natl Acad Sci U S A,2012,109(31):12764-12769.
[5] Harvey J,Lacey M G.Endogenous and exogenous dopamine depress EPSCs in rat nucleus accumbens in vitro via D1 receptors activation[J]. J Physiol,1996,492(Pt 1):143-154.
[6] Liu Y W,Li J,Ye J H. Histamine regulates activities of neurons in the ventrolateral preoptic nucleus[J]. J Physiol,2010,588(Pt 21):4103-4116.
