3 种根皮素酰腙衍生物的合成及抑制酪氨酸酶和抗氧化活性
2013-12-23余燕影曹树稳
杜 鹏,余燕影* ,曹树稳,2
1南昌大学化学系,南昌330031;2 食品科学与技术国家重点实验室 南昌大学,南昌330047
酪氨酸酶(EC.1.14.18.1)广泛存在于动植物体,在动植物体内酶促褐变、体内色素合成的过程中起了关键的作用。它具有单酚酶的活性能将酪氨酸羟化,产生邻位二羟基苯丙氨酸(L-多巴),也具有二酚酶的活性,能将L-多巴氧化成多巴醌,进而生成黑色素[1]。酪氨酸酶抑制剂就是通过抑制酪氨酸酶活性从而抑制黑色素生成,近年来,国内外学者对酪氨酸酶抑制剂的研究非常活跃。根皮素(Phloretin)为具有二氢查尔酮类结构的黄酮类化合物,是近年来国外研究较多的一种具有生物活性的天然化合物,主要分布于苹果、梨等多汁水果的果皮及根皮。具有抗氧化[2],抗突变,抗炎及抗肿瘤等生理功效,同时又有美白,抗皱等美容功效,能抑制酪氨酸酶和黑色素细胞活性[3],对各种皮肤色斑有淡化作用,是一种较有开发前景的新型皮肤美白剂,因此它在美容行业也受到越来越多的关注。目前国内外对其进行化学修饰的报道并不多见。
酰腙类化合物属于席夫碱的一种,不仅具有独特的化学结构,而且在抗菌,抗炎、抗病毒及抗肿瘤等方面有着独特的生物和药理活性。本文以根皮素为母体,与三种酰肼化合物结合,引入活性基团,合成了三种新型的酰腙类化合物,提高根皮素的生物活性,以期获得高效、安全的酪氨酸酶抑制剂,开拓其应用领域。
1 实验部分
1.1 仪器与材料
UV-2450 紫外分光光度计(日本岛津公司);FTIR Nicolet5700 傅里叶变换红外光谱仪(美国热电尼高力公司);AV-600 型核磁共振仪(德国BRUKER 公司);ZQ4000/2695 型液质联用仪(美国Waters 公司);X-4 显微熔点测定仪(温度计未校正);DF-101S 集热式恒温加热磁力搅拌器;DZF-150数显小型恒温真空干燥箱;SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司)。
根皮素(98%,陕西华泰精细化工);苯甲酰肼(99%)、水合肼(85%)、水杨酸甲酯(98%)、对羟基苯甲酸乙酯(99%)、对甲苯磺酸(99%)均购买于国药化学试剂厂;酪氨酸酶(1881 U/mg,Sigma 公司);DPPH(Sigma 公司);硅胶(200~300 目,青岛海浪硅胶干燥剂厂);其余试剂均为国产分析纯,所用水均为二次蒸馏水。
1.2 实验方法
1.2.1 根皮素酰腙衍生物1~3 的合成
2-羟基苯甲酰肼和4-羟基苯甲酰肼的合成分别按照文献[4,5]的方法合成。2-羟基苯甲酰肼的合成方法为:将7.60 g 水杨酸甲酯(0.05 mol)和20 mL 85%水合肼溶入无水乙醇中,80.0 ℃加热回流10 h,蒸出大部分乙醇,冷却、搅拌,有白色沉淀生成,抽滤。乙醇重结晶,抽滤、干燥得白色针状晶体。产率95%,熔点m.p.148.0~149.0 ℃;4-羟基苯甲酰肼的合成方法如下:称取9. 97 g 4-羟基苯甲酸乙酯(0.06 mol),加入25 mL 85%水合肼,80.0 ℃加热回流15 min,再加入20 mL 乙醇,继续加热回流4 h,蒸出部分乙醇,冷却,抽滤得白色沉淀。乙醇重结晶,抽滤、干燥得到白色粉末。产率为90%,熔点m.p.258.0~260.0 ℃。
化合物1~3 的合成方法参考文献[6]。分别称取15 mmol 根皮素(4.1139 g)及15 mmol 酰肼置于250 mL 三颈瓶中,加入70 mL 无水乙醇搅拌溶解后,加入30 mL 甲苯和0.3 g 对甲苯磺酸,在88.0℃回流分水反应48 h。用200~300 目硅胶柱层析,TLC 跟踪检测,所用洗脱剂分别为:乙酸乙酯/石油醚=2∶1(化合物1);氯仿/甲醇=8∶1(化合物2);乙酸乙酯/石油醚=1∶1(化合物3)。将洗脱液收集、浓缩、真空干燥至恒重,分别得到目标产物。
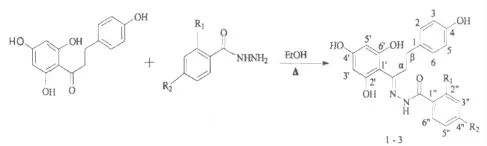
图1 根皮素酰腙衍生物1~3 的合成路线Fig.1 Synthesis routes for compounds 1-3
1.2.2 抑制酪氨酸酶活性研究
酪氨酸酶活力的测定是基于L-DOPA 的酶催化氧化产物—多巴色素在475 nm 处有最大吸收,吸光系数ε=3700 (cm· mol/ L)-1。酪氨酸酶活力单位(U/ min)规定:以每分钟多巴色素在475 nm 处的吸光度(A475)增加0.001 为一个酶活力单位。所以,通过测定酶催化反应体系的A475随时间的增长直线,从直线斜率即可求得酶活力。
参照文献[7]的方法略作修改:在3 mL 的反应体系中,将0.3 mL 的5.0 mmol/L L-DOPA 溶液(溶剂为pH =6. 8 的磷酸盐缓冲液)加入0. 6 mL 的0.25 mol/L 的PBS 缓冲溶液和1.9 mL 的蒸馏水,在30 ℃恒温水浴中恒温10 min,加入0.1 mL 的不同浓度样品溶液(DMSO 溶剂)和0.1 mL 酪氨酸酶水溶液(160 μg),测定OD475。此测活体系中酶的终质量浓度为5.3 μg/mL。
待测样品对酪氨酸酶的抑制率按下式计算:
抑制率( %) =(1 -OD1/OD2) ×100%
式中:OD1是指含有底物、酪氨酸酶、待测样品的测活体系的酶活力值;OD2是指含有底物、酪氨酸酶,但不含样品的测活体系的酶活力值。
1.2.3 清除DPPH 自由基研究
参照Lee YL 等[8]方法略作修改:比色管中依次加入不同浓度受试样品1 mL 及0.6 mmol/L DPPH甲醇溶液0.5 mL,然后以甲醇补充体积至5 mL,30 min 室温避光反应后于517 nm 处测定吸光值。平行测定三次,结果为平均值±标准偏差。
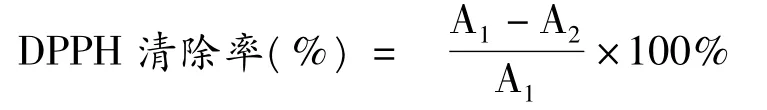
其中:A1为不加样品,加入DPPH 时的吸光度值;A2为加入样品和DPPH 时的吸光度值。
1.2.4 总抗氧化能力( ABTS 自由基)
参照Re,R[9]的方法略作修改。ABTS 自由基的生成方法:将7 mmol/L 的ABTS 水溶液与2.45 mmol/L 的K2S2O8溶液混合,在室温暗处放置12~16 h 后使用。使用前将ABTS 自由基储备液用乙醇稀释至吸光度值为0.70 ±0.02(734 nm 处)。比色管中依次加入系列浓度的受试样品0.5 mL 以及ABTS·+工作液5 mL,以乙醇溶液作为空白对照,室温避光反应6 min 后于734 nm 处测定吸光值。平行测定三次,结果为平均值±标准偏差。
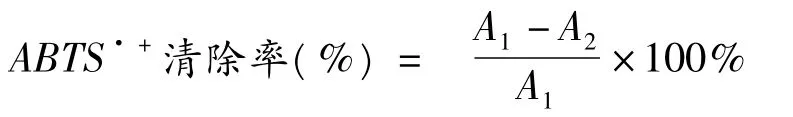
其中,A1为不加样品,加入ABTS·+时的吸光度值;A2为加入样品和ABTS·+时的吸光度值。
2 结果与讨论
2.1 结构表征
2.1.1 UV 光谱
将根皮素及其酰腙分别溶于无水乙醇,配成浓度为1 ×10-5mol/L 的溶液,测定紫外-可见吸收光谱,测定波长为200~600 nm,结果见图2:
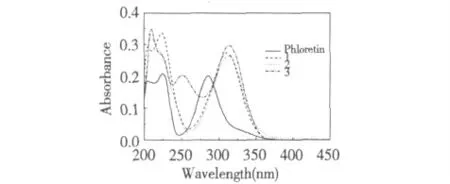
图2 化合物的紫外-可见光谱图Fig.2 UV-Vis spectra of phloretin and its hydrazone 1-3
由图可知,根皮素在225、286 nm 处有两个强吸收峰,酰腙与母体相比,峰Ⅰ由286 nm 红移至310 nm(1)、312.5 nm(2)、314 nm(3),强度略增。是由于形成酰腙后,次氨基氮原子的孤对电子与羰基和亚氨基双键形成了p-π 共轭体系,使得根皮素母体的共轭体系延长,导致吸收波长向长波方向移动。
2.1.2 IR 光谱
用KBr 压片,测定根皮素及其酰腙衍生物1~3的红外特征吸收峰,测量范围400~4000 cm-1,数据见表1:

表1 化合物的主要红外吸收频率及归属(cm-1)Table 1 IR spectra data of phloretin and its hydrazone 1-3
根皮素的羰基振动频率ν (C =O)在1633 cm-1处出现较弱特征吸收峰,形成酰腙后,化合物1~3分别在1631、1627、1638 cm-1处出现C=N 很强的特征吸收峰,3296、3254、3363 cm-1处出现了NH 伸缩振动特征峰,分别在1592、1587、1609 cm-1处出现NNH 弯曲振动特征峰,这均说明合成了酰腙。
2.1.31H NMR 及13C NMR 谱学及质谱数据
Phloretin benzoyl hydrazone(化合物1)Yield:39%;mp. :258~260 ℃;1H NMR (DMSO-d6,600 MHz)δ:2.76(2H,t,J =7.8 Hz,β-H),3.19(2H,t,J =7.8 Hz,α-H),5.76 (2H,s,3',5'-H),6.66 (2H,dd,J =2.4,2.4 Hz,3,5-H),7.01(2H,m,2,6-H),7.53(2H,dd,J =7.2,1.2 Hz,3'',5''-H),7.60(1H,d,J=0.6 Hz,4''-OH),7.92(2H,dd,J=1.2,0.6 Hz,2'',6''-H),8.73 (1H,d,J =2.4 Hz,N-NH),9.13 (1H,s,4-OH),10.45(1H,d,J =0.6Hz,4'-OH),12.24(2H,s,2',6'-OH);13C NMR(DMSO-d6,150 MHz)δ:203.6 (-C=O),166.7 (-C=N),166.3 (C-2'),164.4 (C-6'),156.5 (C-4'),155.8 (C-4),133.0 (C-1),132.4 (C-2''),132.2(C-6''),129.6 (C-1''),129.0 (C-3''),129.0 (C-5''),127.9 (C-4''),127.8 (C-1'),115.5 (C-2,6),103.2 (C-3,5),90.4(C-3',5'),45.7 (C-β),30.1(C-α);ESI-MS:m/z calcd for C22H20O5N2[M +Na+]415.39,found[M+Na+]415.06。
Phloretin 2-hydroxy benzoyl hydrazone(化合物2) Yield:41%;mp. :254~256 ℃;1H NMR(DMSO-d6,600 MHz)δ:2.76 (2H,t,J=7.8 Hz,β-H),3.19 (2H,t,J=7.8 Hz,α-H),5.77 (2H,s,3',5'-H),6.65 (2H,dd,J=1.8,2.4 Hz,3,5-H),6.96(2H,m,3'',6''-H),7.01 (2H,t,J =2.4 Hz,2,6-H),7.45 (1H,t,J = 6.6,1.8 Hz,5''-H),7.88(1H,m,J =1.8,1.2 Hz,4''-H),8.78 (1H,s,NNH),9.12 (1 H,s,4-OH),10.52 (1H,s,4'-OH),11.84 (1H,s,2''-H),12.24 (2H,s,2',6'-OH);13C NMR (DMSO-d6,150 MHz)δ:203.7 (-C = O),169.0 (-C = N),164.4 (C-2''),159.7 (C-2',6'),156.1 (C-4''),155.8 (C-4),134.6 (C-1),132.2(C-1''),129.6 (C-4''),128.6 (C-6''),119.5 (C-5''),117.8 (C-3''),115.5 (C-1'),115.3 (C-2,6),103.3 (C-3,5),90.5 (C-3',5'),45.8 (C-β),30.1(C-α);ESI-MS:m/z calcd for C22H20O6N2[M-H+]407.40,found[M-H+]406.89。Phloretin 4-hydroxy benzoyl hydrazone(化合物3) Yield:45%;mp. :277~279 ℃;1H NMR(DMSO-d6,600 MHz)δ:2.75 (2H,t,J =7.8Hz,β-H),3.17 (2H,t,J=7.8 Hz,α-H),5.73 (2H,s,3',5'-H),6.65 (2H,d,J=2.4 Hz,3,5-H),6.65 (2H,d,J=8.4 Hz,3'',5''-H),7.01 (2H,d,J=8.4 Hz,2,6-H),7.79 (2H,t,J =9.0 Hz,2'',6''-H),8.65(1H,s,N-NH),9.14 (1H,s,4-OH),10.13 (1H,s,4'-OH),10.20 (1H,s,4''-OH),12.24(2H,s,2',6'-OH);13C NMR (DMSO-d6,150 MHz)δ:203.5 (-C=O),166.3 (-C=N),164.2 (C-4''),161.2 (C-2',6'),156.7 (C-4'),155.8 (C-4),132.2 (C-1,1'),129.8 (C-1'),129.5 (C-2',6'),123.6 (C-3'',5''),115.5 (C-2,6),103.2 (C-3,5),90.4 (C-3',5'),45.6 (C-β),30.1(C-α);ESI-MS:m/z calcd for C22H20O6N2[M-H+]407.40,found[M-H+]406.51。
2.2 活性研究
2.2.1 化合物对酪氨酸酶活力的影响
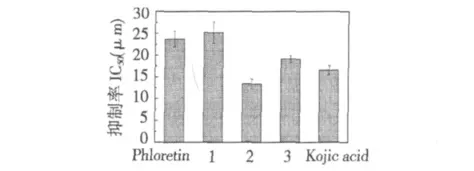
图3 抑制酪氨酸酶活力IC50Fig.3 Inhibitory IC50 for Phloretin,hydrazone 1-3 against tyrosinase
由图3 可知,化合物抑制酪氨酸酶活力大小的顺序是:化合物2 >曲酸>化合物3 >化合物1 >根皮素。与根皮素相比较,根皮素苯甲酰基腙(1)虽表现出较强的抑制能力,但两者之间没有显著性差异(P >0.05);根皮素2-羟基苯甲酰基腙(2)和根皮素4-羟基苯甲酰基腙(3)的抑制酶活力能力得到明显提高,呈现显著性差异(P <0.05),且酰腙2(芳酰基苯环邻位有一个羟基)的抑制能力比酰腙3(芳酰基苯环对位有一个羟基)强,甚至强于常用美白剂曲酸,这可能是因为酰基苯环上羟基的位置不同所产生的影响[10]。
2.2.2 清除DPPH 自由基
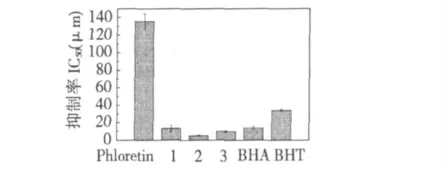
图4 清除DPPH 自由基能力Fig.4 Scavenging activity of samples on DPPH radicals
由图4 可知,化合物清除DPPH 自由基的能力顺序是:2 >3 >1 >BHA >BHT >根皮素。新合成的三种化合物的清除DPPH 自由基的能力相比根皮素都有了显著提高,并且强于常用抗氧化剂BHA 和BHT。酰腙2 和3 的IC50明显小于酰腙1 和根皮素,说明在芳酰基引入一个羟基后的酰腙化合物具有更好的自由基清除能力。酰腙2 清除自由基能力强于3,这也证明芳酰基苯环上羟基的个数和位置在化合物清除DPPH 自由基能力中有着关键作用。
2.2.3 总抗氧化能力
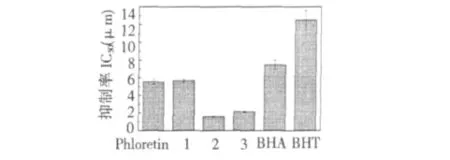
图5 清除ABTS 自由基能力Fig.5 Scavenging activity of samples on ABTS radicals
由图5 中的IC50值可知,各受试样品均具有较强的清除ABTS 自由基能力,根皮素和酰腙1~3 的清除ABTS 自由基的能力都强于常用抗氧化剂BHA和BHT,酰腙2 和3 的清除能力显著高于母体根皮素和1,而根皮素和酰腙1 的清除能力相当(P >0.05),酰腙2 (IC50= 1.60 ± 0.053 μM)的清除ABTS 自由基能力最强。此实验结果证明芳酰基苯环上羟基的个数和位置在化合物清除ABTS 自由基能力中发挥着重要作用。
3 结论
以天然活性物质作为先导化合物,对其进行结构修饰和改造,是天然产物研究热点之一。本文中以根皮素为母体合成了三种酰腙类化合物,并对其结构进行了表征。抑制酪氨酸酶活性和清除自由基实验表明,酰腙2 和3 的抑制酪氨酸酶能力相比母体根皮素有了明显提高;酰腙1~3 清除DPPH 自由基的能力得到明显提高且均大于阳性对照品BHA、BHT;新合成酰腙2 和3 清除ABTS 自由基的能力也有了明显增强。对物质构效关系探讨表明,化合物芳酰基苯环上羟基的个数和位置在抑制酪氨酸酶和清除自由基能力中发挥着关键作用。
1 Sanchez-Ferrer A,Rodrigucz-Lopez JN,Garcia-Canovas F,et al. Tyrosinase:a comprehensive review of its mechanism.Biochim Biophys Acta,1995,1247:1-11.
2 Rezk BM,Haenen GR,van der Vijgh WJ,et al.The antioxidant activity of phloretin:the disclosure of a new antioxidant pharmacophore in flavonoids.Biochem Biophys Res Commun,2002,295:9-13.
3 Lin YP,Hu FL,Chen CS,et al.Constituents from the formosan apple reduce tyrosinase activity in human epidermal melanocytes.Phytochemistry,2007,68:1189-1199.
4 Gong XQ(龚筱群),Chen HC(陈洪超).Synthesis and fungicidal effect of some derivatives of salicylic acid hydrazide.West Chin J Pharm Sci (华西药学杂志),1997,12:240-242.
5 Wu BW(仵博万),Zhang B(张兵),Yu XQ(于新桥),et al. Synthesis of 4-(benzeneazo)salicyladelhyde hydrazones and study on their spectral properties. Spectrosc Spect Anal(光谱学与光谱分析),2006,26:106-108.
6 Li J(李静),Yu YY(余燕影),Cao SW(曹树稳).Synthesis,characterization and antioxidant activity of phloretin isonicotinyl hydrazone.Nat Prod Res Dev (天然产物研究与开发),2011,23:824-827.
7 Shi Y,Chen QX,Wang Q,et al.Inhibitory effects of cinnamic acid and its derivatives on the diphenolase activity of mushroom (Agaricus bisporus)tyrosinase.Food Chem,2005,92:707-712.
8 Lee YL,Yang JH,Mau JL. Antioxidant properties of water extracts from Monascus fermented soybeans. Food Chem,2008,106:1127-1137.
9 Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical decolorization assay.Free Radic Biol Med,1999,26:1231-1237.
10 Wu ZR,Zheng LF,Li Y,et al.Synthesis and structure-activity relationships and effects of phenylpropanoid amides of octopamine and dopamine on tyrosinase inhibition and antioxidation.Food Chem,2012,134:1128-1131.
