迷迭香酸对辐射损伤小鼠造血功能的保护作用
2013-12-23张玉杰李光强徐文清施培基
张玉杰,李光强,徐文清 ,沈 秀,施培基
北京协和医学院中国医学科学院放射医学研究所 天津市分子核医学重点实验室,天津300192
辐射防护剂是一类在照射前或在照射后早期使用,能够减轻辐射对机体造成的损伤,促进损伤恢复的药物。在电离和非电离等辐射接触中,它扮演着重要的角色。20 世纪50 年代,辐射防护剂迎来了研究的高潮时期,70 年代以后,因为核战威胁趋于缓和而逐渐低迷。近年来,航天航空事业飞速发展,辐射防护剂的研究又被提上日程。因此,安全、广谱的辐射防护药物研究不仅对医疗事业亦对航天航空事业的发展具有重要意义。
一直因强抗氧化活性而广泛用于食品、化妆品行业的迷迭香酸,由于安全及药效广谱而成为医药领域的研究热点。它具有抗炎、抗氧化、抗菌、抗病毒、免疫调节、抗血栓和抗血小板凝聚、抗肿瘤、改善和增强认知能力及治疗过敏性疾病等众多药理作,化学结构见图1。最新研究发现的对抗紫外线辐射[1]和降低60Co γ 射线导致的骨髓细胞中嗜多染红细胞微核发生率等功效[2],引起了笔者的兴趣。本研究探索迷迭香酸对亚致死剂量辐射损伤小鼠造血功能的保护作用。
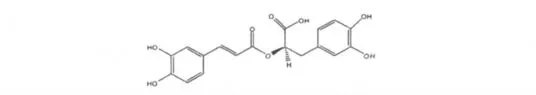
图1 迷迭香酸的化学结构Fig.1 Chemical structure of rosmarinic acid
1 材料与仪器
1.1 药品和试剂
迷迭香酸(Rosmarinic acid,RA)购自Sigma;阿米福汀(Amifostine,WR-2721)购自大连美罗大药厂;碳酸氢钠、无水氯化钙、冰醋酸、高氯酸,购自津市江天化工技术有限公司;氯化钠注射液购自中国大冢制药有限公司;乙二胺四乙酸二钾(EDTA-2Ka)购自天津市光复精细化工研究所。
1.2 仪器
137Cs γ 射线照射源(Gammacel 40,加拿大);BC-2800 全自动血液细胞分析仪(迈瑞,深圳迈瑞生物医疗电子股份有限公司);正置荧光显微镜(Qlympus BX53,美国);离心机(TDZ5-WS,湘仪离心机仪器有限公司);电子精密天平(METTLER TOLEDO,美国)。
1.3 动物
健康SPF 级ICR 小鼠,由天津市实验动物中心提供,动物合格证号SCXK(津)2010-0002。
2 实验方法
2.1 实验动物分组与给药
6~7 周龄ICR 小鼠,70 只,体重18 ± 2 g,雌雄各半,随机分为7 组:正常组;单纯照射组(IR )给予生理盐水;阳性对照组(WR-2721)于照射前0.5 h腹腔注射WR-2721 200 mg/kg b. w.;迷迭香酸(RA)50、100、150、200 mg/kg 剂量组分别给予RANa(迷迭香酸钠盐)50、100、150、200 mg/kg b. w.。IR 组与RA 各剂量组均于照射前2、1 日连续口服给药0.3 mL/只,照射当日,于照射前20 min 给药;照射后连续给药6 日,均每日一次。137Cs γ 射线一次性全身照射,照射剂量率71.1 rad/min,小鼠吸收剂量为5.5 Gy。实验重复三批。
2.2 观察指标
2.2.1 体重
取照射前2 日,照射当日,照射后2、4、6 日等5个时间点,对各组小鼠称重,观察体重变化。于照射后第7 日,处死之前称取各组小鼠体重。
2.2.2 脏器系数
照射后第7 日,称得小鼠体重,然后颈部脱椎处死。取脾脏和胸腺,称重,按下式计算脏器系数:

2.2.3 外周血指标
照射后第7 日,小鼠摘眼球取血约1 mL,加入20 mg/mL EDTA-2Ka 的生理盐水溶液100 μL,BC-2800 全自动血液细胞分析仪检测白细胞(white blood cell,WBC)、血小板(blood pelet,PLT)数目及血红蛋白(hemoglobin,HGB)浓度。
2.2. 4 股骨有核细胞数(bone marrow nucleated cells,BMNC)
于照射后第7 日,将小鼠颈部脱椎处死,取一侧股骨,用白细胞稀释液冲洗骨髓,后于荧光显微镜下观察股骨有核细胞并计数。
2.2.5 脾结节(colong forming unit of spleen,CFUS)
将取出的脾脏放入Bouin 液内固定,约24 h 后,取出,用酒精冲洗去大部分黄色,肉眼计数突出脾脏表面的结节数(CFU-S)。
2.2.6 骨髓DNA 含量
照射后第7 日,小鼠颈部脱椎处死后取一侧股骨,用0.005 mol/L CaCl2溶液冲洗骨髓,离心,弃上清液,加入0.2 mol/L 高氯酸溶液5 mL,充分混匀,90 ℃加热15 min,冷却,过滤,滤液于268 nm 处测定吸光度值(A)。DNA(μg)= 40 ×50 ×A
2.3 统计学处理
所有数据均以表示,不同实验组间差异采用单因素ANOVA 方差分析检验,SPSS17.0 软件处理,P<0.05 为差异有统计学意义。
3 实验结果
3.1 不同剂量RA 对γ 射线照射后小鼠体重的影响
137Cs γ 射线照射前,各组小鼠毛色及活动正常,体重增加。照射后,正常对照组因没有受到辐射仍保持正常;IR 及RA 各剂量组均出现不同程度的梳毛光泽性下降、精神萎靡、饮食和饮水量下降;WR-2721 组的毛色及活动状况几与正常对照组无异。
在照射前第2 日(-2)、照射当日(0)、照射后第2(+2)、4(+4)、6(+6)日对小鼠称重,各组小鼠体重变化趋势见图2。照射前,各组小鼠体重保持近相同程度的增长(P >0.05),见表1。照射后,体重明显下降,与正常对照组相比有显著性差异(P <0.01);RA 100 mg/kg 组体重下降较缓和,与IR 组呈显著差异(P <0.01)。WR-2721 组于照后第4日体重显著恢复;如表1 所示,RA 各剂量组在第6日表现出不同程度的恢复,除RA 200 mg/kg 组外,其余各组均较IR 组有显著性差异,且与WR-2721组无明显区别(P >0.05),但是RA 100 mg/kg 组恢复尤佳(P <0.001)。
实验结果表明RA 能够促进辐射损伤小鼠体重的恢复,给予小鼠迷迭香酸钠盐100 mg/kg 能够很好的减轻辐射引起的体质量下降。
3.2 不同剂量RA 对受照小鼠脏器系数的影响
γ 射线照射后,小鼠脾脏和胸腺严重受损,WR-2721 及RA 起到了保护作用,见图3。RA 100 mg/kg 对脾脏保护作用明显(P <0.01),与WR-2721组无显著性差异(P = 0. 936)。RA 50、150、200 mg/kg 等剂量亦能升高脾系数,但统计学上差异无显著性(P >0.05)。在对免疫器官胸腺的保护方面,给药组明显好于IR 组,除RA 200 mg/kg 外,其余各剂量有显著性差异,组间差异无显著性(P >0.05),但是RA 100 mg/kg 效果最好(P <0.001)。从图3、4 中可见,RA 对辐射损伤小鼠脾和胸腺的保护效果并非如预计呈剂量依赖性。
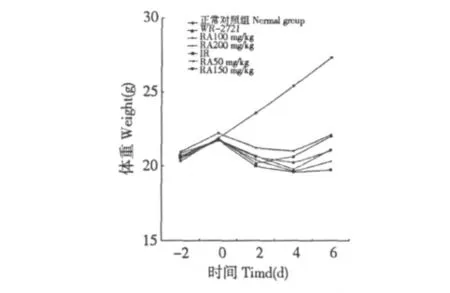
图2 137Cs γ 射线照射前2 d(-2)至照射后第6 d(+6)小鼠体重变化趋势Fig.2 Trends of mice's weight from the 2nd day before(-2)irradiation to the 6th day after irradiation(+6)
表1 RA 对辐射损伤小鼠体重的影响(n=30,±s)Table 1 Influence of RA on weight of mice exposed to 5.5 Gy γ-rays (n=30,±s)

表1 RA 对辐射损伤小鼠体重的影响(n=30,±s)Table 1 Influence of RA on weight of mice exposed to 5.5 Gy γ-rays (n=30,±s)
注:与单纯照射组(IR)比较,* P <0.05;**P <0.01;***P <0.001Note:Compare with control,* P <0.05;**P <0.01;***P <0.001
组别Group实验开始时小鼠体重(g)Weight of mice at the beginning of the experiment(g)照射后第6 天小鼠体重Weight of mice on the 6th day after irradiation(g)(g)正常对照组(Normal group)20.31 ±0.51 27.33 ±2.39 IR 20.67 ±1.03 19.72 ±1.54 WR-2721 20.57 ±0.85 22.02 ±1.98***RA 50 20.68 ±1.22 21.10 ±1.27*RA 100 20.95 ±1.04 22.12 ±1.84***RA 150 20.49 ±1.16 21.03 ±1.87*RA 200 20.85 ±1.03 20.30 ±1.30

3.3 不同剂量RA 对辐射损伤小鼠造血系统的影响
如表2 所示,5.5 Gy γ 射线照射后,小鼠造血系统严重受损,股骨DNA 含量、股骨有核细胞数目(BMNC)及外周血指标(WBC、HGB、PLT)明显低于正常组,脾脏应急反应出现结节(CFU-S)。数据显示,RA 不同剂量组均对受照小鼠造血系统有一定的保护作用。与IR 组相比,RA 能有效的升高外周血白细胞(WBC)数目,除200 mg/kg 组统计学上差异无显著性,50(P <0.01)、100(P <0.01)、150(P<0.05)mg/kg 均有显著性差异。实验给予受照小鼠RA 后,小鼠外周血载氧能力明显提高,RA 50(P<0.05)、100(P <0.01)、150(P <0.05)mg/kg 组血红蛋白(HGB)含量与IR 组相比有显著或极显著性差异,外周血血小板(PLT)含量亦显著升高(P <0.05,P <0.001,P <0.01,P <0.05)。
表2 不同剂量RA 对γ 射线损伤小鼠外周血相的影响(n=30,±s)Table 2 Influence of RA on the peripheral blood of γ-rays irradiated mice at different Concentrations (n=30,±s)
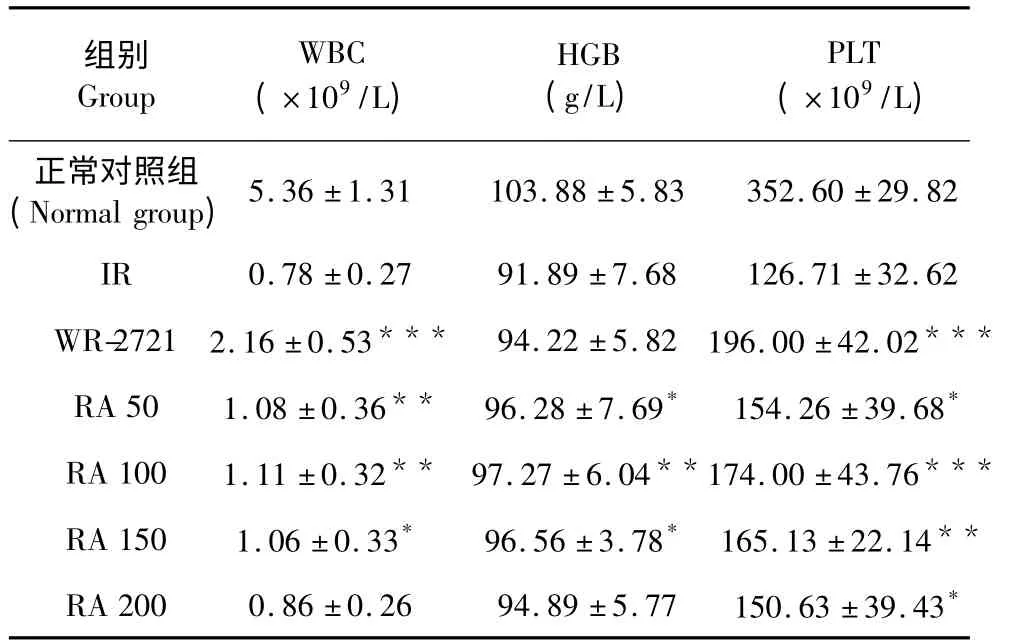
表2 不同剂量RA 对γ 射线损伤小鼠外周血相的影响(n=30,±s)Table 2 Influence of RA on the peripheral blood of γ-rays irradiated mice at different Concentrations (n=30,±s)
注:与IR 组比较,* P <0.05;** P <0.01;***P <0.001Note:Compare with control,* P <0.05;**P <0.01;***P <0.001
组别Group WBC(×109/L)HGB(g/L)PLT(×109/L)正常对照组(Normal group)5.36 ±1.31 103.88 ±5.83 352.60 ±29.82 IR 0.78 ±0.27 91.89 ±7.68 126.71 ±32.62 WR-2721 2.16 ±0.53*** 94.22 ±5.82 196.00 ±42.02***RA 50 1.08 ±0.36** 96.28 ±7.69* 154.26 ±39.68*RA 100 1.11 ±0.32** 97.27 ±6.04**174.00 ±43.76***RA 150 1.06 ±0.33* 96.56 ±3.78* 165.13 ±22.14**RA 200 0.86 ±0.26 94.89 ±5.77 150.63 ±39.43*
表3 不同剂量RA 对γ 射线损伤小鼠造血系统的保护作用(n=30,±s)Table 3 Protective effect of RA on the hematopoietic system of γ-rays irradiated mice at different concentrations (n=30,±s)
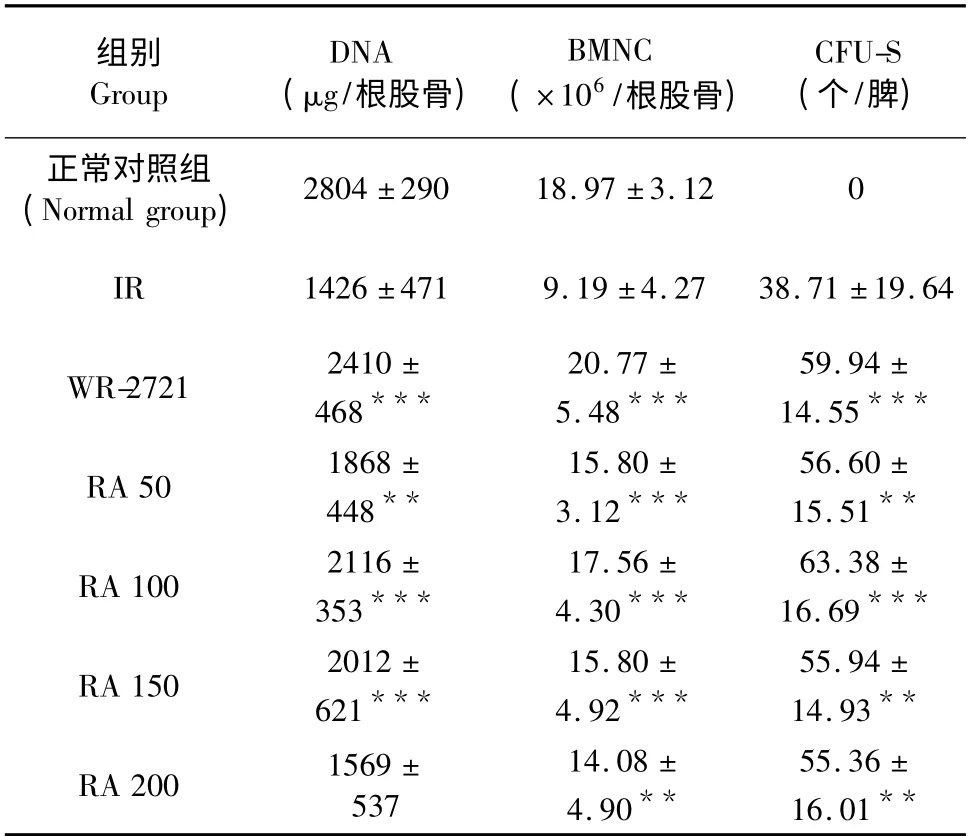
表3 不同剂量RA 对γ 射线损伤小鼠造血系统的保护作用(n=30,±s)Table 3 Protective effect of RA on the hematopoietic system of γ-rays irradiated mice at different concentrations (n=30,±s)
注:与IR 组比较,* P <0.05;** P <0.01;***P <0.001Note:Compare with control,* P <0.05;**P <0.01;***P <0.001
组别Group DNA(μg/根股骨)BMNC(×106/根股骨)CFU-S(个/脾)正常对照组(Normal group)2804 ±290 18.97 ±3.12 0 IR 1426 ±471 9.19 ±4.27 38.71 ±19.64 WR-2721 2410 ±468***59.94 ±14.55***RA 50 1868 ±448**20.77 ±5.48***56.60 ±15.51**RA 100 2116 ±353***15.80 ±3.12***63.38 ±16.69***RA 150 2012 ±621***17.56 ±4.30***55.94 ±14.93**RA 200 1569 ±537 15.80 ±4.92***14.08 ±4.90**55.36 ±16.01**
基于RA 能够如此明显的促进外周血相的恢复,我们进而探讨了RA 对造血系统的影响。研究显示RA 各剂量组的股髓DNA 含量、股髓有核细胞数(BMNC)、内源性脾结节数(CFU-S)均高于IR组,但并不呈剂量依赖性。统计学处理发现,RA 各组BMNC、CFU-S 较IR 组呈显著性差异(P <0.01),而骨髓DNA 含量,与IR 比较,除200 mg/kg外,其他剂量亦有显著性差异(P <0.01)。实验结果说明,RA 50~200 mg/kg 对辐射损伤小鼠造血系统有很好的保护作用,剂量为100 mg/kg 时,效果最佳。
4 讨论
电离辐射作用于机体后在瞬间以其很小的能量引发一系列物理、化学反应,进而产生一系列生物效应,表现出辐射损伤,如体重下降,免疫和造血等辐射敏感器官受损,活动能力降低等。胸腺和脾脏是重要的免疫器官,辐射导致的免疫障碍使机体处于对病原体及其他损伤因子的高敏抵抗状态,增加了继发感染和死亡几率。因此胸腺和脾脏的正常与否直接关乎生命安危。脾系数和胸腺系数反映了生物体免疫功能,实验中选取二者作为评价RA 对受照小鼠免疫系统影响的指标。造血系统对射线极具敏感性,骨髓是主要的造血组织,亦是辐射攻击的重要目标。骨髓受到射线照射后,在分子、细胞水平上产生多方面病理变化,造成DNA 断裂,造血干细胞急剧减少,故使外周血中白细胞、红细胞、血小板降低。而CFU-S 和BMNC 也代表了机体造血组织恢复的能力。实验中,通过测定小鼠外周血中WBC、PLT、HGB 及骨髓DNA 含量、BMNC、CFU-S 以研究不同剂量RA 对γ 射线照射后小鼠造血系统的影响。
因近年来,核能应用逐渐深入到人类生活的各个方面,“神九”等载人航天飞船升空,以及宇航员的太空行走和空间站的建立,人类受到射线辐射的几率日趋升高。目前,WR-2721(氨磷汀)是国际上普遍认可的广谱细胞保护剂,被FDA 批准与顺铂联用治疗肿瘤,但因其毒副作用严重而没有被批准为辐射防护药。研究称其能降低行为能力[3,4],对钙离子代谢的影响会加重人在太空中失重引起的低血钙[5],还有其他如恶心、呕吐、低血压等一系列副作用。因此,研制高效低毒的辐射防护剂意义重大。
实验于γ 射线照射前给小鼠连续2 d 口服不同剂量的迷迭香酸钠盐溶液(RA-Na),并于照射当天照射前20 min 再口服给药一次,5.5 Gy137Cs γ 射线一次性全身照射后,连续给药6 d。从实验中可以看出,相比单纯照射组(IR),迷迭香酸(RA)组小鼠体重于照射后第5 d 便开始恢复,而IR 组在第7 天仍不见上升,并且第7 d RA 组体重与IR 组有显著性差异。体重是机体整体状况的一个表征,迷迭香酸能够促进受照小鼠体重恢复,初步表明其有一定的抗辐射效果。试验进而发现,RA 50~200 mg/kg能够防止小鼠胸腺和脾脏系数降低,有效地保护免疫器官,这与研究称其具有免疫调节功能相映成辉[6,7]。RA 对小鼠造血系统的保护也是出乎意料,它能够显著升高辐射损伤小鼠外周血白细胞(WBC)、血小板(PLT)数目,提高血红蛋白(HGB)浓度,保护骨髓组织,避免射线导致的骨髓细胞DNA 断裂、骨髓有核细胞减少,并且促进内源性脾结节(CFU-S)形成,增强脾脏造血功能。从迷迭香酸化学结构及目前研究报道[8-10]中,我们认为试验中迷迭香酸良好的抗辐射效果与其出众的抗氧化能力相关。

图5 RA 保护辐射损伤小鼠造血功能的倒“U”形剂量-效应曲线Fig.5 The inverse U-shaped dose-response curve of RA for its protective effect on hematopoietic function of radiationinjured mice
试验中也发现,迷迭香酸100 mg/kg 防护作用最为突出,与阳性对照组效果相当,在CFU-S 指标上甚至好于阳性药物。而且对于大多数检测指标,迷迭香酸对辐射损伤小鼠的保护作用在50~200 mg/kg 范围内并不成预期的剂量依赖性,而是如图4 所示呈倒“U”字形,防护效果RA 100 >50 ≧150>200 mg/kg,即在100 mg/kg 时出现最高点,之后便开始下降。此与2005 年Pereira 等在研究迷迭香酸抗焦虑作用时发现的情况相同,出现了如图5 的倒“U”形剂量反应曲线[11,12]。我们认为这可能是由于机体不同系统对药物剂量敏感阈值不同造成的[11]。有关迷迭香酸抗辐射作用的进一步研究仍在进行中。
1 Sanchez-Campillo M,Gabaldon JA,Castillo J,et al. Rosmarinic acid,a photo-protective agent against UV and other ionizing radiations.Food Chem Toxicol,2009,47:386-392.
2 Wang SW(王淑伟),Liu XL(柳晓兰),Yu ZY(余祖胤),et al.Protective effect of rosmarinic acid on γ ray-induced micronucleus in polychromatic erythrocytes of murine bone marrow cells.J Int Pharm Res (国际药学研究杂志),2011,38:381-384.
3 Landauer MR,Davis HD,Dominitz JA,et al. Dose and time relationships on the radioprotector WR-2721 on locomotor activity in mice.Pharm Biochem Behav,1987,27:573-576.
4 Landauer MR,Davis HD,Dominitz JA,et al. Long-term effects of radioprotector WR-2721 on locomotor activity and body weight of mice following exprosure to ionizing radition.Toxicol,1988,49:315-323.
5 Glover D,Retiley L,Carmichael Kim,et al. Hypocalcemia and inhibition of parathyroid hormone secretion after administration of WR-2721 (a radioprotective and chemoprotective agent).N Engl J Med,1983,309:1137-1141.
6 Ahn SC,Oh WK,Kim BY,et al.Inhibitory effects of rosmarinic acid on Lck SH2 domain binding to a synthetic phosphopeptide.Planta Med,2003,69:642-646.
7 Lee JS,Jung ES,Koh J,et al. Effect of rosmarinic acid on atopic dermatitis.J Dermatol,2008,35:768-771.
8 Chen SZ,Fu YP,Wu RS,et al.Effects of rosmarinic acid on free radical production and lysosomal enzyme release from rat peritoneal neutrophils.Acta Pharm Sin,1999,34:881-885.
9 Kosar M,Goger F,Can Baser KH,et al. In vitro antioxidant propertries and phenolic composition of Salvia virgata Jacq.from Turkey.J Agric Food Chem,2008,56:2369-2374.
10 Del Bano MJ,Castillo J,Benavente-Garcia O,et al.Radioprotective antimutagenic effects of rosemary phenolics against chromosomal damage induced in human lymphocytes by γrays.J Agric Food Chem,2006,54:2064-2068.
11 Pereira P,Tysca D,Oliveira P,et al. Neurobehavioral and gentoxic aspects of rosmarinic acid. Pharm Res,2005,52:199-203.
12 Takeda H,Tsuji M,Inazu M,et al.Rosmarinic acid and caffeic acid produce antidepressive-like effect in the forced swimming test in mice. Eur J Pharmacol,2002,164:233-235.
