竹节参总皂苷抑制急性低压缺氧大鼠脑和心肌损伤的形态学观察
2013-09-12周湘洁牛东滨郭志刚杜学礼窦跃龙
周湘洁,牛东滨,郭志刚,王 亮,赵 琦,杜学礼,窦跃龙
1中国人民解放军总装备部后勤部航天城门诊部;2中国航天员科研训练中心,北京,100094;3清华大学化工系,北京 100084
竹节参(Panax japonicus C.A.Meyer)是五加科人参属植物,具有滋补强壮、活血化瘀、消肿止痛、健胃、祛痰、解热的功效,主治跌打损伤,筋骨疼痛,风湿痹症,是我国的一种名贵中草药。现代药理学研究表明,竹节参具有抗溃疡、保肝、镇静、镇惊、抗疲劳、损伤保护、免疫、镇痛、抗炎、抗肿瘤等多种活性[1]。有学者的研究表明,竹节参提取物能够抑制血栓的形成[2],对完全性和不完全性脑缺血、胃缺血、心肌缺血以及再灌注损伤动物模型具有保护作用[3-6];竹节参皂苷能够抑制脑及心肌缺血缺氧的损伤,减轻组织水肿,可能与其改善机体自由基代谢、干预缺血后的细胞凋亡等有关[7-10]。但有关竹节参总皂苷在抗低压缺氧方面的研究尚未见报道。
在载人航天在轨飞行中,当航天员出舱活动往返于轨道舱和气闸舱之间时,面临的风险之一就是急性低压缺氧,高原作业以及疾病发生过程中也会经常发生缺氧状况。本实验拟将大鼠暴露于模拟海拔8000 m低压缺氧舱内8 h,建立动物急性低压缺氧模型,以红景天提取物为中药阳性对照,尼莫地平为西药阳性对照,竹节参总皂苷为实验对象,通过光镜对实验动物的心脑组织细胞变化进行形态学观察,以研究急性低压缺氧对机体产生的损伤和药物的保护作用。
1 材料与方法
1.1 材料
实验动物选用Wistar大鼠,雄性,4月龄,体重195~212 g。由北京维通利华实验动物技术有限公司提供。实验动物合格证号SCXK(京)2006-0009。竹节参总皂苷,由清华大学化工系生化所利用索式提取以及制备色谱法从竹节参培养细胞中提取分离获得。尼莫地平注射液:4 mg∶20 mL,(批号:0503101,山东亚宝药业股份有限公司生产);红景天提取物(由“八一”体工队药物研究所提供)。动物加压减压实验舱:芜湖潜水设备厂生产。
1.2 动物分组设计
选取Wistar大鼠60只,随机分为5组,每组12只。即①竹节参总皂苷组,②红景天提取物组,③尼莫地平组,④阴性对照组(低压处理对照组),⑤空白对照组(常压处理对照组)。
1.3 给药方法
竹节参总皂苷与红景天提取物分别制成溶液。实验动物采用分笼饲养,每笼6只,自由采食。适应饲养4 d后,①、②、③组每日清晨灌胃给药,剂量为:①组为相当于竹节参总皂苷100 mg/kg,②组为相当于红景天提取物量100 mg/kg,③组为相当于尼莫地平1 mg/kg,④、⑤组灌胃给与等量生理盐水。动物连续灌胃给药14 d。
1.4 大鼠急性低压缺氧模型的制备方法
实验动物分组灌胃给药14 d后,于末次给药30 min后开始进行急性低压缺氧实验,将动物置于动物加压减压实验舱内(舱容积为1 m3),关闭舱门,调整舱内压力渐减,在10 min左右将舱内压力减至0.068 MPa(相当于以10 m/s上升至海拔8000 m),维持此压力8 h,制备大鼠急性低压缺氧模型,舱内温度保持为恒温16℃,完成缺氧时间后将舱内压力升至正常大气压,速度仍为10 m/s;空白对照组置于实验舱附近,于正常大气压下滞留8 h。动物出舱后30 s内迅速断头、取血、分离脑组织,进行观察、保存和检测。
1.5 组织切片样本处理
每组随机取3只大鼠,切除右侧半脑,置于4℃磷酸盐缓冲液(0.01M PBS,pH=7.3)中洗去血液,用小块纱布包裹,铅笔标记,置于10%的福尔马林溶液中,同样方法取心肌组织并保存。
1.6 脑组织含水量测定
大鼠断头取脑后,用滤纸吸去脑表面的水分,每组取9只大鼠的右侧半脑,分析天平称湿重(w),用铝箔纸分别包裹标记,置110℃烘箱内烘干24 h至恒重(D),用干湿重法(H2O)%=〔(W-D)/W ×100%〕计算每份脑组织水含量,结果用%表示。并用邓肯氏测验法对不同处理的数据进行了差异显著性分析。
1.7 细胞形态学的观察
将心肌、脑组织分别置于4℃磷酸盐缓冲液(0.01M PBS,pH=7.3)中洗去血液,用 10% 福尔马林固定。通过脱水、透明处理、浸蜡、包埋、切片、用苏木素染色液染色、水洗、伊红复染、脱水透明和树脂封固等步骤,再置于光学显微镜下观察心、脑组织细胞形态变化。
2 结果与讨论
2.1 竹节参总皂苷对Wistar大鼠脑组织含水量的影响
实验结果如表1所示,与空白对照组相比,各低压缺氧模型组Wistar大鼠的脑组织含水量均显著升高。其中竹节参总皂苷组、红景天提取物组和尼莫地平组等三个给药组的脑组织含水量没有显著性差异,但是均显著低于阴性对照组。表明竹节参总皂苷、红景天提取物和尼莫地平给药的Wistar大鼠,在低压缺氧环境下均具有抑制脑组织水肿的作用。因此可以证明竹节参总皂苷具有与红景天提取物相同的抗脑组织水肿的效果,该结果与刘家兰[4]等的实验结论基本相同。至于竹节参总皂苷抑制脑组织水肿的作用机理,可能与竹节参总皂苷具有抗氧化、抑制氧自由基生成[6,8],抑制了细胞膜脂质过氧化,改善了细胞膜的钙离子释放等作用相关。具体作用机制还有待于进一步研究。

表1 竹节参总皂苷对急性低压缺氧大鼠脑组织含水量的影响Table 1 Effect of PJTS on brain tissue water content of rat in acute hypobaric hypoxia
2.2 竹节参总皂苷对急性低压缺氧Wistar大鼠脑组织和细胞损伤的抑制效果
从脑组织外观和显微观察(图1)发现,空白对照组Wistar大鼠的脑组织形态显示脑膜血管无扩张,脑组织无肿胀;脑组织切片显示,脑各部位结构及层次明显,形态结构清晰完整,脑实质中细胞核仁清晰,神经纤维细胞纵横交错,排列致密(图1a)。而阴性对照组的形态显示,脑膜血管中度扩张,脑组织细胞极度肿胀;脑组织切片显示,脑各部位结构及层次紊乱,细胞水肿明显,胞浆变宽,淡染,排列紊乱,间质疏松水肿(图1b)。竹节参总皂苷给药组的形态显示脑膜血管轻度扩张,脑组织轻度肿胀;脑组织切片显示,脑各部位结构及层次较阴性对照组清楚,脑组织结构变化不大,细胞水肿不明显,胞浆减少,极性存在,间质轻微疏松,有少量细胞出现肿胀,胞浆有空泡化现象(图1c)。红景天提取物给药组的形态显示脑膜血管轻度扩张,脑组织轻度肿胀;脑组织切片显示,细胞有轻度水肿,细胞肿胀,间质疏松(图1d)。尼莫地平给药组的形态显示脑膜血管中度扩张,脑组织中度肿胀;脑组织切片显示,脑各部位结构及层次较阴性对照组清楚,细胞水肿较明显,部分细胞变形,胞浆减少,胞浆空泡化,间质疏松(图1e)。实验结果表明,在急性低压缺氧环境下,Wistar大鼠的脑组织和细胞会受到极大损伤。竹节参总皂苷、红景天提取物和尼莫地平给药组的Wistar大鼠虽然在急性低压缺氧环境下,其脑细胞同样受到伤害,但是与阴性对照组相比其损伤症状明显减轻。特别是竹节参总皂苷给药组的脑细胞虽然有轻度水肿,但是基本保持清晰完整。表明竹节参总皂苷在急性低压缺氧环境下可以保护Wistar大鼠脑细胞的结构和功能的完整性。

图1 竹节参总皂苷对急性低压缺氧大鼠脑组织和细胞形状的影响(光镜HE染色,×400)Fig.1 Effect of PJTS on brain tissue cell morphology of rat in acute hypobaric hypoxia(microscopy with HE staining,×400)
2.3 竹节参总皂苷对急性低压缺氧Wistar大鼠心肌组织和细胞损伤的抑制效果
从心肌组织外观和显微观察(图2)发现,空白对照组的形态显示Wistar大鼠的心肌组织无肿胀,无异常变化;组织切片显示,心肌各部位结构及层次清楚,形态结构清晰完整,心肌纤维细胞纵横交错,排列有致(图2a)。而阴性对照组的形态显示心肌膜血管中度扩张,组织肿胀;组织切片显示心肌各部位结构及层次紊乱,细胞水肿明显,细胞变形、胞浆变宽,淡染,排列紊乱,间质疏松水肿(图2b)。竹节参总皂苷给药组的形态显示心肌膜血管轻度扩张,组织轻度肿胀;组织切片显示细胞轻度水肿,心肌组织结构变化不大,有少量细胞肿胀,间质轻微疏松,胞浆有空泡化现象(图2c)。红景天提取物给药组的形态显示心肌膜血管轻度扩张,组织轻度肿胀;组织切片显示细胞有轻度水肿,肿胀,胞浆减少,极性存在,间质轻微疏松(图2d)。尼莫地平给药组的外观显示大鼠心肌膜血管轻度扩张,组织肿胀;组织切片显示细胞水肿较明显,细胞肿胀,部分细胞胞浆变宽,排列紊乱(图2e)。实验结果表明,在急性低压缺氧环境下,Wistar大鼠的心肌组织和细胞会受到极大损伤。竹节参总皂苷、红景天提取物和尼莫地平给药组的Wistar大鼠虽然在急性低压缺氧环境下,其心肌细胞同样受到一定伤害,但是与阴性对照组相比其损伤程度明显减轻。特别是竹节参总皂苷给药的心肌细胞虽然有轻度水肿,但是基本保持清晰完整。表明竹节参总皂苷在急性低压缺氧环境下,可以有效保护Wistar大鼠的心肌组织和细胞的结构以及功能的完整性。
总之,从组织和细胞的形态变化可以明显看到竹节参总皂苷在急性低压缺氧环境下,对于Wistar大鼠的脑和心肌细胞均具有良好的保护作用。至于其作用机理可能与竹节参总皂苷具有抗氧化、清除氧自由基,维护细胞膜通透性,抑制脑和心肌缺血损伤密切相关[3-10],但是由于竹节参总皂苷中含有竹节参皂苷、人参皂苷和三七皂苷等,其保护效果不是某单一物质在起作用,而是多种皂苷类化合物综合作用的结果。如果要彻底解析其作用机制,还需要进一步深入探讨。
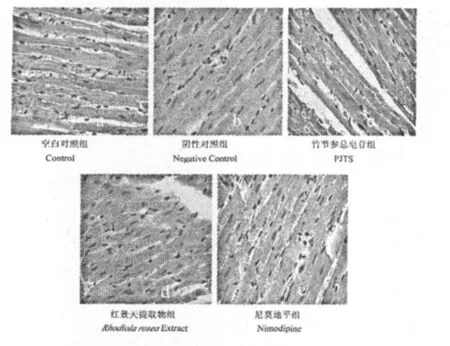
图2 竹节参总皂苷对急性低压缺氧大鼠心肌组织细胞形态的影响(光镜HE染色×400)Fig.2 Effect of PJTS on myocardial tissue cell morphology of rat in acute hypobaric hypoxia(microscopy with HE staining,× 400)
1 Ouyang LN(欧阳丽娜),Xiang DW(向大位),Wu X(吴雪),et al.竹节参化学成分及药理活性研究进展.Chin Tradit Herb Drugs(中草药),2010,41:1023.
2 Matsuda H,Samukawa K,Fukuda S.Studies of Panax japonicas fibrinolysis.Plant Med,1989,55:18.
3 Liu JL(刘家兰),Li DQ(李德清),Liu H(刘红).Protcvtive effect of Panax japonicus C.A.meyer extractive on myocardial ischemic damage in mice.J Hubei Univ Nationalities,Med(湖北民族学院学报,医学版),1999,16:6.
4 Liu JL(刘家兰),Li DQ(李德清),Duan XY(段先宇).Protection of Panax japonicus extract against mice and rats cerebral ischemia reperfusion injury.J Hubei Univ Nationalities,Med(湖北民族学院学报,医学版),2002,19:35.
5 Liu H(刘红).Protective effect of Panax japonicus extracts experimental cerebral ischemia.J Hubei Univ Nationalities,Med(湖北民族学院学报,医学版),2000,17:12.
6 Liu H(刘红).Effect of Panax japonicus in protecting gastric Ischemia-reperfusion injury.J Hubei Univ Nationalities,Med(湖北民族学院学报,医学版),2002,19(2):1.
7 Min J(闵静),Ao MZ(敖敏章).Effect of total saponins of Panax japonicus on immunological function.Lishizhen Medicine and Materia Medica Res(时珍国医国药),2007,18:2784.
8 Min J(闵静),Ao MZ(敖敏章),Hu J(胡菁),et al.Experimental research on anti-oxidation effect of total saponins of Panax japonicus.J Hubei Voca-Tech Col(湖北职业技术学院学报),2007,10:110.
9 Jia ZH(贾占红),Zhao H(赵晖).Effects of TSPJ on neuronal apoptosis and related gene expression in rat cerebral ischemia-reperfusion injury.Chin J Exp Traditl Med Form(中国实验方剂学杂志),2011,17:168.
10 Zhao H(赵晖),Li J(李佳),Liu NC(刘南岑),et al.Effects of total rhizoma Panacis japonica saponins on injury and antioxidase activities in rats brain with focal cerebral ischemia.Chin J New Drugs Clin Rem(中药新药与临床药理),2007,18:445.
