人类CD8 + 记忆T 细胞体外扩增方法的研究*
2013-12-23罗海华郭学敏
罗海华, 周 南, 张 旭, 郭学敏, 张 辉, 刘 超
(中山大学人类病毒学研究所,热带病防治研究教育部重点实验室,广东 广州510080)
艾滋病和恶性肿瘤是目前威胁人类生命安全的两大重要疾病[1-2]。将艾滋病患者或肿瘤患者体内的CD8+T 细胞分离出来,体外扩增后再输回患者体内进行过继性免疫治疗在临床应用的前景非常广阔,但CD8+效应T 细胞的寿命较短,无法在体内维持长时间的免疫应答。因此,寿命较长的CD8+记忆T 细胞正在成为过继性免疫治疗中的主要细胞,得到越来越多的重视与应用。目前,体外扩增CD8+记忆T 细胞的方法主要包括:用白细胞介素(interleukin,IL)-15 刺激CD8+记忆T 细胞的体外扩增[3];用结合了anti-CD3 抗体和anti-CD28 抗体的磁珠体外扩增具有抗原特异性的CD8+记忆T 细胞[4];用抗原提呈细胞体外激活CD8+记忆T 细胞[5]。
本研究选取了6 种刺激人类CD8+记忆T 细胞体外扩增的刺激物(anti-CD3 抗体、anti-CD28 抗体、CD70、IL-2、IL-7 和IL-15),并对其进行排列组合,设计出了63 种刺激方式,如此大规模的组合,在同类研究中尚属首次。通过多次实验比较,本研究探索出了一种理想的组合方式可有效地体外扩增人类CD8+记忆T 细胞,从而为抗病毒与抗肿瘤的过继性免疫治疗提供了新的手段。
材 料 和 方 法
1 材料
正常人的外周血由广州市血液中心提供。
2 主要试剂与溶液
抗人CD45RA(isoforms of CD45 containing the A exon,含有外显子A 的CD45 亚型)抗体-FITC(fluorescein isothiocyanate,异硫氰酸荧光素)、抗人CD8抗体-APC(allophycocyanin,别藻蓝蛋白)和抗人CCR7 抗体-PE(phycoerythrin,藻红蛋白)均购自BD Pharmigen;单克隆抗人CD3ε 抗体、单克隆抗人CD28 抗体、CD70、重组人IL-2、重组人IL-7 和重组人IL-15 均购自RD。人淋巴细胞分离液购自中国医学科学院生物工程研究所;RPMI -1640 培养基购自Invitrogen;胎牛血清购自Gibco。
PBS 溶液:称取8 g NaCl、0. 2 g KCl、3. 58 g NaH2PO4·12H2O 和0.24 g KH2PO4,用800 mL 溶解,HCl 调pH 至7.4,定容至1 000 mL,高压灭菌,室温保存。
4%台盼蓝母液:称取4 g 台盼蓝,加少量双蒸水研磨,再加双蒸水定容至100 mL,过滤,于4 ℃保存,使用时用PBS 溶液稀释成0.4%台盼蓝溶液。
3 主要仪器
生物安全柜(Thermo Scientific);水平转子离心机(Eppendorf Centrifuge 5810R);微量移液器(Eppendorf);倒置生物显微镜(Leica);血球计数板(上海市求精生化试剂仪器有限公司);20 mL 注射器(北京颇赛科技发展有公司);流式细胞仪(Becton Dickinson);CO2培养箱(Thermo Scientific);电子分析天平(Acculab ALC-210.4);pH 计(雷磁PHS-25);定时恒温磁力搅拌器(雷磁JB-3 型)。
4 主要方法
4.1 细胞分离 从正常人外周血中分离外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)(准备2 支20 mL 注射器,5 支50 mL 离心管,分别编号为1、2、3、4 和5 号;用注射器向1 号和2 号离心管中加入25 mL 人淋巴细胞分离液;用注射器吸取10 mL 正常人外周血,加入到3 号离心管中,再加入40 mL PBS 溶液,混匀;用吸管向1 号和2 号离心管中各加入25 mL 混匀的外周血与PBS 的混合液;20 ℃、2 000 r/min 离心25 min;小心吸出PBMCs,加到4 号和5 号离心管中,并加入3 ~5 倍体积的PBS 溶液;20 ℃、300 ×g 离心10 min;弃上清液,再向1 号和2 号离心管中加入50 mL PBS 溶液,重悬混匀;20 ℃、300 ×g 离心10 min;弃上清液,用RPMI-1640 培养基定容至10 mL;用血球计数板进行细胞计数;置于37 ℃、CO2培养箱中进行培养);随后,用抗人CD8 抗体-APC 对PBMCs 进行标记,并用流式细胞术分选出纯度达到99%的CD8+T 细胞。
4.2 细胞培养 将分选出来的CD8+T 细胞悬浮于含10%胎牛血清的RPMI-1640 培养基中,均匀铺于96 孔板中(每孔细胞数为1 ×105);将细胞培养板置于5% CO2、饱和湿度及37 ℃的细胞培养箱中培养。
4.3 用63 种刺激组合体外扩增人类CD8+T 细胞
将6 种刺激因子进行排列组合,得到63 种刺激组合。本实验所用的6 种刺激因子的浓度分别为:anti-CD3 抗体(1 mg/L)、anti-CD28 抗体(1 mg/L)、CD70(50 μg/L)、IL-2(10 μg/L)、IL-7(10 μg/L)、IL-15(10 μg/L)。将铺板后的CD8+T 细胞分成2 组:实验组和对照组;对实验组的CD8+T 细胞分别施加以上63 种刺激,并在细胞培养的第4 天、第7 天和第10 天施加同样方式的刺激;在细胞培养的第7 天将CD8+T 细胞从96 孔板转移到24 孔板,并将培养基体积由0.2 mL 扩大到1 mL;在细胞培养的第14 天,用血球计数板和台盼蓝染色法对每孔的活细胞进行计数,并按照公式(1)计算63 种刺激组合下的CD8+T 细胞的体外扩增倍数;根据实验结果,选出最有利于CD8+T 细胞体外扩增的6 种刺激方式,进行下一步针对CD8+T 细胞、CD8+中枢记忆T 细胞(central memory T cells,TCM)和CD8+效应记忆T 细胞(effector memory T cells,TEM)TEM 的体外扩增实验。

4.4 用优选的6 种刺激方式体外扩增CD8+T 细胞、CD8+中枢记忆T 细胞和CD8+效应记忆T 细胞
从正常人外周血中分离出PBMCs,继而通过流式细胞仪从中分选得到纯度达到99% 的CD8+T 细胞;对分选出的CD8+T 细胞进行抗体标记(抗人CD8 抗体-APC),随后,用流式细胞术检测CD8+TCM 和CD8+TEM 在CD8+T 细胞中所占的比例;将分选出来的CD8+T 细胞分成实验组和对照组,均匀铺在96 孔板中(每孔细胞数为1 ×105)。对实验组的CD8+T 细胞施加优选的6 种刺激,在细胞培养的第14 天,用血球计数板和台盼蓝染色法,对每孔的活细胞进行计数;在对实验组中的CD8+T 细胞进行抗体标记后,用流式细胞仪检测CD8+T 细胞的纯度,以及其中TCM 和TEM 所占的比例;用公式(1)、公式(2)和公式(3)分别计算在6 种优化的刺激方式作用下,培养14 d 后的CD8+T 细胞、CD8+TCM 和CD8+TEM 的体外扩增倍数,进而筛选出最为理想的刺激方式。

5 统计学处理
用SPSS 13.0 统计软件分析。数据采用均数±标准差(mean ±SD)表示,多组间数据的两两比较采用最小显著性差异t 检验法(LSD-t 检验)。以P <0.05 为差异有统计学意义。
结 果
1 CD8+ T 细胞的纯度检测
从正常人外周血中分离出PBMCs,再用抗人CD8 抗体-APC 对PBMCs 进行标记,并用流式细胞术分选出纯度达到99%的CD8+T 细胞,见图1。
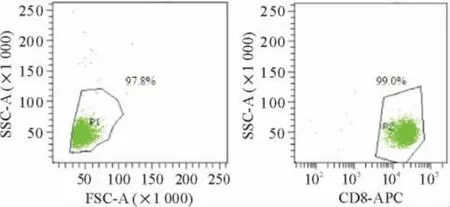
Figure 1. Purity of human CD8 + T cells after sorting.Human PBMCs were isolated and labeled with anti-human CD8-APC antibody and sorted by FACS. Then the purity of human CD8 + T cells after sorting was examined. Three donors were examined and only one was shown.图1 分选后人类CD8 + T 细胞的纯度
2 63 种刺激方式对人类CD8+ T 细胞体外扩增的影响
对分选出的人类CD8+T 细胞施加63 种刺激,并培养14 d,最后进行细胞计数。由公式(1)计算出63 种刺激方式作用下的人类CD8+T 细胞的体外扩增倍数,见图2。
结果表明,有6 种刺激方式使CD8+T 细胞体外扩增的倍数达到4 倍以上,它们分别是:anti-CD3 抗体、IL-2 和IL-7 三者的组合;anti-CD3 抗体、IL-2、IL-7 和IL-15 四者的组合;anti-CD3 抗体、anti-CD28 抗体、CD70、IL-7 和IL-15 五者的组合;anti-CD3 抗体、anti-CD28 抗体、IL-2 和IL-7 四者的组合;anti-CD3 抗体、anti-CD28 抗体、IL-2 和IL-15 四者的组合;anti-CD3 抗体、CD70、IL-2 和IL-15 四者的组合。由于如此大规模的组合对于抗体与细胞因子的消耗巨大,因此,受到实验条件的限制,该轮筛选样本数n=1。
3 CD8+ TCM 和CD8+ TEM 纯度和所占比例的检测
随机选取3 份正常人外周血样术,从中分离出PBMCs,再分选出纯度达到99%的CD8+T 细胞。对分选出的CD8+T 细胞进行抗体标记(抗人CD8 抗体-APC、抗人CD45RA 抗体-FITC 和抗人CCR7 抗体-PE),检测其中CD8+TCM 和CD8+TEM 所占的比例,见图3、表1。结果表明,3 个不同个体外周血中CD8+TCM 和CD8+TEM 所占的比例差异较大,这可能会导致不同个体的CD8+记忆T 细胞对同等体外刺激的应答产生较大的差别。
4 优选的6 种刺激方式对CD8+ TCM 和CD8+TEM 体外扩增的影响
将优选的6 种刺激方式进一步用于体外扩增人类CD8+T 细胞、CD8+TCM 和CD8+TEM,培养14 d后,检测CD8+T 细胞的纯度以及其中TCM 和TEM所占的比例,并用血球计数板和台盼蓝染色法对活细胞进行计数,结果见表2。由公式(1)和公式(2)计算在6 种刺激方式作用下,培养14 d 后CD8+TCM 的体外扩增倍数见图4。结果表明,与对照组(mock)相比,anti-CD3 抗体、IL-2 和IL-7 三者的组合使CD8+TCM 体外扩增的倍数最多(13.28 倍),2 组差异有统计学意义(P <0.01)。
由公式(1)和公式(3)计算在6 种刺激方式作用下,培养14 d 后的CD8+TEM 的体外扩增倍数见图5。结果表明,anti-CD3 抗体、IL-2 和IL-7 三者的组合使CD8+TEM 体外扩增倍数最多(15.27 倍),与对照组(mock)相比,差异有统计学意义(P <0.01)。
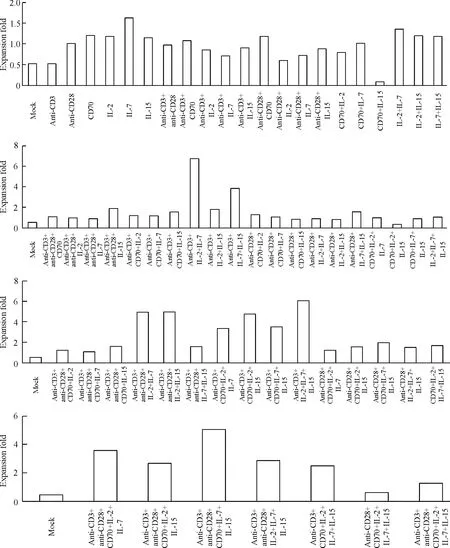
Figure 2. Effects of 63 kinds of stimulating combinations on human CD8 + T cell expansion in vitro.Six kinds of stimuli (anti-CD3 antibody,anti-CD28 antibody,CD70,IL-2,IL-7 and IL-15)for the expansion of human CD8 + T cells in vitro were selected and arranged for their combinations,resulting in 63 kinds of stimulating combination. Normal human CD8 + T cells were isolated and exposed to a variety of stimuli. After 14 days of cell culture,the numbers of CD8 + T cells were detected.图2 63 种刺激组合对人类CD8 + T 细胞体外扩增的效果

Figure 3. Purity of CD8 + T cells and percentages of CD8 + TCM and CD8 + TEM after sorting. A:normal human CD8 + T cells were sorted by FACS and the purity of CD8 + T cells was examined;B:normal human CD8 +T cells were sorted by FACS and the percentages of CD8 + TCM and CD8 + TEM were also detected. Three donors were examined and only one was shown.图3 分选出的CD8 + T 细胞的纯度以及CD8 + TCM 和CD8 + TEM 所占的比例

表1 分选出的CD8 + T 细胞的纯度以及CD8 + TCM 和CD8 + TEM 所占的比例Table 1. Purity of CD8 +T cells and percentages of CD8 + TCM and CD8 + TEM after sorting (%.Mean±SD.n=3)
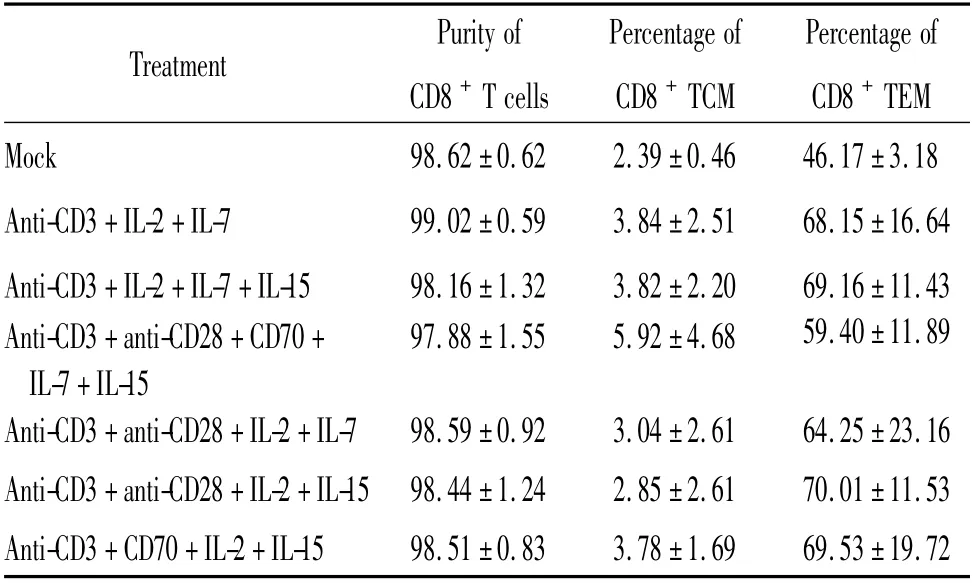
表2 培养14 d 后CD8 + T 细胞的纯度以及CD8 + TCM 和CD8 + TEM 所占的比例Table 2. Purity of CD8 + T cells and percentages of CD8 + TCM and CD8 + TEM after 14 days (%.Mean±SD.n=3)
讨 论
近年来过继性免疫治疗在临床上得到越来越广泛的应用。如何更好地实现T 细胞的体外扩增,是提高过继性免疫治疗疗效的一大难点。目前一些研究人员在体外使用人工抗原提呈细胞,促进T 细胞的增殖,但仍然存在临床治疗的成本较高且安全性难以保证等问题。在本研究中,我们选取了6 种刺激人类CD8+记忆T 细胞体外扩增的刺激物(anti-CD3 抗体、anti-CD28 抗体、CD70、IL-2、IL-7 和IL-15),并对其进行排列组合,设计出了63 种刺激方式,并优选出6种刺激方式进行后续实验。研究表明,在体外培养14 d 的条件下,与对照组(mock)相比,anti-CD3 抗体、IL-2 和IL-7 三者的组合使CD8+TCM 和CD8+TEM 体外扩增的倍数最多,分别为13.28 倍和15.27 倍。
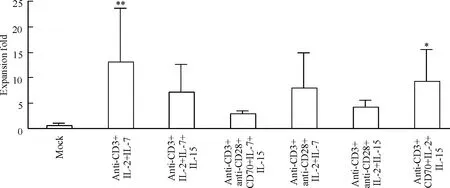
Figure 4. Effects of 6 kinds of stimulating combinations on human CD8 + TCM cell expansion in vitro. Mean ±SD. n = 3. * P <0.05,**P <0.01 vs mock.图4 6 种刺激组合对人类CD8 + TCM 体外扩增的影响
Anti-CD3 抗体能够激活T 细胞并促进其增殖。在T 细胞被激活后,IL-2 受体α 就会迅速而大量地上调,并且T 细胞可以自分泌IL-2,来促进自身的增殖。IL-7 具有促进T 细胞增殖和维持CD8+记忆T细胞存活的作用,并且能够上调抗凋亡蛋白Bcl-2 的表达。因此,用anti-CD3 抗体、IL-2 和IL-7 三者组合刺激CD8+记忆T 细胞,可激活其增殖和存活的信号通路,从而促进其体外扩增。
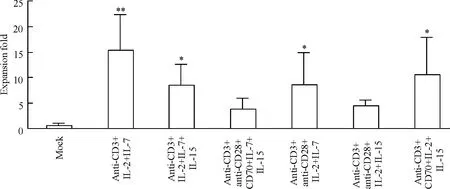
Figure 5. Effects of 6 kinds of stimulating combinations on human CD8 + TEM cells expansion in vitro.Mean±SD. n=3. * P <0.05,**P <0.01 vs mock.图5 6 种刺激组合对人类CD8 + TEM 体外扩增的影响
CD8+记忆T 细胞包括CD8+TCM 和CD8+TEM。CD8+TCM 表达CD62L 和CCR7,主要分布在淋巴组织,能够迅速增殖分化为CD8+效应T 细胞;CD8+TEM 不表达CD62L 和CCR7,主要分布在外周组织,能够对再次感染产生迅速的免疫反应[6]。因此,体外大量扩增CD8+记忆T 细胞,对于提高过继性免疫治疗的效果具有重要意义。本研究表明,anti-CD3 抗体、IL-2 和IL-7 三者的组合,是刺激人类CD8+记忆T 细胞体外扩增的理想方法,为抗病毒与抗肿瘤的过继性免疫治疗提供了新的手段。
[1] 黄秀艳,曾耀英. 艾滋病发病学研究进展与药物和疫苗研发新策略[J]. 中国病理生理杂志,2008,24(9):1861-1864.
[2] Dudley ME,Wunderlich JR,Robbins PF,et al.Cancer regression and autoimmunity in patients after clonal repopulation with antitumor lymphocytes[J]. Science,2002,298(5594):850-854.
[3] Kanegane H,Tosato G. Activation of naive and memory T cells by interleukin-15[J]. Blood,1996,88 (1):230-235.
[4] Kalamasz D,Long SA,Taniguchi R,et al. Optimization of human T-cell expansion Ex Vivo using magnetic beads conjugated with anti-CD3 and anti-CD28 antibodies[J]. J Immunother,2004,27(5):405-418.
[5] Butler MO,Friedlander P,Milstein MI,et al. Establishment of antitumor memory in humans using in vitro-educated CD8+T cells[J]. Sci Transl Med,2011,3(80):80ra34.
[6] 吴长有.初始和记忆T 细胞的研究进展[J].现代免疫学,2005,25 (5):353-356.
