老年高血压合并不同程度下肢动脉粥样硬化危险因素的分析
2013-12-23张兴凯冯菁宋熔张作鹏党晓丽郭玉周侯晓平付金喜
张兴凯,冯菁,宋熔,张作鹏,党晓丽,郭玉周,侯晓平,付金喜
下肢动脉粥样硬化性疾病(lower extremity atherosclerosis,LEAD)是因动脉粥样硬化造成下肢动脉狭窄或者闭塞,使下肢组织急慢性缺血而导致下肢运动功能受损。近年来随着动脉硬化患者不断增多,LEAD的检出率也呈现明显上升趋势[1]。老年患者高血压发病率高,同时合并LEAD的比例也较高,这部分患者多同时存在导致动脉粥样硬化的危险因素,如高龄、血脂异常、吸烟、糖尿病等,以上高危因素是如何影响高血压合并不同程度下肢动脉粥样硬化的发生、发展尚不得而知。因此,本研究将通过比较不同程度LEAD的老年高血压患者存在的高危因素差异,寻找危险因素,为老年高血压合并LEAD的预防和治疗工作提供依据。
1 资料和方法
1.1 研究对象 纳入2010年1月~2012年1月在解放军第五医院就诊的老年原发性高血压合并LEAD的患者129例为研究对象。纳入标准:①年龄>60岁;②自愿参与本项研究,签署知情同意书;③符合2005年高血压病防治指南诊断标准[2]:安静休息10 min后不同时间段平均两次测得的动脉收缩压和(或)舒张压增高(≥140/90 mmHg);④符合LEAD诊断标准[3]:下肢慢性缺血症状(足温低、毛发少、足部皮肤紫、间歇性跋行和(或)下肢静息痛)、股动脉可闻及血管杂音、足背动脉或胫后动脉搏动减弱或消失;静息ABI<0.90,或脚趾/上臂血压比(TBI)<0.60,或运动后ABI下降20%;超声多普勒检查和其他影像学检查(CT血管成像、MRA、血管数字减影造影)显示下肢动脉硬化狭窄或闭塞性疾病(符合以上任意一条)。排除标准:①继发性高血压、多发性大动脉炎、大动脉周围炎、血管闭塞性脉管炎等;②自身免疫性疾病、雷诺氏病、糖尿病足、白血病等;③严重肝肾功能下降、恶性肿瘤等。
1.2 研究方法
1.2.1 血压测量 受检者至少休息15 min,精神放松,受检前15 min停止吸烟。用标准汞柱血压计于右臂一次测压3遍,取3次读数的平均数作为血压值。
1.2.2 ABI测量 被检查者在安静环境中去枕仰卧于检查床,将四肢血压袖带分别缚于下肢踝部及上肢肱部,上臂袖带气囊对准肱动脉,下肢袖带下缘距内踝1~2 cm,松紧度适中,同时在患者的胸骨左缘第4肋间放置测量心音的微音器。采用全自动动脉硬化测试仪(日本科林公司)测量ABI值。依据ABI将研究对象分为轻度组(0.7<ABI<0.9)、中度组(0.4<ABI<0.7)和重度组(ABI<0.4)。
1.2.3 血脂血糖检测 受检者在检查前一天禁止吸烟、清淡饮食,检查前一天晚禁食8 h以上后于检查当日清晨6 h空腹抽肘静脉血3 ml,检测血糖、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、血浆纤维蛋白原(FIB)等。
1.3 统计方法 采用SPSS16.0进行统计学分析,服从正态分布的资料采用“均数±标准差”表示,三组及以上计量资料的比较采用单因素方差分析(ANOVA),率的比较采用χ2检验,以P<0.05认为差异具有统计学意义。
2 结果
2.1 三组患者各项指标比较 三组患者在高血压病程、ABI、脉压、糖尿病病程、TG、FIB存在统计学差异(P均<0.05),在其余各项比较中不存在统计学差异((P>0.05,表1)。
2.2 ABI与老年高血压合并LEAD的高危因素的逐步logistic回归分析 为了便于研究,将重度组与中度组的ABI值合并,并在logistic回归方程中设为Y=1,即发生ABI显著降低,而将轻度组设为Y=0,即ABI未显著降低。随后采用逐步logistic回归(stepwise)的方法,进入方程的水平设为α=0.05,剔除水平β=0.05,结果仅四个变量进入方程,其中变量“高血压病程”的OR值为3.455,95%CI为1.024~19.231,是导致ABI显著减低的最主要危险因素(表2)。
3 讨论
近年来,老年原发性高血压与LEAD的发病率均呈上升趋势,LEAD表现为下肢动脉狭窄甚至闭塞,使下肢组织急慢性缺血而出现间歇性跋行和(或)静息痛等临床表现,严重影响老年人生活质量。本研究采用ABI来诊断LEAD与疾病严重程度之间具有很好的相关性[5],从而为研究原发性高血压合并LEAD的高危因素奠定基础。
原发性高血压是冠心病、脑卒中、动脉粥样硬化等心血管疾病的重要危险因素。由于凝血-纤溶系统平衡失调和内皮细胞受损是动脉粥样硬化的始动因素,当高血压时,血流对血管壁的机械冲击作用造成内皮细胞损伤,激活单核-巨噬细胞系统并释放炎症因子、促使单核细胞向内膜浸润、引起炎症反应及血小板、脂质聚集,促使动脉粥样硬化性疾病的发展。此外,受损的内皮细胞还可促进成纤维细胞和平滑肌细胞增生,血管壁通透性增加,脂质侵入并形成泡沫细胞,两者相互影响,促使动脉粥样硬化形成并发展。
本研究显示,老年高血压合并LEAD患者中,随着ABI程度的逐渐加重,高血压病程与脉压均具有逐渐增加的趋势。高血压病程在三组比较中具有显著差异(F=9.230,P<0.001),脉压同样在三组中具有统计学差异(F=3.101,P=0.048)在逐步logistic回归中发现,高血压病程是导致ABI显著减低的最主要危险因素(OR=3.455,95%CI:1.024~19.231)。高血压病程长及(或)脉压增宽时可能导致患者动脉中层结构排列紊乱,弹力纤维变薄、断裂,平滑肌增厚,胶原纤维增加,钙质沉积从而导致动脉硬化的发生,并且程度严重。由于老年患者高血压较中青年患者更具有脉压增大的特点,脉压增大对血管壁的剪切力增加、弹力纤维容易断裂,并引起内皮缺血、缺氧,导致内皮细胞功能障碍,一氧化氮与血管内皮素的平衡被打破[6]。另外,脉压增宽还可调节内皮细胞分泌,使原本内皮细胞通过分泌各种生物活性物质而发挥调节血管弹性、调控血管平滑肌增殖的作用丧失。因此,脉压增宽显著影响患者的血管功能及代偿作用,随着高血压病程的延长及(或)脉压增大可使老年高血压合并LEAD患者的病情愈发加重。

表1 三组患者各项临床指标和血清生化指标的检测结果
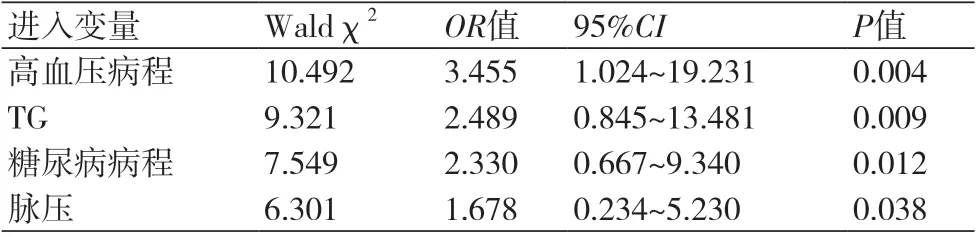
表2 ABI与各项高危因素的逐步logistic回归分析
在西方国家的高脂血症的患者中,TC和LDL-C与动脉硬化关系最为密切,而HDL-C水平在动脉硬化中的起保护作用。在我国患者中,TG升高对动脉粥样硬化、冠心病及其他心血管疾病中发挥着重要的作用。高TG意味着含高胆固醇的乳糜微粒及VLDL-C的增加[7]。乳糜微粒同样是导致动脉粥样硬化斑块形成的主要机制。另外,TG还可损伤血管内皮、促进血栓形成、抑制纤维蛋白溶解系统、促进炎症反应等而致动脉硬化[8]。由此可见,血脂异常变化对LEAD的发生和发展同样至关重要。本研究发现,TG水平在三组中存在显著差异(F=6.592,P<0.001),同时也是导致ABI显著增高的危险因素之一(OR=2.489,95%CI:0.845~13.481)。
糖尿病在各种心、脑、肾、血管等严重并发症的发展过程中的作用至关重要。长期高血糖可使血管内皮细胞的膜蛋白因高血糖环境而产生糖基化,在这种糖基化终产物形成过程中可产生大量自由基直接损伤内皮细胞,从而成为动脉粥样硬化的始动环节。另外,糖尿病患者糖化血红蛋白(HbA1C)含量增高,血红蛋白携氧能力下降,以上因素可使内皮缺血、缺氧、受损,最终导致血管内皮功能障碍、血管收缩、痉挛等改变,进而导致LEAD的发生。此外,糖尿病患者由于胰岛素抵抗常合并有血脂代谢异常、酸碱电解质紊乱、血小板形态和功能异常及血液高凝状态等变化,并因此导致末梢血管的病变,随着病程延长,促进LEAD临床症状进一步加重。本研究显示,糖尿病是ABI显著降低的重要危险因素(OR=2.330,95%CI:0.667~9.340)。
综上所述,随着老年高血压患者高血压病程延长、脉压增大、糖尿病病程延长、高TG血症发生LEAD的危险性显著增加。临床医师需重视该问题,并通过相应治疗控制高血压、合并LEAD关注血糖和血脂,以降低LEAD的发生率。
[1] Zheng ZJ,Rosamond WD,Chambless LE,et al. Lower extremity arterial disease assessed by ankle-brachial index in a middle-aged population of African Americans and whites: the Atherosclerosis Risk in Communities (ARIC) Study[J]. Am J Prev Med,2005 (5 Suppl 1):42-9.
[2] 中国高血压防治指南修订委员会. 200年中国高血压防治指南(试用本). 中华心血管病杂志,2004,32(12):1060-4.
[3] 中华医学会老年医学分会,中华医学会心血管病学分会. 下肢动脉粥样硬化性疾病诊治中国专家建议(2007). 中华老年医学杂志,2007,26(10):725-40.
[4] Fiz JA,Morera J,Monsonis JV,et al. Systemic inflammation in 222.841 healthy employed smokers and nonsmokers: white blood cell count and relationship to spirometry[J]. Tob Induc Dis,2012,10(1):7.
[5] Zhang H,Li XY,Si YJ,et al. Manifestation of lower extremity atherosclerosis in diabetic patients with high ankle-brachial index[J]. Chin Med J (Engl),2010,123(7):890-4.
[6] Karwowski W,Naumnik B,Szczepański M,et al. The mechanism of vascular calcification-a systematic review[J]. Med Sci Monit,2012,18(1):RA1-11.
[7] Kohli P,Cannon CP. Triglycerides: how much credit do they deserve[J]? Med Clin North Am,2012,96(1):39-55.
[8] Dallinga-Thie GM,Dullaart RP,van Tol A. Derangements of intravascular remodeling of lipoproteins in type 2 diabetes mellitus: consequences for atherosclerosis development[J]. Curr Diab Rep,2008,8(1):65-70.
