外源MeJA胁迫对盐生杜氏藻生理生化特性的影响
2013-12-21龚一富刘晓丹潘益芳刘增美朱天艺
章 丽, 龚一富, 刘晓丹, 潘益芳, 刘增美, 朱天艺
(宁波大学 海洋学院 应用海洋生物技术教育部重点实验室, 宁波 315211)
盐生杜氏藻(Dunaliellasalina)是一种耐盐能力极强的单细胞绿藻,其体内能合成并积累具有强抗氧化活性的次生代谢产物——β-胡萝卜素,是研究β-胡萝卜素积累的一种模式生物。目前国内外大量研究都集中在培养条件对盐生杜氏藻β-胡萝卜素积累的影响,特别是光照、温度、缺氮等培养条件能显著影响β-胡萝卜素的合成和积累[1-3],而对其它诱导因子对β-胡萝卜素积累报道较少[4],朱颖等报道添加茉莉酸甲酯(Methyl jasmonate,MeJA)等外源诱导子也可提高盐生杜氏藻β-胡萝卜素的含量[4]。MeJA是近年来研究极为热门的一类芳香类植物生长调节物质,是茉莉酸类物质的代表,MeJA广泛存在于高等植物体内,对植物的生长发育、抵抗逆境胁迫(抗盐、抗旱、抗寒等)、抗病和次生代谢产物积累等方面具有十分重要的作用[5-8],特别是MeJA对植物次生代谢产物的积累和诱导作用研究是目前研究的热点,MeJA已广泛应用于陆地上植物的次生代谢产物的积累研究和应用中。MeJA促进次生代谢产物积累的机制可能是通过诱导防御反应或次生代谢合成途径中关键酶基因的表达来提高紫杉醇、长春花碱、银杏内酯、类胡萝卜素等代谢产物的产生和积累[8-13],但系统研究MeJA在诱导次生代谢物质积累过程中的光合特性、保护酶活性等生理生化机理方面的报道较少。因此,本研究以盐生杜氏藻为材料,研究不同浓度MeJA胁迫处理对盐生杜氏藻 β-胡萝卜素含量、叶绿素含量、POD活性、SOD活性的影响,探讨MeJA胁迫下盐生杜氏藻的生理生化效应,为今后进一步深入开展β-胡萝卜素合成调控和提高β-胡萝卜素含量研究提供理论依据。
1 材料和方法
1.1 实验材料
盐生杜氏藻(DunaliellaSalina)藻种由宁波大学海洋工程重点实验室微藻室提供,用PKS培养基(pH值7.5)培养并保存。盐藻可在20~320 g/L的NaCl培养液中生存,当NaCl浓度为60~120 g/L时生长较快,因此本实验采取100 g/L NaCl条件下培养,接种初始密度为105个/mL。盐藻培养温度为25℃±0.5℃,明暗周期比12 h∶12 h,光照强度为4000 lx,静置培养。
1.2 MeJA处理及取样
接种初始密度为105个/mL的对数生长期盐生杜氏藻细胞到新鲜的PKS液体培养基上光照静止培养,培养2 d后,分别向培养瓶中添加不同体积的MeJA母液,使培养瓶中MeJA终浓度分别为0、50、100、200和500 μmol/L,每个外源MeJA胁迫组设3个重复组。MeJA胁迫处理后每2 d取各处理组样品20 mL,4000 r/min离心20 min,弃上清,将沉淀保存于-20℃冰箱中,用于后续测定盐生杜氏藻β-胡萝卜素和叶绿素的含量。MeJA胁迫处理后0、6、12、24、48和72 h分别取样,离心保存于-20℃冰箱,用于测定盐生杜氏藻POD酶活性和SOD酶活性。
1.3 β-胡萝卜素和叶绿素含量的测定
从冰箱中取出盐生杜氏藻各处理组样品,加入适量95%乙醇溶液提取β-胡萝卜素和叶绿素,离心取上清,沉淀用95%乙醇再重复提取2次,合并各次提取液,定容到25 mL容量瓶中,在722型分光光度计上测定450 nm、649 nm和665 nm处的光吸收值,即OD450、OD649和OD665。
根据Jensen公式换算出盐生杜氏藻藻液中的β-胡萝卜素及叶绿素的含量[10]。β-胡萝卜素含量(mg/L) =OD450× 提取液的体积(mL) × 稀释倍数 × 103/2500。叶绿素浓度(mg/L) = 叶绿素a浓度 + 叶绿素b浓度。叶绿素a浓度(mg/L) = 11.98OD665-1.93OD649;叶绿素b浓度(mg/L) = 20.36OD649-5.50OD665,单位鲜重叶绿素含量(mg/g FW)= [叶绿素浓度×提取液体积×稀释倍数]/样品鲜重。
1.4 POD和SOD酶活性的测定
POD酶活性的测定采用愈创木酚法[14],SOD酶活性的测定采用NBT光还原法[14]。然后计算相对酶活=实验组酶活/对照组酶活。
1. 5 数据处理
所得数据应用Excel软件统计、处理;并用SPSS16.0软件在对照组和实验处理组之间进行差异显著性分析以及处理组之间单因素方差分析,认为P<0.01时存在极显著性差异,P<0.05时存在显著性差异。
2 结果和分析
2.1 外源MeJA胁迫对盐生杜氏藻β-胡萝卜素含量的影响
研究外源MeJA胁迫对盐生杜氏藻细胞β-胡萝卜素含量的影响,结果表明(图1),随着培养时间的延长,不添加MeJA组(对照组)和添加100 μmol/L MeJA组(处理组)的盐生杜氏藻细胞β-胡萝卜素含量均呈逐渐增加的趋势,其β-胡萝卜素积累曲线呈典型的S型曲线,在培养第4~8 d时,β-胡萝卜素积累处于对数增长期,而培养第10 d后,β-胡萝卜素积累变化不明显,处于积累平台期。比较外源MeJA处理组和对照组盐生杜氏藻β-胡萝卜素含量的变化,结果表明,100 μmol/L 外源MeJA处理组的β-胡萝卜素含量均明显高于未处理对照组(P<0.01),说明MeJA可显著促进盐生杜氏藻β-胡萝卜素的积累。研究不同浓度外源MeJA胁迫处理对盐生杜氏藻β-胡萝卜素含量的影响,结果表明(图1),随着MeJA浓度的升高,盐生杜氏藻β-胡萝卜素含量呈先上升后下降的趋势,当MeJA浓度为100 μmol/L时,盐生杜氏藻β-胡萝卜素含量最高。

图1 外源MeJA胁迫对盐生杜氏藻β-胡萝卜素含量的影响

图2 外源MeJA胁迫对盐生杜氏藻叶绿素含量的影响
2.2 外源MeJA胁迫对盐生杜氏藻光合生理指标的影响
叶绿素含量代表光合作用水平,外源MeJA胁迫处理是否会对盐生杜氏藻光合作用造成影响。本研究通过研究外源MeJA胁迫处理对盐生杜氏藻细胞叶绿素含量的影响,结果表明(图2),在培养初期,盐生杜氏藻叶绿素含量随着培养时间的延长而增加,在培养第8 d时其叶绿素含量达最大值,随后随着培养时间的延长,叶绿素含量呈逐渐下降的趋势,表明盐生杜氏藻在培养8 d前其光合作用效率逐渐增加,随着时间的推移,藻类生长和β-胡萝卜素含量均达到平台期,此时的光合作用效率也逐渐降低。比较外源MeJA处理组和对照组盐生杜氏藻叶绿素含量的变化,结果表明,100 μmol/L 外源MeJA处理组的叶绿素含量均明显高于未处理对照组(P<0.01),说明MeJA可显著促进盐生杜氏藻叶绿素的积累,即可促进其光合作用。比较不同浓度外源MeJA胁迫处理对盐生杜氏藻叶绿素含量的影响,结果表明(图2),随着外源MeJA胁迫浓度的升高,盐生杜氏藻叶绿素含量呈先上升后下降的趋势,当MeJA浓度为100 μmol/L时,盐生杜氏藻叶绿素含量最高。
2.3 外源MeJA胁迫对盐生杜氏藻POD酶活性的影响
研究外源MeJA胁迫对盐生杜氏藻POD酶活性变化的影响,结果表明(图3),随着MeJA处理时间的延长,MeJA处理组POD酶活性呈先上升后下降的趋势,当MeJA处理时间为24 h时,其POD酶活性最大,而未处理对照组在培养过程中POD酶活性无明显的变化。在外源MeJA处理的72 h内,MeJA处理组的POD酶活性均显著高于未处理组,说明外源MeJA胁迫提高了POD酶的活性。研究不同浓度MeJA在处理24 h时POD酶活性的变化,结果表明(图3),随着MeJA处理浓度的增加,盐生杜氏藻POD酶活性呈先上升后下降的趋势,其中50 μmol/L MeJA处理时POD酶活性最大,且各外源MeJA胁迫处理组POD酶活性均明显高于未处理对照组(P<0.01),说明MeJA处理使盐生杜氏藻POD酶活性提高。
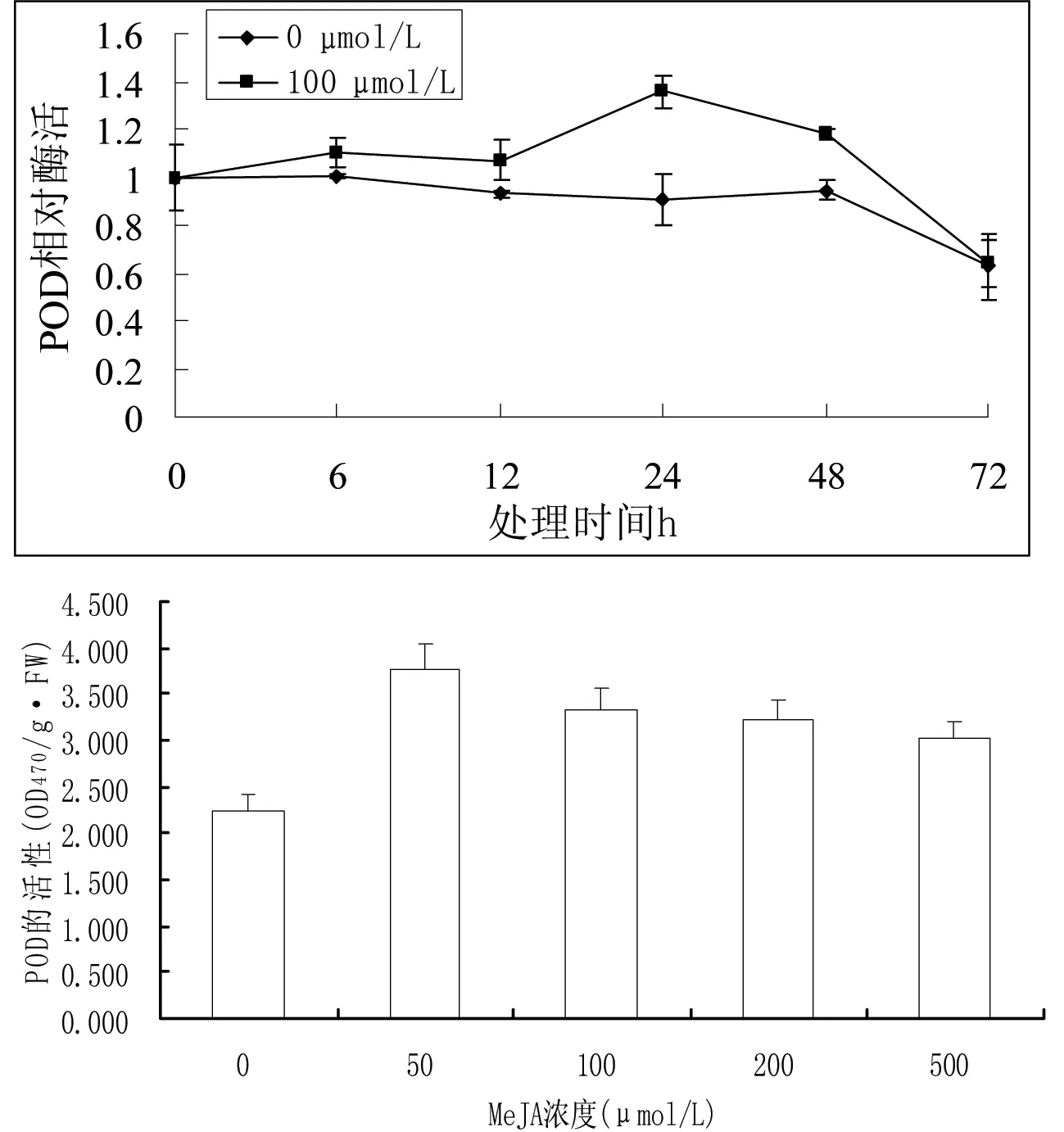
图3 外源MeJA胁迫对盐生杜氏藻POD酶活性的影响
2.4 外源MeJA胁迫对盐生杜氏藻SOD酶活性的影响
测定100 μmol/L MeJA处理组和未处理对照组盐生杜氏藻SOD酶活性变化,结果表明(图4),随着MeJA处理时间的延长,处理组SOD酶活性呈先上升后下降的趋势,当外源MeJA胁迫处理48 h时,其SOD酶活性达最大值,而未处理对照组在培养过程中SOD酶活性无显著变化。比较MeJA处理组和未处理对照组各SOD酶活性表明,MeJA处理组SOD酶活性均显著高于未处理对照组SOD酶活性,说明MeJA胁迫处理可提高盐生杜氏藻SOD酶的活性。研究不同浓度MeJA在处理48 h时SOD酶活性的变化,结果表明(图4),随着MeJA处理浓度的增加,盐生杜氏藻SOD酶活性呈逐渐上升的趋势,且各浓度处理组SOD酶活性均显著高于未处理对照组,说明MeJA处理使盐生杜氏藻SOD酶活性提高,其中500 μmol/L MeJA处理时其SOD酶活性最大,方差分析表明各MeJA处理组SOD酶活性差异显著。

图4 外源MeJA胁迫对盐生杜氏藻SOD酶活性的影响
3 讨论
MeJA在植物信号中具有重要作用,外源MeJA可启动植物防御途径并诱导防御相关基因表达,并诱导产生蛋白酶抑制因子、防御相关性化合物[15]。外源MeJA还能够诱导植物的次级代谢网络途径中关键酶基因的表达,从而诱导次生代谢物包括萜类、黄酮类、生物碱类等化合物的大量积累[8]。Gong等研究表明,外源MeJA胁迫处理银杏愈伤组织,能通过调控银杏细胞中银杏内酯合成途径中的关键酶dxs基因的表达来提高银杏内酯的含量[9]。外源MeJA胁迫处理可使整株烟草的烟碱含量提高2~10倍[16]。外源MeJA胁迫处理能明显提高抗癌药物紫杉醇和紫杉烷类化合物的含量[11-13]。外源MeJA胁迫处理还可提高大豆异黄酮、雨生红球藻虾青素、丹参酚酸类物质、黄芪黄酮等次生代谢产物的积累[17-20]。本研究表明,MeJA能诱导盐生杜氏藻β-胡萝卜素的积累。其中,100 μmol/L的MeJA处理效果最佳,与在红豆杉中的报道一致。
外源MeJA能够诱导β-胡萝卜素的累积有两方面原因,一种可能为MeJA可诱导类胡萝卜素合成途径中相关基因的表达,进而导致β-胡萝卜素的生物积累。Liu等人指出MeJA能够诱导类胡萝卜素合成途径中关键酶基因的合成,在促进番茄红素生物合成中发挥着积极的作用[21]。Kim等发现对生菜喷洒0.5 μM MeJA,其β-胡萝卜素含量在8 d后变化不显著,但是对照组相对于MeJA处理组,6 d后β-胡萝卜素含量只有处理组的31%[22]。


随着MeJA浓度的升高,8 d后β-胡萝卜素和叶绿素呈先增高后下降趋势。唐美玲研究MeJA对苹果和梨叶片叶绿素的影响表明,MeJA对叶绿素总量的影响趋势是先降低后升高[31],与本实验结果不一致,可能与所用不同物种有关;赵瑾等研究的干旱胁迫下圆柏叶绿素含量变化呈现先增加后降低的现象[32];与盐生杜氏藻的结果相似。可能原因有一方面是由于胁迫的氧化损伤加剧,使叶绿素合成受阻,降解加快,因此叶绿素含量下降;活性氧的增加也致使β-胡萝卜素清除氧自由基的能力受阻,合成减慢。另一方面,高浓度MeJA处理盐生杜氏藻时,其生长受到抑制,单位体积内藻细胞数量明显下降,导致相同体积藻液的叶绿素和β-胡萝卜素含量也明显下降。而POD在不同浓度的MeJA下处理8 h后的变化趋势则表明盐生杜氏藻对胁迫反应的典型特征,当MeJA的浓度较低时,产生活性氧较少,能激活细胞内POD的活性,藻细胞抗逆性增强。当MeJA浓度升高时,藻细胞内活性氧的代谢严重失衡,此时POD对机体的保护作用减弱,活性降低。有趣的是藻细胞中SOD的活性一直呈现增强趋势。这与其他高等植物在胁迫环境下SOD的变化趋势不同,可能是盐生杜氏藻与高等植物抗氧化防御系统的组成和数量的不同所造成的,盐藻细胞内含有丰富的类胡萝卜素,对SOD可能也具有保护作用。但盐藻SOD活性的过高或过低对于β胡萝卜素的积累都是不利的。盐生杜氏藻作为最耐盐的单细胞藻类,其高SOD活性也是抗逆能力的标志。
盐生杜氏藻对环境的胁迫和适应能力是β-胡萝卜素积累的基础和前提。本实验初步讨论了盐藻对MeJA胁迫的部分生理机制。说明盐生杜氏藻对MeJA的反应较为敏感,也表明盐生杜氏藻能对MeJA胁迫做出反应,进而启动其相应的生理活动或迅速的防御反应,抵御活性氧的伤害。
[1]Liu X D,Shen Y G. NaCl-induced phosphorylation of light harvesting chlorophyll a/b proteins in thylakoid membranes from the halotolerant green alga,Dunaliellasalina[J]. FEBS Letters,2004,569: 337-340.
[2]Liu X D,Shen Y G. Salt-induced redox-independent phosphorylation of light arvesting chlorophyll a/b proteins inDunaliellasalinathylakoid membranes [J]. Biochimica et Biophysica Acta,2005,1706: 215-219.
[3]康燕玉,谢文玲,高亚辉,等. 不同浓度NaCl和光照强度对杜氏藻内 β-胡萝卜素含量的影响[J]. 植物生理学通讯,2006,42(2): 315-318.
[4]朱 颖,王丽丽,柴芸彬,等. 茉莉酸甲酯对杜氏盐藻β-胡萝卜素含量的影响[J]. 宁波大学学报(理工版),2010,23(1): 13-17.
[5]汪新文. 茉莉酸参与植物逆境胁迫的研究进展[J]. 安徽农学通报,2008,14(6): 29-35.
[6]吴夏华,胡睦荫,蔡庭付,等. 茉莉酸及其甲酯的代谢与生理功能[J]. 安徽农业科学,2007,35(14): 4109,4125.
[7]田爱梅,王国强,曹家树. 茉莉酸类物质对农作物的生理效应研究[J]. 安徽农业科学,2008,36(30): 13037-13039.
[8]蒋科技,皮 艳,侯 嵘,等. 植物内源茉莉酸类物质的生物合成途径及其生物学意义[J]. 植物学报,2010,45(2): 137-148.
[9]Gong Y F,Liao Z H,Guo B H,et al. Molecular cloning and expression profile analysis ofGinkgobilobaDXS gene encoding 1-deoxy-D-xylulose 5-phosphate synthase,the first committed enzyme of the 2-C-methyl-D-erythrito l,4-phosphate pathway [J]. Planta Medica,2006,72: 329-335.
[10]Kang S M,Min J Y,Kim Y D,et al. Effects of methyl jasmonate and salicylic acid on the production of bilobalide and ginkgolides in cell cultures ofGinkgobiloba[J]. In Vitro Cell Dev Biol Plant,2006,42(1): 44-49.
[11]Yukimune Y,Tabata H,Higashi Y. Methyl jasmonate-induced overproduction of paclitaxel and baccatin III inTaxuscell suspension cultures [J]. Nat Biotechnol,1996,14(9): 1129-1132.
[12]Ketchum R E,Gibson D M,Croteau R B. The kinetics of taxoid accumulation in cell suspension cultures ofTaxusfollwing elicitation with methyl jasmonate [J]. Biotechnol Bioeng,1999,62(1): 97-105.
[13]余龙江,朱 敏,刘幸福,等. 茉莉酸甲酯对中国红豆杉胚性细胞紫杉醇生物合成的影响[J]. 武汉植物学研究,1999,17(4): 371-374.
[14]张志良. 植物生理学实验指导[M]. 北京: 高等教育出版社,2003.
[16]桂连友,刘树生,陈宗懋. 外源茉莉和茉莉酸甲酯诱导植物抗虫作用及其机理[J]. 昆虫学报,2004,47(4): 507-514.
[17]马君兰,赵 越. 外源茉莉酸甲酯(MeJA)对大豆异黄酮合成途径的影响[J]. 东北农业大学学报,2011,42(5): 14-18.
[18]王鑫威,王丽丽,龚一富,等. 甲基茉莉酸对雨生红球藻虾青素含量和dxs基因表达的影响[J]. 水产学报,2011,35(12): 1823-1829.
[19]李文渊,高 伟,赵 静,等. 基于茉莉酸甲酯诱导的丹参毛状根酚酸类成分次生代谢机制研究[J]. 中国中药杂志,2012,37(1): 13-16.
[20]刘雅静,邢菊展,张宇婷,等. 茉莉酸甲酯,蔗糖和氮源对蒙古黄芪愈伤组织生长和黄酮含量的影响[J]. 内蒙古大学学报,2012,43(1): 63-68.
[21]Liu L,Wei J,Zhang L,et al. Ethylene independent induction of lycopene biosynthesis in tomato fruits by jasmonates [J]. J Exp Bot,2012,63(16): 5751-5761.
[22]Kim H J,Fonseca J M,Choi J H,et al. Effect of methyl jasmonate on phenolic compounds and carotenoids of romaine lettuce (LactucasativaL.) [J]. J Aqric Food Chem,2007,55(25): 10366-10372.
[23]Knight H,Treavas A J,Knight M R. Cold calcium signaling inArabidopsisinvolves two cellular pools and a change in calcium signature after acclimation [J]. Plant Cell,1996,8(3): 489-503.
[24]王海波,黄椿颖,庞学群,等. 茉莉酸甲酯诱导的采后香蕉果实耐冷性与活性氧信号的关系[J]. 中国农业科学,2008,41(4): 1165-1171.
[25]潘瑞炽,豆志杰,叶庆生. 茉莉酸甲酯对水分胁迫下花生幼苗SOD活性和膜脂过氧化作用的影响[J]. 植物生理学报,1995,21(3): 221-228.
[26]何红卫,廖令洁,肖文娟,等. 茉莉酸甲酯对烟草幼苗抗病毒相关酶活性的影响[J]. 暨南大学学报,2005,26(03): 406-411.
[27]宾金华,潘瑞炽. 茉莉酸甲酯的生理生化及在植物抗病中的作用[J]. 植物学报,1995,12(4): 17-21.
[28]胡海英,贺海明,梁新华,等. 茉莉酸甲酯对乌拉尔甘草种子萌发和过氧化物酶活性的影响[J]. 时珍国医国药,2011,22(7): 1579-1580.
[29]Popham P L,Novacky A. Use of dimethyl sulfoxide to detect hydroxyl radical during bacteria-induced hypersensitive reaction [J]. Plant Physiol,1991,96: 1157-1160.
[30]蒋明义,杨文英,徐 江,等. 渗透胁迫下水稻幼苗中叶绿素降解的活性氧损伤作用[J]. 中国植物学报,1994,36(4): 289-295.
[31]唐美玲. 茉莉酸甲酯对离体叶片衰老的影响及其作用机制[D]. 河北农业大学博士学位论文,2002.
[32]赵 瑾,白 金,潘青华,等. 干旱胁迫下圆柏不同品种(系)叶绿素含量变化规律[J]. 中国农学通报,2007,3: 236-239.
