植物体内Ca2+,pH,ROS活体荧光探针成像研究进展
2013-12-21祝雪兰许树成
祝雪兰, 许树成
(1.阜阳师范学院生命科学学院; 2.阜阳市红旗中学,阜阳 236041)
细胞内Ca2+,H+与活性氧 (reactive oxygen species, ROS) 是植物体内广泛存在的响应生物或非生物胁迫、调节植物生长发育的因子。人们越来越倾向认为,这些调节因子所显示的时空动态复杂变化模式是它们信号行为的一部分。因此,检测Ca2+,H+与ROS的动态变化,是研究和了解这些细胞因子对植物起调节作用的关键。然而,上述无机信号分子在细胞内浓度等时空变化的有效检测或监测手段一直较少。目前这些信号的显像技术已经出现,并且可以在细胞和亚细胞水平上对上述信号(分子)进行原位实时定量鉴定[1]。 这些显像或成像方法是基于一些小分子染料可以与Ca2+,H+和ROS发生专一性的相互作用、从而使染料荧光特性发生改变的原理。研究进一步发现,使用绿色荧光蛋白(Green fluorescent protein, GFP),可以在亚细胞尺度上,对Ca2+,H+和ROS信号分子进行高分辨定位分析。
1 Ca2+在植物活细胞体内的成像
1.1 细胞内Ca2+成像分子探针
Ca2+被认为是广泛存在的细胞功能调节子,因此人们十分关注这种阳离子在细胞内的时空变化水平,以期揭示出它是如何触发细胞生理响应的[2]。细胞质Ca2+水平常常呈现出诸如“尖峰形成”和细胞内“钙波”形式的变化、被认为是细胞间触发信息传递的方式。解码Ca2+“指纹”的生物化学耦联,使得Ca2+信号能够参与细胞对多种环境刺激响应的调节。Ca2+浓度过高时、它也是一种细胞毒素,在胞质中其浓度为100 nM水平、而在细胞器内或质外体Ca2+浓度大致在在 1 mM水平。在细胞质中,一旦 Ca2+浓度超出 100 μM 水平时间过长,细胞功能将会因Ca2+沉积而遭到破坏。然而,Ca2+浓度在 100 μM 水平上的增加,如果在时空上受到限制,细胞是可以耐受的。最典型的是植物根尖生长点和伸长区细胞[3]。因此,对Ca2+浓度动态变化模式的监测是研究Ca2+信号的关键。 然而,Ca2+浓度瞬时变化的定位与成像却面临诸多挑战。因为监测细胞质Ca2+浓度的系统必须足够灵敏、而且能够检测到100 μM 浓度范围Ca2+的变化、并且要避免其他二价离子如Mg2+的干扰。
广泛用来进行植物细胞Ca2+显像的染料,都含有一族碳酸残基。这些染料通过碳酸残基与Ca2+相互作用,使得其自身的荧光强度发生改变。例如,Ca2+荧光染料Green-1,Ca2+浓度从0到 μM 水平上的变化,可以使其荧光染料发光强度增加上百倍(图1)。可以借助激光共聚焦或荧光显微镜,用肉眼观察Ca2+染料荧光强度的增加,进而推断Ca2+浓度水平的变化。 一旦知道Ca2+探针的解离系数,可以用简单的公式来确定Ca2+浓度变化:
Ca2+浓度= Kd[(F-Fmin)/(Fmax-F)]
上式中Kd为Ca2+对Ca2+染料的解离系数;F是测定的荧光强度;Fmax是饱和荧光强度; Fmin是无Ca2+时的荧光强度[4]。
在使用以上描述过的方法过程中,人们发现荧光共振能量转移(Fluorescent resonance energy transfer,FRET),这一基于Ca2+绿色荧光受体蛋白(green fluorescent proteins, GFPs)的转基因新技术,对于信号检测来说是很有吸引力的一项新技术。Palmer等[5]分析研究了荧光共振能量转移等成熟的技术方法,在实践中有很强的应用价值。
1.2 向植物细胞内加载Ca2+染料的方法
能与Ca2+相互作用的染料,均含有强烈的带电基团、使得它们不易进入细胞。因此,要使Ca2+染料顺利进入植物细胞,确实是个不小的挑战。使细胞膜可逆性溶解或撕裂的技术,如电穿孔、去污剂增溶、微注射、膜片钳、颗粒型传送、或其它酸酯掩盖电荷的方法,均可使染料顺利进入植物细胞[6-7]。值得一提的是,染料在胞质和细胞器内加载积累后、保持其完整性十分重要。因此,目前与葡聚糖相结合的染料分子、经显微注射加载进入细胞的方法受到广泛重视[8]。

图1 Ca2+敏感的荧光染料和绿色荧光蛋白的特性[1]
(a)Ca2+传感染料Calcium Green-1,Fura-2和 Indo-1荧光发射与激发波普。这些染料的化学结构如下:(i) Ca2+结合后荧光强度增加的波长,(ii)Ca2+结合后荧光强度不同步增加的辐射波长,(iii) Ca2+结合后荧光强度下降的波长。(b) 彩色表示波普的范围。(c) Ca2+响应的Ca2+传感蛋白:钙调素(calmodulin)结构域在2个Ca2+结合的能量转移伴侣蛋白CFP和YFP之间;钙调素结合Ca2+后,蛋白构象的改变使得CFP与YFP接近、FRET出现后导致激发态光产生。(d ) Ca2传感蛋白的荧光发射波普。Ca2+水平增加, CFP (FRET 供体) 辐射减弱, 而YFP (FRET 受体) 辐射增加。缩略语: 青色荧光蛋白CFP, cyan fluorescent protein;荧光共振能量转移FRET, fluorescence resonance energy transfer;黄色荧光蛋白YFP, yellow fluorescent protein。
2 植物细胞pH值荧光显微成像
与Ca2+相似,质子作为带电离子必须严格控制在合适的浓度。H+参与信号转导、而且直接影响植物发育。鉴于此,测量细胞pH是植物学家们的一个重要目标。传统上讲,人们一般用选择性质子微电极等方法来对细胞pH进行测量。这些技术虽得到应用, 但有很多不足,如分辨率低、时间响应滞后等。传统的测细胞pH值的微电极方法,在实践上仍有很多不足。由于pH在细胞内也是动态变化的,因此用荧光指示剂捕获这一动态变化过程,是测定pH极佳的方法[9]。
2.1 质外体pH
质外体是植物细胞膜外区域,包括细胞壁、细胞间隙和木质部。这一区域的离子环境会影响物质的跨膜运输,尤其直接影响根部的营养吸收和溶质传输。细胞壁的pH也调整其延展性与稳定性、进而调节细胞形状的大小。植物激素在质外体的运输,也会受到质子化水平的影响。撇开细胞壁pH对植物众多生理功能的影响不谈,测定其数值仍然是确定质外体pH对生长发育调控的关键。有许多方法都是利用共聚焦显微镜来观察荧光探针对质外体pH的标记。指示剂一般是用荧光粉或其衍生物来充当[10]。荧光粉染料通常被用来作为双重激发态比例指示剂,即一方面其一个激发态峰值的形成完全不依赖于细胞pH值、另一方面其第二个激发态峰值的形成完全依赖pH值。细胞pH值可根据二者激发态强度变化,按比例计算出来。目前细胞pH值的测定大体都按这种方式进行,代表着该技术的新方向。
2.2 细胞质pH监测
由于细胞溶质是强缓冲液、加之H+-ATP质子泵和多聚焦磷酸化的作用,植物细胞pH一般情况下维持在7.2左右。H+-ATP质子泵一般定位在细胞质膜和内膜上,其工作结果是去除胞质过多H+。最近有研究发现,细胞质pH值也受到了精巧的调节、以期响应外界刺激或植株生长[11]。
当前,灵敏的荧光pH探针与高分辨率的空间图像相偶联,不仅使得人们可以使用荧光显微镜观察亚细胞水平pH值的不均一性、而且可以观察到不同细胞pH值的动态变化。基于荧光显微镜使用的灵敏细胞质pH荧光染料一直是观察和测定胞质pH的首选方法。目前,胞质pH荧光蛋白瞬时表达技术受到研究和使用者的欢迎,该技术还在发展之中。
3 植物细胞ROS活体原位成像
3.1 单线态氧细胞成像探针

3.2 超氧阴离子细胞成像
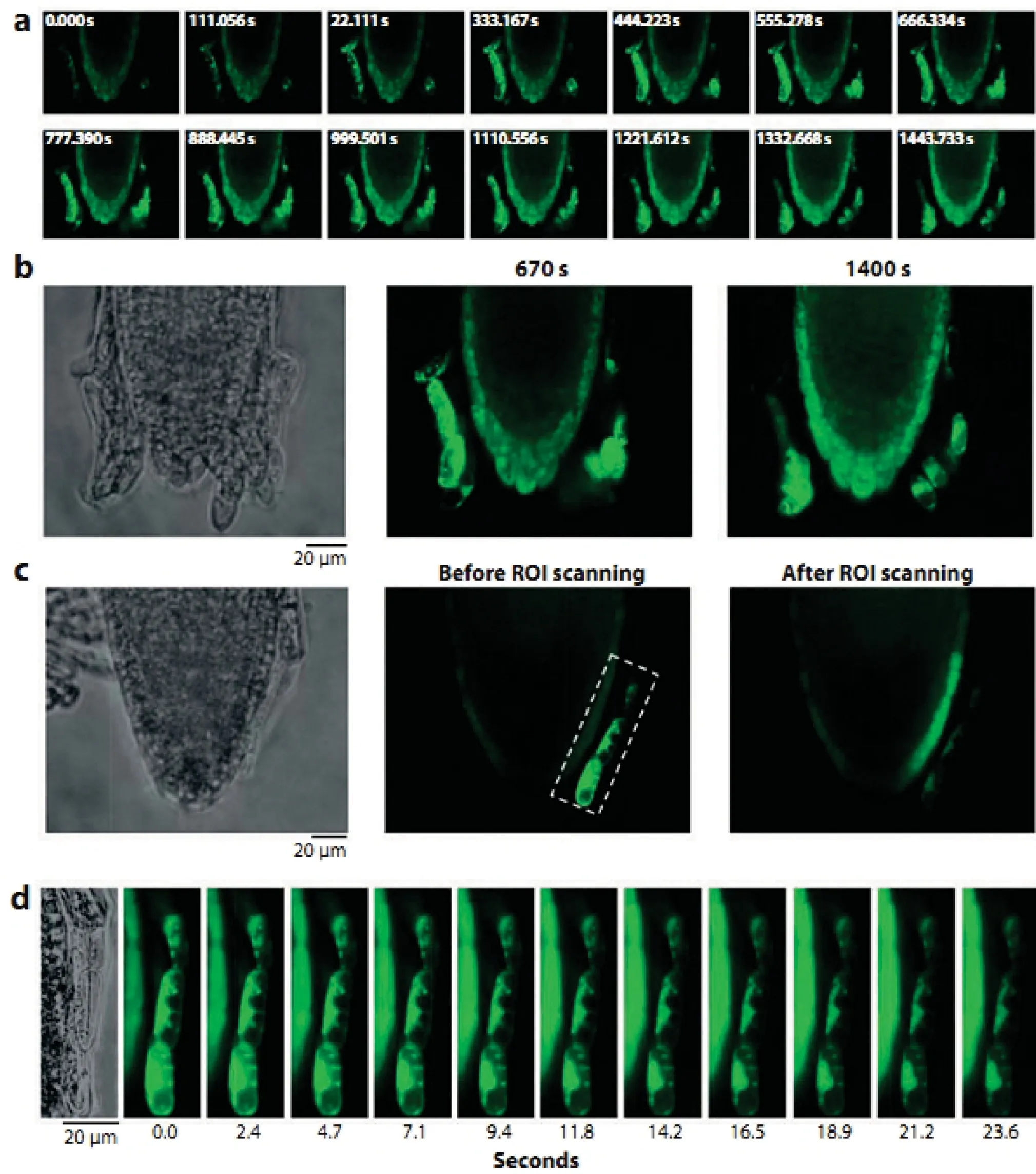
图2 4 d 拟南芥根尖50- μM H2DCF-DA染色结果[1]
(a) H2DCF-DA 染色和加载的时间进程;(b) 单个根尖细胞光漂白、染料吸收和泄漏,以及氧化还原势的不同复合状态;(c) 根尖加载H2DCF-DA 10 min后, 激光共聚焦显微成像,然后再根据要求扫描目标区域活性氧;(d) 总作用时间为26 s,扫描结束后,表皮外周细胞染色因光漂白逐渐变暗,而毗邻的细胞因成像胁迫诱导产生ROS变亮。
3.3 过氧化氢显像探针
二氨基联苯(3,3-Diaminobenzidine, DAB)是水溶性有机化合物,能与过氧化氢(H2O2)起反应,生成深褐色多聚物[19]。与NBT使用方式相仿,DAB被用来进行植物生物胁迫或伤害胁迫条件下H2O2原位显色。值得注意的是DAB对植物细胞有毒性,并且易于被光降解。荧光素衍生物2,7-二氯荧光黄(dihydrodichlorofluorescein diacetate, H2DCF-DA)目前被广泛作为过氧化氢实时显像荧光探针[19,24]。由于与H2O2的高反应活性且可以直接通过细胞膜进入细胞,H2O2已被普遍用来监测植物细胞H2O2的积累(图2)。与其他ROS染料或传感器相比,H2DCF-DA具有可视化程度高、加载进入细胞方便等优点,但是该染料探针在完整细胞内不稳定、易于发生光氧化或光猝灭作用。在应用中宜快、不宜慢。
4 总结和展望
荧光探针为确定植物细胞Ca2+、pH和ROS的时空动态变化提供了一个强有力的工具和办法。 随着人们对荧光探针与目标信号分子相互作用模式认识的深入,这些探针在对信号分子定量分析方面将起十分重要的作用。尽管本文讨论仅限于Ca2+、pH和ROS探针,但是更广泛的染料和修饰化GFP荧光蛋白感受器、已经被用来监测G-蛋白活性、蔗糖浓度和酶活性等[25]。荧光蛋白感受器的出现,使得显微成像更为容易、尤其是用于转化细胞、可以免除染料添加等定位试验。期待着能有一个荧光蛋白数据库资源,届时亚细胞信号定位方面的试验开展将更为便捷,也可以丰富人们对亚细胞信号动态变化的理解。目前,由于可以获取多个荧光探针,因而可以同时测定多个细胞位点多个参数。这种多渠道获取的荧光图像,无疑对于我们确定亚细胞水平上标志性信号元件、有至关重要的作用。
[1]Swanson S J, Choi W G, Alexandra,C, et al.In vivo imaging of Ca2+, pH, and reactive oxygen species using fluorescent probes in plants[J].Annu Rev Plant Biol, 2011, 62:273-297.
[2]Dodd A N, Kudla J, Sanders D.The language of calcium signaling[J].Annu Rev Plant Biol, 2010, 61:593-620.
[3]Michard E, Alves F, Feijo J A.The role of ion fluxes in polarized cell growth and morphogenesis: the pollen tube as an experimental paradigm[J].Int J Dev Biol, 2009, 53:1609-1622.
[4]Grynkiewicz G, PoenieM, Tsien R Y.A new generation of Ca2+indicators with greatly improved fluorescence properties[J].J Biol Chem, 1985, 260:34403450.
[5]Palmer A E, Tsien R Y.Measuring calcium signaling using genetically targetable fluorescent indi-cators[J].Nat Protoc, 2006, 1:1057-1065.
[6]Bothwell J H, Brownlee C, Hetherington A M, et al.Biolistic delivery of Ca2+dyes into plant and algal cells[J].Plant J, 2006, 46:327-335.
[7]Romano L A, Jacob T, Gilroy S, et al.Increases in cytosolic Ca2+are not required for abscisic acid inhibition of inward K+ currents in guard cells ofViciafabaL[J].Planta, 2000, 211:209-217.
[8]Scanlon M, Williams D A, Fay F S.A Ca2+-insensitive form of Fura-2 associated with polymor-phonuclear leukocytes-assessment and accurate Ca2+measurement[J].J Biol Chem, 1987, 262:6308 6312.
[9]Monshausen G B, Bibikova T N, Weisenseel M H, et al.Ca2+regulates reactive oxygen species production and pH during mechanosensing inArabidopsisroots[J].Plant Cell, 2009, 21:2341-2356.
[10]Probes M.The Handbook[M].Carlsbad, NM: Invitrogen, 2010.
[11]Monshausen G B, Bibikova T N, Weisensee M H, et al.Ca2+regulates reactive oxygen species production and pH during mechanosensing inArabidopsisroots[J].Plant Cell, 2009, 21:2341-2356.
[12]Apel K, Hirt H.Reactive oxygen species: metabolism, oxidative stress, and signal transduction[J].Annu Rev Plant Biol, 2004, 55:373-399.
[13]Swanson S, Gilroy S.ROS in plant development[J].Physiol Plant, 2010, 138:384-392.
[14]D′Autreaux B, Toledano M B.ROS as signalling molecules: mechanisms that generate specificity in ROS homeostasis[J].Nat Rev Mol Cell Biol, 2007, 8:813-824.
[15]Giorgio M, Trinei M, Migliaccio E, et al.Hydrogen peroxide: a metabolic by-product or a common mediator of ageing signals[J]? Nat Rev Mol Cell Biol, 2007, 8:722-728.
[16]Moller I M, Jensen P E, Hansson A.Oxidativemodi?cations to cellular components in plants[J].Annu Rev Plant Biol, 2007, 58:459-481.
[17]Hideg E, Barta C, Kalai T, et al.Detection of singlet oxygen and superoxide with fluorescent sensors in leaves under stress by photoinhibition or UV radiation[J].Plant Cell Physiol, 2002, 43:1154-1164.
[18]Hideg E, Kos P B, Schreiber U.Imaging of NPQ and ROS formation in tobacco leaves: heat inactivation of the water-water cycle prevents down-regulation of PSII[J].Plant Cell Physiol, 2008, 49:1879-1886.
[19]Probes M.The Handbook.Carlsbad, NM: Invitrogen, 2010.
[20]Bielski B H J, Shiue G G, Bajuk S.Reduction of nitro blue tetrazolium by CO2-andO2-radicals[J].J Phys Chem, 1980, 84:830-833.
[21]Driever S M, Fryer M J, Mullineaux P M, et al.Imaging of reactive oxygen species in vivo[J].Methods Mol Biol, 2009, 479:109-116.
[22]Jekely G, Arendt D.Cellular resolution expression profiling using confocal detection of NBT/BCIP precipitate by reflection microscopy[J].Biotechniques, 2007, 42:751-755.
[23]Zielonka J, Vasquez-Vivar J, Kalyanaraman B.Detection of 2-hydroxyethidiumin cellular systems: a unique marker product of superoxide and hydroethidine[J].Nat Protoc, 2008, 3:8-21.
[24]Rhee S G, Chang T S, Jeong W, et al.Methods for detection and measurement of hydrogen peroxide inside and outside of cells[J].Mol Cells, 2010, 29:539-549.
[25]Frommer W B, Davidson M W, Campbell R E.Genetically encoded biosensors based on engineered fluorescent proteins[J].Chem Soc Rev, 2009, 38:2833-2841.
