FISH技术解析不同氨氮浓度MBR中的微生物群落结构
2013-12-21杨小丽宋海亮傅大放
杨小丽 周 娜 陈 明 张 瑞 宋海亮 傅大放
(1东南大学土木工程学院,南京 210096)
(2东南大学能源与环境学院,南京 210096)
膜生物反应器(membrane bioreactor,MBR)是将生物处理与膜分离技术有机结合起来的一种新型污水处理技术.由于膜组件的高效截留作用,MBR实现了水力停留时间(HRT)和污泥龄(SRT)的完全分离,有利于世代周期较长的硝化细菌的富集增长,使MBR硝化效率增强,但目前对不同硝化强度下MBR中起主要作用的微生物群落结构的变化研究仍较有限[1].近年来,随着PCR,SSCP,FISH等现代分子生物技术的发展,使得快速准确地鉴定细菌成为可能.在水处理微生物学中,已经开始广泛应用现代生物学分子技术检测处理体系中微生物群落生态演替规律及种群数量的波动等.其中,FISH是应用广泛、最为有效的技术之一.
为了探究不同硝化过程中微生物群落结构的组成变化,本文应用FISH技术对不同氨氮负荷的MBR进行微生物种群检测.根据文献[2-3],本文选择了污水处理中常见的8种细菌并对其数量进行检测分析,分别是:变形菌(α-变形菌(Alphaproteobacteria)、β-变形菌(Betaproteobacteria)、γ-变形菌(Gammaproteobacteria))、放线菌、黄杆菌、绿弯菌、氨氧化细菌、硝化细菌.通过研究,以期真实反映出在不同进水氨氮浓度的MBR中微生物群落结构的组成变化,同时分析其数量分布及丰度,探索MBR中微生物菌群结构与硝化作用的内在关系,为实际工程进一步提高MBR的处理效果提供理论依据.
1 实验方法
1.1 实验装置
MBR实验装置如图1所示.

图1 MBR实验装置示意图
1.2 荧光原位杂交技术实验步骤
荧光原位杂交技术实验步骤如下:① 进行玻片预处理、样品采集与预处理[4].② 杂交反应.在密闭的杂交盒中放入吸水纸,用不含探针的杂交液(SDS 0.1%,Tris-HCl (pH 8.0) 20 mmol/L,甲酰胺浓度见表1)润湿.用移液枪分别取24 μL杂交液和1 μL探针溶液放入带有样品的载玻片上,然后放入杂交盒内进行杂交反应.总细菌和硝化细菌杂交时间为5 h,其余为2~3 h,杂交温度均为46 ℃.所有有关探针的操作应避光处理.③ 洗脱反应.提前将洗脱液(EDTA 56 mmol/L,SDS 0.1%,Tris-HCl (pH 8.0) 20 mmol/L,NaCl浓度根据杂交液中甲酰胺浓度确定)放入水浴锅中48 ℃预热,然后倒入干燥的杂交盒;将载玻片放入装有洗脱液的杂交盒中,避光密闭洗脱20 min后除去洗脱液,用ddH2O漂洗2次.④ DAPI染色.取10 μL浓度为1 μg/mL的DAPI加到载玻片样品上,染色5 min,用甲醇漂洗,加上盖玻片,用封片剂封片,放在室温下晾干.

表1 实验使用的16S和23S rRNA特异寡核苷酸探针序列
待载玻片干燥后,立即使用OLYMPUS-BX41荧光显微镜观察.该荧光显微镜配置有3种不同波长的滤光片,分别为:395~415 nm,420~485 nm,460~550 nm.观测30个视野,用Image-Pro Plus 6.0软件读取细菌数目.对每个样品进行了3组平行实验.观察时每组实验至少摄取30个视野进行计数,然后将3组平行样的计数结果进行平均计算[8].
本实验所使用的靶向细菌、序列、杂交条件详见表1.其中探针NIT3用FITC标记,激发光为亮绿色;其余探针用HEX标记,激发光为红色.
2 实验结果与讨论
2.1 MBR对污染物的去除效果
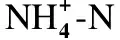
表2 MBR对COD和的平均去除效果(n=33)
2.2 MBR微生物群落结构

图2为3个MBR中细菌的构成比较.由图可看出,3个MBR中,所选细菌涵盖细菌总量的90%~97%,说明所选细菌具有很好的代表性[12].在1#MBR中α-变形菌和β-变形菌相对系统中其他细菌来说含量较多,占总细菌的比例分别为18%和21%;其次是氨氧化细菌、硝化细菌、γ-变形菌和绿弯菌,分别占总细菌的15%,13%,12%和10%;放线菌和黄杆菌相对来说含量较低,均不超过6%;另外,3%的细菌未检测出.Zang等[13]采用FISH方法测试了活性污泥中的优势菌群,得出类似的结果:α-变形菌和β-变形菌占总细菌的比例均为20%左右;黄杆菌和放线菌相对含量为6%~10%.在2#MBR中优势菌群是β-变形菌,占总细菌数量的比例为24%;其次是α-变形菌、放线菌、黄杆菌和绿弯菌,占总细菌的比例为15%左右;其余细菌所占比例均不大于5%.在3#MBR中氨氧化细菌为绝对优势菌种,占总细菌的26%;其次是α-变形菌、硝化细菌和β-变形菌,所占比例分别为19%,17%和16%;其他细菌所占比例约为2%~5%.以上结果表明,不同进水氨氮浓度的MBR经过长时间的稳定运行后,形成了各自特定的微生物群落结构,相同的微生物种群在不同的MBR体系中的优势地位不同.

图2 3个MBR中细菌的构成比较

从图2中还可看出,变形菌在3个MBR中占总细菌的比例分别是51%,44%,39%,可见变形菌在MBR微生物群落结构中占有明显优势.张斌等[14]采用PCR-DGGE技术对处理不同废水MBR体系中的微生物群落结构比较也发现,变形菌是MBR的主要优势菌落.
图3是MBR中微生物的荧光显微图像.图3(f)为绿弯菌,在3个MBR中含量均比较少.Björnsson等[10]实验证明,绿弯菌确实是活性污泥的组成成分之一.在活性污泥系统中绿弯菌是生活在好氧环境下的,主要以糖类为基质[15-16],因此较低氨氮负荷的MBR更有利于绿弯菌的生存.Kragelund等[16]应用MAR-FISH技术对126座生活污水和工业废水处理厂进行的绿弯菌检测表明,50%的污水厂中检测到了绿弯菌,其中12%的污水厂中绿弯菌含量比较高,而且是造成污泥膨胀的主要丝状细菌之一.
图3(g)、(h)在同一个视野下拍摄的,图3(g)是2#MBR的荧光显微图像,图3(h)是2#MBR β-变形菌的DAPI图像,箭头指向的是该探针检测到的β-变形菌.由图可看到,这种细菌在2#MBR中呈丝状大量分布.此时,2#MBR中放线菌和绿弯菌较其他2个MBR含量增多,与2#MBR呈现污泥膨胀的态势相吻合.由此表明,低氨氮负荷的MBR在长期稳定运行中更易发生污泥膨胀,丝状β-变形菌是引起污泥膨胀的主要丝状细菌之一.
黄杆菌荧光显微图像如图3(j)所示,在2#MBR中的含量也相对较高.这可能是由于2#MBR中有机物(投加的主要是葡萄糖)浓度相对氨氮浓度较高,有利于黄杆菌这类主要以葡萄糖作为碳源和能源,且极少能利用其他碳源生长的细菌生存[16].
2.3 微生物群落结构与污染物去除效果的相关性分析


表3 微生物群落结构与污染物去除效果的相关性分析


图3 MBR稳定运行条件下体系中微生物荧光显微图像(视野放大倍数是1 000倍)
3 结论
1) 进水氨氮浓度不同的MBR经过长时间的稳定运行,各自形成了特有的微生物群落结构,并且相同的微生物种群在不同运行条件的MBR系统中的优势地位也不相同,变形菌是MBR主要优势菌群之一.
2) 高进水氨氮浓度的MBR为氨氧化细菌和硝化细菌提供了有利的生存条件,使这些细菌在MBR系统中大量繁殖富集,提高了MBR的硝化能力.低进水氨氮浓度的MBR限制了氨氧化细菌和硝化细菌的生存,在与其他细菌的竞争中,逐渐被淘汰,且低氨氮负荷下,MBR系统中存在大量的β-变形菌、放线菌、绿弯菌等丝状菌.
)
[1]Judd S J. The status of membrane bioreactor technology[J].TrendsinBiotechnology, 2008,26(2): 109-116.
[2]Amann R, Fuchs B M. Single-cell identification in microbial communities by improved fluorescence in situ hybridization techniques[J].NatureReviewsMicrobiology, 2008,6(5): 339-348.
[3]Snaidr J, Amann R, Huber I, et al. Phylogenetic analysis and in situ identification of bacteria in activated sludge[J].AppliedandEnvironmengtalMicrobiology, 1997,59(1): 143-169.
[4]朱琳,尹立红,浦跃朴,等. 荧光原位杂交法检测环境硝化细菌实验条件优化及应用[J].东南大学学报:自然科学版, 2005, 35(2): 266-270.
Zhu Lin, Yin Lihong, Pu Yuepu, et al. Optimization and application of fluorescence in situ hybridization assay for detecting nitrifying bacteria in environmental samples[J].JournalofSoutheastUniversity:NaturalScienceEdition, 2005,35(2): 266-270.(in Chinese)
[5]Britt-Marie W, Motoharu O, Malte H, et al. Microbial community structure in activated sludge floc analysed by fluorescence in situ hybridization and its relation to floc stability [J].WaterResearch, 2008,42(8): 2300-2308.
[6]He Shuying, Chen Jing, Li Jixiang. Dynamics of Nitrobacteria community in biological contact oxidation process by DGGE and FISH[C]//4thInternationalConferenceonBioinformaticsandBiomedicalEngineering. Chengdu, China, 2010: 5515470.
[7]Lubarsky H V, Hubas C, Chocholek M, et al. The stabilisation potential of individual and mixed assemblages of natural bacteria and microalgae[J].PLoSone, 2010,5(11): 1-12.
[8]Manz W, Amann R, Ludwig W, et al. Application of a suite of 16S rRNA specific oligonucleotide probes designed to investigate bacteria of the phylum Cytophaga-Flavobacter-Bacteroides in the natural environment[J].Microbiology,1996,142(5): 1097-1106.
[9]Björnsson L, Hugenholtz P, Tyson G W, et al. Filamentous Chloroflexi (green non-sulfur bacteria) are abundant in wastewater treatment processes with biological nutrient removal[J].Microbiology, 2002,148(8): 2309-2318.
[10]Roller C, Wagner M, Amann R, et al. In situ probing of Gram-positive bacteria with high G+C content using 23S rRNA-targeted oligonucleotides[J].Microbiology, 1994,140(10): 2849-2858.
[11]杨宗政,顾平,刘静文.好氧序批式MBR处理高浓氨氮废水[J].中国给水排水,2005,21(3):53-56.
Yang Zongzheng, Gu Ping, Liu Jingwen. Aerobic sequencing MBR for treatment high concentration of ammonia nitrogen wastewater[J].ChinaWater&Wastewater, 2005,21(3): 53-56. (in Chinese)
[12]Zang K, Kurisu F, Kasuga I, et al. Analysis of the phylogenetic diversity of estrone-degrading bacteria in activated sewage sludge using microautoradiography-fluorescence in situ hybridization[J].SystematicandAppliedMicrobiology, 2008,31(3): 206-214.
[13]Mota C, Head M A, Ridenoure J A, et al. Effects of aeration cycles on nitrifying bacterial populations and nitrogen removal in intermittently aerated reactors[J].AppliedandEnvironmentalMicrobiology, 2005,71(12): 8565-8572.
[14]张斌,孙宝盛,刘慧娜,等. 处理不同废水MBR系统中微生物群落结构的比较[J].环境科学, 2008,29(10): 2943-2949.
Zhang Bin, Sun Baosheng, Liu Huina, et al. Comparison of microbial community structure in MBRs treating different wastewater[J].EnvironmentalScience, 2008,29(10): 2943-2949. (in Chinese)
[15]Kragelund C, Kong Y, Thelen K, et al. Ecophysiology of different filamentous Alphaproteobacteria species from industrial waste water treatment plants[J].Microbiology, 2006,152(10): 3003-3012.
[16]马迪根M T, 马丁克J M.BROCK微生物生物学:上册[M].11版.李春明,杨文博,译.北京:科学出版社,2009:592-593.
[17]高大文,李昕芯,安瑞,等.不同DO下MBR内微生物群落结构与运行效果关系[J].中国环境科学,2010,30(2):209-215.
Gao Dawen, Li Xinxin, An Rui,et al. Relationships between microbial community structure and the performance of MBR under different dissolved oxygen[J].ChinaEnvironmentalScience, 2010,30(2): 209-215. (in Chinese)
