NOX及细胞内ROS与胶质瘤增殖及恶性程度的关系
2013-12-20由丽娜姜海东
由丽娜 姜海东
脑胶质瘤是神经科中常见的原发性脑内肿瘤,发生率约为颅内肿瘤的40%[1]。近年随着对颅内肿瘤研究的深入,相关研究指出肿瘤细胞内活性氧酶簇(IDO activity clusters,ROS)可作为细胞内信号传导的重要媒介,其可能在肿瘤细胞的增殖及凋亡过程中发挥重要的作用[2]。NAD(P)H氧化酶(NOX)被认为是ROS的来源物质。本文将探讨NOX及细胞中ROS与脑胶质瘤增殖及恶性分级的关系。
1 材料与方法
1.1 一般资料
选取本院2011年1月至2013年1月经病理组织学证实为脑胶质瘤患者48例为研究对象,其中男性27例,女性21例,年龄为3~72岁,平均年龄为(45.6±5.8)岁,病程为2~14个月,平均病程为(6.8±2.7)个月。根据WHO关于神经中枢系统肿瘤的恶性程度分级标准将患者分为Ⅰ级15例,Ⅱ级16例,Ⅲ级10例,Ⅳ级7例。选取同期行脑外伤手术的20例非肿瘤患者的正常脑组织为对照组,其中男性12例,女性8例,年龄为3~74岁,平均年龄为(47.8±3.9)岁。上述各组性别、平均年龄无统计学差异(P>0.05),具有可比性,且均签署知情同意书。
1.2 方法
1.2.1 NOX mRNA含量的测定 采用RT-PCR(购于日本TAKAPA公司)测定各组脑组织中NOX mRNA含量,设计针对人NOX的PCR的探针序列以及荧光检测引物,选择人GAPDH(由美国BD公司提供)作为测试的内参物,并采用Trizol试剂盒(美国Invitrogen公司)提取RNA,荧光定量PCR实验严格按照试剂盒操作说明进行。NOX mRNA相对表达量=目的基因/内参基因。
1.2.2 脑组织ROS含量测定 采用流式细胞仪测定患者脑部组织ROS含量,将样本组织剪碎后采用D-Hank's试剂液进行冲洗,并加入1 mg/mL的DNASeI以及2.5 g/L胰蛋白酶混合液,并在37℃中孵化30~60 min,并在含有小牛血清的DMEM培养基中终止消化。样液反复吹打后过滤弃上清液,并用D-Hank's试剂洗涤2次,再次离心5 min,去上清液,留置沉淀物,加入DMEM将悬浮液浓度为2×106/mL的细胞悬液,并于37℃中避光放置,并采用流式细胞仪检测其荧光强度。ROS含量采用相对荧光强度表示:实验测得平均荧光强度/对照组平均荧光强度。
1.2.3 免疫组化法测定脑胶质瘤组织NOX表达 将患者脑部组织标本切成4~8 μm的冰冻切片,室温下静置30 min,加入4°C丙酮固定10 min,用PBS洗涤3次,加入过氧化氢消除内源性过氧化物活性,采用PBS洗涤3次,5 min/次,加入兔抗人NOX一抗,并在室温下孵化2 h后用PBS漂洗,随后加入1∶500的FITC标记的羊抗兔IgG,并在室温下避光孵育30 min,用PBS漂洗,并在荧光显微镜下观察NOX表达情况。
1.2.4 免疫组化法阳性结果判断 ①在倍数为100的显微镜下观察细胞着色情况,根据着色程度由轻至重可分别记为0、1、2、3;②随机选取5个视野点,采用倍数为400的显微镜分别对5个视野进行观察,每个视野进行细胞计数,并计算细胞的阳性百分比(以500个细胞作为1组计算单位),细胞阳性百分率:<10%为1分,10%~50%为2分,>50%为3分。积分计算:①与②计算所得的分值相乘,积分0分为阴性“-”,1~3分为弱阳性“+”,4~6分为中度阳性“++”,7~9分为强阳性“+++”[3]。
1.3 统计学分析
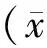
2 结果
2.1 RT-PCR检测脑组织NOX mRNA表达
与正常脑组织相比,脑胶质瘤细胞组织中NOX1~5 mRNA的含量显著增加,两两比较差异有统计学意义(P<0.05),具体结果见表1。
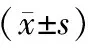
表1 RT-PCR检测脑组织NOX mRNA相对表达量
2.2 脑胶质瘤组织ROS含量测定
经单因素分析,NOX表达量与ROS的含量呈正相关(γ=0.698,P=0.001)。随着脑胶质瘤分级的增加,脑胶质瘤细胞组织中ROS的含量显著增加,两两比较差异有统计学意义(P<0.05),见表2。
2.3 NOX在脑胶质瘤组织中的表达情况
随着病理分级水平的增加,NOX表达阳性率显著增加,两两比较差异有统计学意义(P<0.05),见表3。
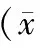
表2 流式细胞仪测定脑组织ROS含量±s)
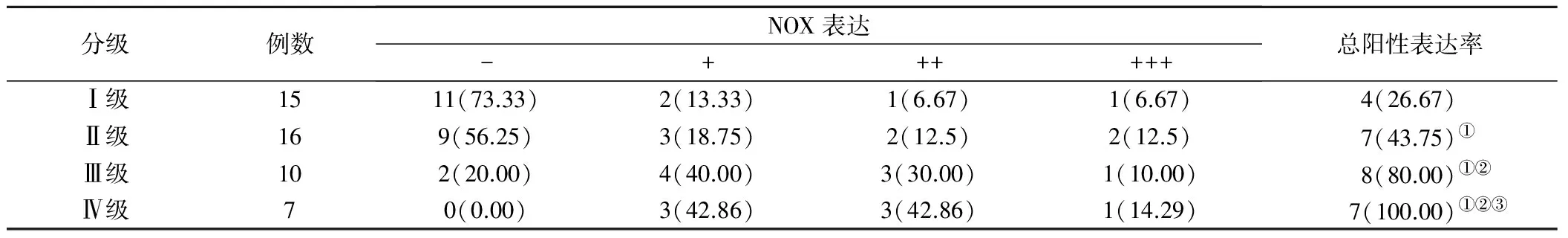
表3 免疫组化法检测NOX在脑胶质瘤组织中的表达情况(例,%)
3 讨论
相关研究指出[4],ROS属于细胞内部的信号转导因子,对细胞基因转录、增殖、凋亡起到重要的调控作用。构成ROS酶体包括NOX、脂氧化酶、黄嘌呤氧化酶、环氧合酶、线粒体呼吸链以及不偶联一氧化氮合酶,其中NOX被认为是细胞内ROS的主要来源。
当机体在正常状态下,NOX则能保持一定的活性并产生ROS,在正常生理情况下ROS的表达处在低水平,其生命活性受到抑制。通过此途径产生的ROS其生理作用主要是作为第二信使对信号传导的介质如转录因子、蛋白激酶、蛋白磷酸酶等物质产生作用,从而调控信号传导[5]。同时ROS还能参与到多器官的生理功能调控中,对维持机体正常的生命活动起到重要的作用。当机体受到外界刺激时会激活NOX产生大量的ROS,从而诱导机体出现各种疾病[6]。研究表明[7],脑组织中ROS主要参与到肿瘤的发生及发展中,当细胞中ROS浓度过高时会导致细胞内DNA出现损伤,从而导致DNA出现突变,引发肿瘤的产生;此外高浓度的ROS会导致细胞出现异常增殖,并能诱导低氧因子以及血管内皮生长因子产生,从而导致肿瘤血管增生,促使肿瘤增殖、转移。
通过本研究发现,48例脑胶质瘤组织样本中均能检出NOX及ROS有不同程度的表达,而在正常的脑组织中NOX及ROS的表达则较低。在不同病理级别的胶质瘤中NOX表达存在差异性,随着恶性程度的增高,患者中NOX以及ROS的表达也随之增高。且NOX1~5 mRNA的表达量随着肿瘤级别的增加而显著增加,并且ROS也随之增加。NOX是产生ROS的主要酶体,并且与脑胶质瘤的恶性分级有密切关系。免疫组化法检测NOX在脑部组织的表达情况,发现随着病理分级水平的增加,NOX表达阳性率显著增加,从而进一步提示,NOX在脑胶质瘤的发展过程中起到重要的作用。
目前对于脑胶质瘤的治疗效果并不理想,传统的放化疗以及手术治疗后容易出现复发,这可能与NOX表达的上调以及产生的ROS调控脑胶质瘤基因表达、增殖以及凋亡有密切关系[8]。本研究也证实了在脑胶质瘤中NOX具有较高的表达能力,经单因素分析,NOX表达量与ROS的含量呈正相关(γ=0.698,P=0.001),其原因可能与NADPH氧化酶DPI抑制NOX活性,进而清除细胞内ROS,减少肿瘤复发有关,因此通过抑制NOX的产生可作为治疗脑胶质瘤的新型治疗手段。但对于NOX在脑胶质瘤中的具体表达机制、活性调控机制以及亚单位结构的相互作用还需要进一步进行研究。
[1] 向定朝.胶质瘤化疗耐药细胞与胶质瘤干细胞的关系〔J〕.实用癌症杂志,2012,27(4):423.
[2] Yu H,Zhang CM,Wu YS.Research progress in cancer stem cells and their drug resistance〔J〕.Chinese Journal of Cancer,2010,29(3):261.
[3] 周开甲,张 鸣,刘伯伟.Ki-67、p53在脑胶质瘤中的表达及意义〔J〕.实用癌症杂志,2012,27(6):572.
[4] 周金桥,王景涛,刘秋红,等.人脑星形胶质细胞瘤恶性程度相关蛋白表达谱的分析与鉴定〔J〕.中华神经医学杂志,2012,11(8):780.
[5] 卢灿亮,黄品助,李斌奎,等.NADPH氧化酶DUOX1在肝细胞癌中的表达及临床意义〔J〕.中华普通外科学文献:电子版,2010,4(1):10.
[6] 张发兵,柯以铨,姜晓丹,等.NADPH氧化酶调节U251胶质瘤细胞的生长和凋亡〔J〕.中华神经医学杂志,2010,9(4):345.
[7] EI Hellene S,Boisselier B,Peglion F.A new alternative mechanism in glioblastoma vascularization:tubular vasculogenic mimicry 〔J〕.Brain,2010,133(Pt4):973.
[8] 韩晓燕.NADPH氧化酶NOX家族与疾病的关系〔J〕.国际病理科学与临床杂志,2010,30(6):513.
