共表达CD40L和IL-2的腺病毒对树突状细胞成熟和IL-12产生的影响
2013-12-20张玉萍谭晓华
张 璇 张玉萍 谭晓华
树突状细胞(dendritic cells,DC)瘤苗是目前最常用的肿瘤主动性免疫治疗策略之一,应用体外培养DC并给予相应的抗原刺激,将其作为1种肿瘤治疗性疫苗来诱导针对相应肿瘤抗原的特异性免疫反应,该方法已在大量的体外研究和动物实验获得证实,并有许多临床试验研究的报道。树突状细胞体外培养过程是将DC前体细胞如CD14+单核细胞通过粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)和白介素4(interleukin-4,IL-4)诱导分化成为不成熟DC,然后给予抗原刺激并诱导DC成熟后完成DC作为1种特定肿瘤疫苗的制备。其中诱导DC成熟十分重要,只有成熟的DC才能产生主动性肿瘤免疫应答反应[1],而非成熟DC可能会导致免疫耐受[2]。目前临床上诱导DC成熟最为常用的方案是,在非成熟DC中加入多种细胞因子包括IL-1β 、IL-6、TNF-α和PGE2,共孵育24~48 h[3],这种方法存在耗时长、成本高等不足。此外,常通过采用基因转导方法对DC进行修饰,以期达到增强DC刺激肿瘤特异性CTL产生的能力,其中最常用的手段之一是用腺病毒载体表达各类基因感染DC[4]。本研究构建了共表达CD40L和IL-2的5/F35嵌合型腺病毒载体,能高效感染人单核细胞来源的DC(monocyte-derived dendritic cells,Mo-DC),并诱导Mo-DC成熟和IL-12的产生。
1 材料与方法
1.1 主要试剂和材料
各种限制性内切酶购自日本TaKaRa公司,Phusion高保真PCR酶、T4DNA连接酶购自美国NEB公司,ThermoScriptTM试剂盒、脂质体Lipofectamine 2000TM和真核表达载体pcDNA3.1/Myc-His(-)B购自Invitrogen公司,流式细胞仪抗体CD80-PE,CD86-PE,DC83-PE、CD40-PE、CD40L-PE和HLA-DR-PE购自美国BD公司,RNA提取试剂盒(RNeasy Mini Kit)购自美国Qiagen公司,质粒提取、纯化和胶回收试剂盒购自OMEGA Bio-Tek公司,AdMaxTMCre重组腺病毒系统购自加拿大Microbix Inc公司,IL-2和IL-12 ELISA试剂盒购自法国Diaclone公司,各种培养基和胎牛血清购自美国Gibco公司,淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司。
1.2 人CD40L和IL-2的克隆
用淋巴细胞分离液分离人外周血单个核细胞(PMBCs)后,用RNA提取试剂盒提取总RNA,按ThermoScriptTM试剂盒说明书合成第一链cDNA。分别按人CD40L 和hIL-2在GenBank登记的序列号NM_000074(CD40L)和NM_000586(IL-2)设计二对引物。CD40L上游引物:5’-ggaattcgccatggtcgaaacatacaacc-3’ (5’端引入EcoRⅠ位点,下划线部分表示引入位点,下同);下游引物:5’-cgggatcctcagagtttgagtaagcc-3’(5’端引入BamHⅠ位点)。 IL-2上游引物:5’-cgggatccatggacaggatgcaactc-3’(5’端引入BamH Ⅰ位点);下游引物:5’-cccaagcttcaagtcagtgttgagatgatg-3’(5’端引入Hind Ⅲ位点)。扩增的PCR片段分别插入pcDNA3.1/Myc-His(-)B真核表达载体相应的酶切位点中,分别构建pcDNA3.1(-)CD40L和pcDNA3.1(-) IL-2,测序证明克隆序列的正确性。
1.3 Ad5/F35 CD40L-IL-2腺病毒载体的构建和扩增
为构建共表达CD40L和IL-2腺病毒载体,先构建共表达CD40L和IL-2的腺病毒载体穿梭质粒pDC315 CD40L-IL-2。用EocR I和BamH I双酶切将CD40L片段从pcDNA3.1(-)CD40L切下,插入腺病毒穿梭质粒pDC315(加拿大Microbix Inc公司)相应的酶切位点中,构成pDC315 CD40L。为构建内部核酸加入位点(IRES)连接的IL-2,设计一对IL-2引物,上游引物:5 ’-catgccatggacaggatgcaactcc-3 ’(在5’端引入Nco Ⅰ位点),下游引物:5 ’-ccgctcgagtcaagtcagtgttgagat-3’(在5’端引入Xho I位点)。PCR从pcDNA3.1(-) IL-2质粒中扩增IL-2片段并用Nco Ⅰ和Xho Ⅰ双酶切,pmRNA IRES-luc[5]载体亦用Nco Ⅰ和Xho Ⅰ双酶切,电泳胶回收pmRNA IRES片段,将IL-2和pmRNA IRES连接构建pmRNA IRES-IL-2。再用BamH Ⅰ和Xho Ⅰ双酶切,胶回收含IRES-IL-2片段,插入pDC515 GM-CSF相应位点,形成pDC315 CD40L-IRES-IL-2(简写成pDC315 CD40L- IL-2)。
Ad5/F35 CD40L-IL-2腺病毒载体的包装送北京本元正阳基因技术有限公司,在公司包装成功获得毒种经PCR鉴定正确后,将毒种感染293细胞进行扩增,收集293细胞冻溶裂解后,用2次CsCl梯度离心获得纯化的Ad GM-CSF-IL-2。采用TCID50法鉴定病毒滴度。
1.4 人单核细胞来源DC的培养
取健康供者外周血20 ml,用淋巴细胞分离液密度梯度离心法分离出人外周血单个核细胞(PBMCs),采用黏附贴壁法培养DCs,方法参照文献[6]。PBMCs用RPMI-1640完全性培养基(PRMI-1640培养基加10%的胎牛血清)重悬,按2×106/ml加入一次性175 cm2塑料培养瓶中,贴壁1 h后吸出非黏附的细胞和培养液,加入含GM-CSF(800 U/ml)和IL-4(250 U/ml)的RPMI-1640完全性培养液20 ml,培养至第3天后,再补充上述含GM-CSF和IL-4的培养液20 ml,培养至第5天,行表型鉴定或将其感染腺病毒后进行下游检测。
1.5 腺病毒载体感染DC
收集培养至第5天的DC,离心后用含GM-CSF和IL-4的RPMI-1640完全性培养液重悬,调整细胞数为5×105/ml,加入6孔板中,每孔3 ml。按100 pfu/细胞病毒滴度加入Ad5/F35 CD40L-IL-2或Ad5/F35 EGFP[7],感染2 h后收集细胞,离心并用含GM-CSF和IL-4的RPMI-1640完全性培养液重悬后放回6孔板中,分别于6、12和24 h后收取少量上清后冻存至-20℃直至行ELISA检测及24 h后收集DC进行表型测定,取Ad5/F35 EGFP感染的少许DC,用4%的多聚甲醛固定后于荧光显微镜下观察绿色荧光蛋白的表达情况。
1.6 流式细胞仪检测
DC表型测定、腺病毒载体对DC感染的效率用流式细胞仪检测。收集待检细胞,离心(1000 rpm,5 min),用PBS洗1次。再次离心,如检测腺病毒感染效率,则用400 μl PBS重悬后上机检测;如行表型测定,则向细胞中加入待染的单抗,室温下避光孵育30 min后用PBS洗2次,再用400 μl PBS重悬后上机检测,流式细胞仪为Beckman-Coulter四色流式细胞仪(Coulter Epics XL)。
1.7 ELISA检测
将上述各个时间点收集的培养液解冻,所有样本稀释5倍后,按IL-2和IL-12 ELISA试剂盒说明书提供的方法测定上清中IL-2和IL-12蛋白的水平。
2 结果
2.1 CD40L和IL-2基因的克隆结果
从健康人PBMCs获取总RNA,逆转录合成第一链cDNA,应用CD40L和IL-2克隆引物PCR扩增可获得两条大小分别约700 bp和450 bp左右的片段,经限制性内切酶酶切后插入真核表达载体pcDNA3.1/Myc-His(-)B相应的位点中,经相应引物鉴定,阳性克隆送生工(北京)生物科技有限公司测序证实,克隆获得的CD40L和IL-2片段序列分别与GenBank提供的CD40L NM_000074(708 bp)序列号和IL-2 NM_000586(462 bp)序列号序列完全一致。
2.2 Ad5/F35 CD40L-IL-2的构建结果
先将CD40L亚克隆至腺病毒穿梭质粒pDC315中,然后再将IRES-IL-2片段插入GM-CSF后,使CD40L和IL-2通过IRES序列串联起来,并在同一CMV启动子的调控下。将构建好的腺病毒穿梭质粒pDC315 CD40L-IL-2送腺病毒包装专业公司北京本元正阳基因技术有限公司进行包装出毒,提取毒种DNA行PCR鉴定,分别用CD40L和IL-2克隆引物进行PCR扩增,可获得两条与CD40L和IL-2基因片段大小一致的片段(图1),表明CD40L和IL-2均在腺病毒DNA基因组上。毒种通过在293细胞中反复扩增,并用CsCl纯化,即可获得1010~1011pfu的病毒滴度的病毒。
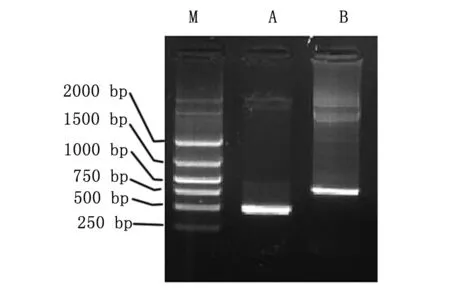
图1 引物PCR扩增Ad5/F35 CD40L-IL-2病毒DNA结果
2.3 Mo-DC的表型特征
培养至第5天的DC,分别用CD86、CD80、CD83、CD40和HLA-DR抗体染色。结果显示,第5天的DC表现为不成熟的表型,即CD80、CD86、CD40等共刺激分子和MHC Ⅱ分子HLA-DR适度表达,而CD83呈低表达(图2)。

图2 腺病毒感染Mo-DC前后表型的变化
2.4 Ad5/F35腺病毒载体对Mo-DC的感染效率
病毒滴度为100 pfu/细胞的Ad5/F35 EGFP或Ad5/F35 CD40L-IL-2感染Mo-DC 24 h,应用流式细胞仪检测EGFP的表达率,结果显示Ad5/F35 EGFP对Mo-DC的感染效率为76.8%,流式细胞仪检测CD40L表达,其表达率基本与EGFP相近,为75.2%(图3)。荧光显微镜下可见绿色荧光。
2.5 Ad5/F35 CD40L-IL-2诱导Mo-DC的成熟和产生IL-12
病毒滴度为100 pfu/细胞的Ad5/F35 EGFP或Ad5/F35 CD40L-IL-2感染Mo-DC 后24 h后,应用流式细胞仪检测Mo-DC的表型变化,结果显示Ad5/F35EGFP感染Mo-DC 24 h后,CD86、CD80、CD83和CD40 和HLA-DR的表达水平上调,而感染Ad5/F35 CD40L-IL-2 24 h后,DC表面CD86、CD80、CD83、CD40和HLA-DR的表达水平上调更为明显(图2),表明腺病毒本身感染Mo-DC可诱导DC的激活和成熟,而在DC表达CD40L后其表型改变更为明显,更倾向于成熟表型。ELISA检测Ad5/F35 CD40L-IL-2或Ad5/F35 EGFP感染Mo-DC 6 h、12 h和24 h时细胞上清中IL-2和IL-12的含量,结果显示见图4A,当CD40L-IL-2感染Mo-DC 6 h后即可检测到IL-12的表达,感染24 h后其表达量会继续上升,尽管单纯的Ad5/F35 EGFP感染也能诱导IL-12的产生,且分泌方式相似,但IL-12的分泌量却明显低于Ad5/F35 CD40L-IL-2感染DC后的分泌量,两者相差2~8倍。此外,检测感染了Ad5/F35 CD40L-IL-2的Mo-DC培养上清液,可检测到高水平的IL-2,而Ad5/F35 EGFP感染的Mo-DC中其仅呈低水平表达(图4B)。
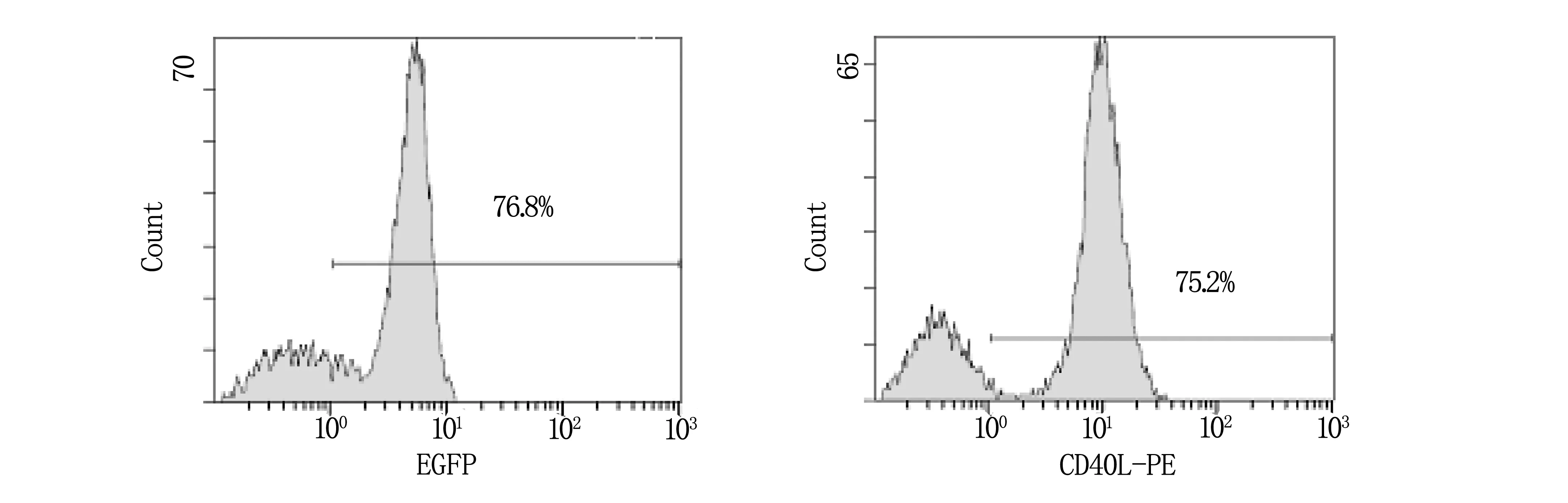
图3 Ad5/F35腺病毒载体对Mo-DC的感染效率
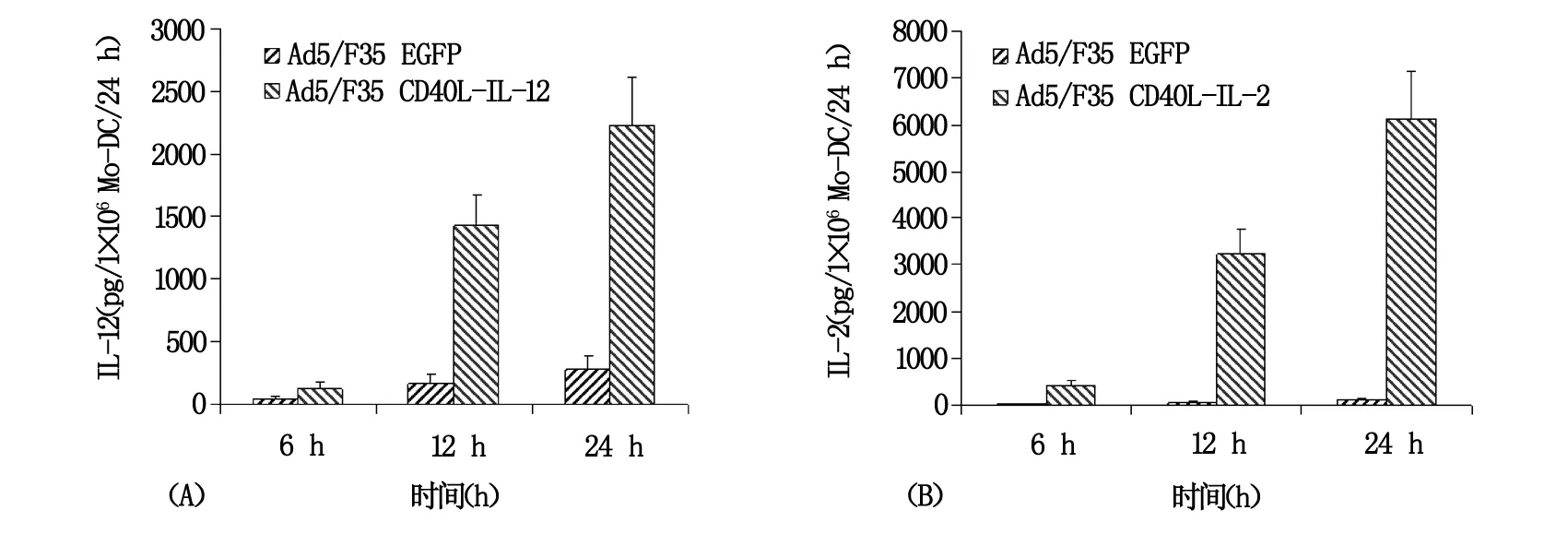
图4 Mo-DC感染腺病毒载体后IL-12和IL-2的表达
3 讨论
以DC为基础的肿瘤免疫治疗是目前常用的肿瘤免疫治疗策略之一。DC获得肿瘤相关抗原的刺激后,需对抗原信息进行加工、处理并递呈给T细胞,使初始(naÏve)T淋巴细胞转化成能识别和杀伤相应肿瘤细胞的细胞毒性T淋巴细胞(CTL)。从DC诱导CTL的产生至少需要3个信号[8],其中肿瘤抗原经DC的加工、处理后以MHC-抗原肽复合物(第一信号)的形式递呈给T细胞,包括CD4+和CD8+T淋巴细胞,而DC表面表达的共刺激分子如CD80、CD86和CD40等作为第二信号与T细胞表面表达的共刺激分子配基相互作用,活化T细胞以及DC和CD4+T细胞分泌多种细胞因子(第三信号)主要包括IL-2、IL-12和TNF-α等Th1细胞因子促进效应性CD8+T淋巴细胞的大量增殖,从而产生具有肿瘤抗原特异性的细胞毒性T淋巴细胞(CTL)。体外培养DC多从外周血CD14+的单核细胞(Monocytes)通过GM-CSF和IL-4诱导分化而成,但经上述2种细胞因子诱导产生的DC为不成熟表型,即表面共刺激分子和MHC Ⅱ分子的表达较低,这些不成熟的DC需要诱导成熟后才能作为瘤苗刺激机体产生特异性的抗肿瘤免疫反应。在体外实验和动物模型中,常用细菌脂多糖(LPS)诱导DC的成熟[9],而在临床背景下,常用多种细胞因子组合即IL-1β、IL-6、TNF-α和PGE2共孵育24~48 h[3]。但这类方法存在耗时长(24~48 h)、成本高等缺点。DC对淋巴瘤的免疫治疗在临床应用中也得到较好疗效[10]。已知CD40和CD40L的相互作用对DC功能十分重要,在体内,CD4+T细胞表达的CD40L和DC表面的CD40相互作用,是DC刺激产生肿瘤特异性CTL产生的必要条件[11],应用抗CD40单克隆抗体或CD40L刺激DC可使DC不依赖CD4+T细胞产生有效的抗肿瘤免疫反应[12,13]。用表达CD40L的腺病毒载体[14,15]感染DC在动物实验中被证实能有效地诱导抗肿瘤免疫应答,而诱导抗肿瘤免疫应答与CD40L诱导DC的成熟和多种细胞因子的产生有关[16],特别是IL-12的产生[17]。有学者把表型为DC成熟表型,但不产生IL-12的DC称之为半成熟DC,只有同时为成熟表型且产生IL-12的DC称之为成熟的DC,只有成熟的DC才能诱导有效的抗肿瘤免疫应答[18]。
本研究构建了一个共表达CD40L和IL-2的5/F35嵌合型腺病毒载体,感染人外周血单核细胞来源的DC后可诱导DC表型成熟和产生大量的IL-12。本研究具有以下特点:①共表达CD40L和IL-2有利于增强抗肿瘤效果:单独用腺病毒载体表达CD40L已被证实能有效地诱导抗肿瘤免疫应答[19],但DC刺激肿瘤特异性CTL产生后CTL的大量增殖需要多种淋巴细胞增殖因子的刺激,特别是IL-2,尽管DC和CD4+T淋巴细胞本身也能产生一定量的IL-2,但外源性表达IL-2作用更稳定和更持久。研究证实,CD40L和IL-2具有协同的抗肿瘤效果,而Rousseau等则将这些体外和动物实验研究的结果转化至临床,他们应用Ad IL-2和Ad CD40L感染原代培养的皮肤成纤维细胞后与自体白血病细胞混合后皮内注射,可在患者体内监测到机体产生了针对白血病细胞的应答[20]。我们将CD40L和IL-2共表达在同一载体上,在今后可能的应用中,可减少操作步骤(只需生产一个载体)和降低成本等;此外,应用表达CD40L腺病毒载体感染DC后可明显缩短DC在体外成熟的时间,因为一旦DC感染腺病毒后,CD40L诱导DC成熟的过程是恒定的,不会因为DC是在体内还是在体外发生改变。因此,DC被腺病毒感染后即可进行接种,让DC的成熟过程在体内完成,而无需像用细胞因子诱导成熟那样需在体外培养24~48 h。②利用5/F35嵌合型腺病毒作为载体,可高效地感染造血系统来源的细胞包括树突状细胞。已知5型腺病毒对包括树突状细胞在内的造血系统来源的细胞感染效率低下,因为造血系统来源细胞的柯萨奇-腺病毒受体(CAR)表达较低甚至缺失[21],5型腺病毒进入细胞需要依赖该受体;而5/F35嵌合型腺病毒载体进入细胞的机制是通过CD46,该分子普遍表达在各类细胞包括造血系统来源的细胞[22]。5/F35嵌合型腺病毒载体能高效感染人单核细胞来源的DC[23],我们的研究也获得了相似的结果。③一个腺病毒载体同时编码2个基因,用内部核酸进入位点(IRES)序列将CD40L和IL-2 2个基因连接,受一个CMV启动子调控,2个基因均获得有效表达。尽管IRES是1种常用的双基因表达载体的构成元件[24,25],但在不同的体系下,IRES连接的2个基因的表达水平并不完全一致,常常是靠近启动子的基因表达水平高,而IRES下游的基因表达水平较低,甚至不能有效地表达[26]。而本研究中证实用IRES连接的CD40L和IL-2均能获得高效的表达,可能与利用Nco I位点(ccatgg)将连接IRES和IL-2,形成Kozak序列(accatgg),有利于IL-2的表达。
[1] de Vries IJ,Lesterhuis WJ,Scharenborg NM,et al.Maturation of dendritic cells is a prerequisite for inducing immune responses in advanced melanoma patients〔J〕.Clin Cancer Res,2003,9:5091.
[2] Kim R,Emi M,Tanabe K.Functional roles of immature de-ndritic cells in impaired immunity of solid tumour and their targeted strategies for provoking tumour immunity〔J〕.Clin Exp Immunol,2006,146(2):189.
[3] Castiello L,Sabatino M,Jin P,et al.Monocyte-derived DC maturation strategies and related pathways:a transcriptional view〔J〕.Cancer Immunol Immunother,2011,60(4):457.
[4] Mossoba ME,Medin JA.Cancer immunotherapy using virally transduced dendritic cells:animal studies and human clinical trials〔J〕.Expert Rev Vaccines,2006,5(5):717.
[5] Tan X,Wan Y.Enhanced protein expression by IRES-driven mRNA translation as a novel approach for in vitro loading dendritic cells with antigens〔J〕.Human Immunol,2008,69(1):32.
[6] Erdmann M,Schuler-Thurner B.Towards a standardized p-rotocol for the generation of monocyte-derived dendritic cell vaccines〔J〕.Methods Mol Biol,2010,595:149.
[7] 陈 鹏,谭晓华,马晶莹,等.5和5F35型腺病毒载体对人骨髓间充质干细胞转染效率的比较〔J〕.中国组织工程与临床康复杂志,2009,13(19):3713.
[8] Boudreau JE,Bonehill A,Thielemans K,et al.Engineering Dendritic Cells to Enhance Cancer Immunotherapy〔J〕.Mol Ther,2011,19(5):841.
[9] Morelli AE,Zahorchak AF,Larregina AT,et al.Cytokine production by mouse myeloid dendritic cells in relation to differentiation and terminalmaturation induced by lipopolysaccharide or CD40 ligation 〔J〕.Blood,2001,98(5):1512.
[10] 郭 智,陈 霞,谭小华,等.淋巴瘤化疗后行DC治疗的疗效分析〔J〕.实用癌症杂志,2009,24(4):391
[11] Kelleher M,Beverley PC.Lipopolysaccharide modulation of dendritic cells is insufficient to mature dendritic cells to generate CTLs from naive polyclonal CD8+T cells in vitro,whereas CD40 ligation is essential〔J〕.J Immunol,2001,167(11):6247.
[12] Kikuchi T,Worgall S,Singh R,et al.Dendritic cells genetically modified to express CD40 ligand and pulsed with antigen can initiate antigen-specific humoral immunity independent of CD4+T cells〔J〕.Nat Med,2000,6(10):1154.
[13] Hernandez MG,Shen L,Rock KL.CD40-CD40 ligand interaction between dendritic cells and CD8+T cells is needed to stimulate maximal T cell responses in the absence of CD4+T cell help〔J〕.J Immunol,2007,178(5):2844.
[14] Thacker EE,Nakayama M,Smith BF,et al.A genetically e-ngineered adenovirus vector targeted to CD40 mediates transduction of caninedendritic cells and promotes antigen-specific immune responses in vivo〔J〕.Vaccine,2009,27(50):7116.
[15] Kikuchi T,Moore MA,Crystal RG.Dendritic cells modified to express CD40 ligand elicit therapeutic immunity against preexisting murine tumors〔J〕.Blood,2000,96(1):91.
[16] Tada Y,O-Wang J,Yu L,et al.T-cell-dependent antitumor effects produced by CD40 ligand expressed on mouse lung carcinoma cells are linked with the maturation of dendritic cells and secretion of a variety of cytokines〔J〕.Cancer Gene Ther,2003,10(6):451.
[17] Stax AM,Crul C,Kamerling SW,et al.CD40L stimulation of rat dendritic cells specifically favors the IL-12/IL-10 ratio resulting in a strong T cell stimulatory capacity〔J〕.Mol Immunol,2008,45(9):2641.
[18] Lutz MB,Schuler G.Immature,semi-mature and fully mature dendritic cells:which signals induce tolerance or immunity〔J〕.Trends Immunol,2002,23(9):445.
[19] Gonzalez-Carmona MA,Lukacs-Kornek V,Timmerman A,et al.CD40ligand-expressing dendritic cells induce regression of hepatocellular carcinoma by activating innate and acquired immunity in vivo〔J〕.Hepatology,2008,48(1):157.
[20] Rousseau RF,Biagi E,Dutour A,et al.Immunotherapy of high-risk acute leukemia with a recipient (autologous) vaccine expressing transgenic human CD40L and IL-2 after chemotherapy and allogeneic stem cell transplantation〔J〕.Blood,2006,107(4):1332.
[21] Balamotis MA,Huang K,Mitani K.Efficient delivery and stable gene expression in a hematopoietic cell line using a chimeric serotype 35 fiber pseudotyped helper-dependent adenoviral vector〔J〕.Virology,2004,324(1):229.
[22] Gaggar A,Shayakhmetov DM,Lieber A.CD46 is a cellular receptor for group B adenoviruses〔J〕.Nat Med,2003,9(11):1408.
[23] Ophorst OJ,Kostense S,Goudsmit J,et al.An adenoviral type 5 vector carrying a type 35 fiber as a vaccine vehicle:DC targeting,cross neutralization,and immunogenicit〔J〕.Vaccine,2004,22(23-24):3035.
[24] Licursi M,Christian SL,Pongnopparat T,et al.In vitro and in vivo comparison of viral and cellular internal ribosome entry sites for bicistronicvector expression〔J〕.Gene Ther,2011,18(6):631.
[25] Yang S,Cohen CJ,Peng PD,et al.Development of optimal bicistronic lentiviral vectors facilitates high-level TCR gene expression and robust tumor cell recognition〔J〕.Gene Ther,2008,15(21):1411.
[26] Ngoi SM,Chien AC,Lee CG.Exploiting internal ribosome entry sites in gene therapy vector design 〔J〕.Curr Gene Ther,2004,4(1):15.
