甘露聚糖酶对罗非鱼生长性能、消化代谢和非特异性免疫力的影响
2013-12-20毛述宏林仕梅李斌斌
毛述宏 林 鑫 杨 阳 林仕梅* 罗 琳 李斌斌
(1.西南大学淡水鱼类资源与生殖发育教育部重点实验室,重庆 400716;2.西南大学动物科技学院,重庆 400716;3.北京市水产科学研究所,北京 100068)
罗非鱼是我国南方的主养经济鱼类。由于动物蛋白质资源短缺、价格昂贵,加之养殖罗非鱼的市场价格低迷,所以养殖者在罗非鱼饲料中大量使用植物蛋白质源以控制饲料成本。众所周知,植物蛋白质源中含有大量的非淀粉多糖(NSP)抗营养因子,如甘露聚糖,它会影响动物对饲料中营养物质的消化利用[1-2]。目前,饲料生产实践中主要通过添加外源性NSP酶或生物发酵以减轻或消除饲料中NSP的抗营养作用[3-4]。甘露聚糖酶作为一种NSP酶,不仅能改善动物的生长性能[5-6],还能 提 高 动 物 的 免 疫 能 力[7-8],且 已 在 畜[9]、禽[10-11]饲料中广泛应用。而有关甘露聚糖酶在水产动物饲料中的应用研究还未见报道。为此,本试验以吉富罗非鱼(GIFT,Oreochromis niloticus)为试验对象,在实用配方的基础上,从生长性能、消化代谢和非特异性免疫力等方面去比较和评价甘露聚糖酶的作用效果,以期为甘露聚糖酶在水产饲料中的科学应用提供理论依据。
1 材料与方法
1.1 试验饲料
以豆粕、菜籽粕和棉籽粕为主要蛋白质源,以米糠、豆油和亚麻籽油为脂肪源配制基础饲料(表1),在此基础上分别添加 0(对照)、500和1 000 U/kg甘露聚糖酶(活性9 000 U/g,最适催化温度65℃,最适催化pH 6.0)配制成3种等氮(粗蛋白质水平为 33.5%)等能(总能为15.7 MJ/kg)的试验饲料。各饲料原料粉碎过60目筛,采取逐级稀释法混合均匀,制成粒径为2.5 mm的硬颗粒饲料,风干后放入4℃冰箱中保存备用。
1.2 试验设计与饲养管理
试验鱼选用当年培育的体质健壮、规格整齐的雄性吉富罗非鱼[平均体重为(5.80±0.01)g]270尾,随机分成3组(每组设3个重复,每个重复30尾),随机饲喂1种试验饲料,在室内淡水循环水族缸(有效体积为300 L)中饲养8周,日投饲率为体重的3% ~5%,每天08:00、12:30、17:00各投喂1次。水源为曝气自来水,试验期间水温为(27.8 ±2.2)℃,pH 为 7.4 ±0.4,溶解氧 >6.5 mg/L,氨 氮 < 0.50 mg/L,亚 硝 酸 盐 氮 <0.06 mg/L。
1.3 样品制备与分析
饲养试验结束后,禁食24 h后称重并计数。每缸随机取5尾鱼于尾静脉取血,将一部分血液样品保存在医用真空采血管中,用于血液细胞分析和血液生化分析;其余血液样品置4℃冰箱过夜,于4℃条件下以6 000 r/min离心10 min,收集血清,-20℃保存备用。每缸另随机取3尾鱼,取出肠道(全肠),立即放入液氮罐中速冻,然后转入-80℃低温冰箱保存。肠道匀浆液在10 000×g、4℃条件下离心30 min,取上清液作为酶活性分析样品,-20℃保存备用。
采用全自动血细胞分析仪(迈瑞,BC-5180)检测白细胞(WBC)总数及中性粒细胞、淋巴细胞和单核细胞百分比。
采用全自动血液生化分析仪(迈瑞,BC-3000)检测血液谷丙转氨酶(ALT)、谷草转氨酶(AST)活性及总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、极低密度脂蛋白胆固醇(VLDL-C)含量。
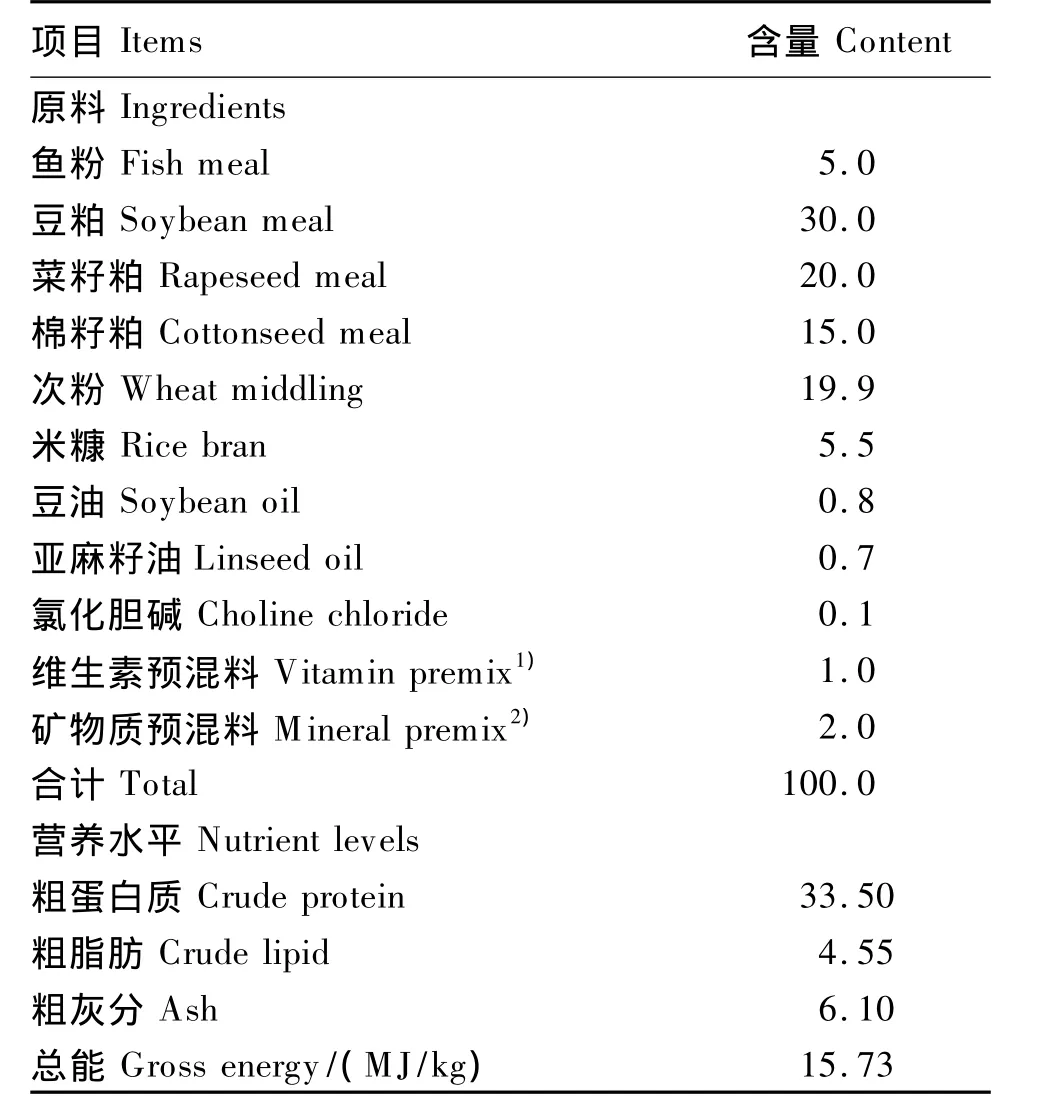
表1 基础饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
血清碱性磷酸酶(AKP)、过氧化氢酶(CAT)、总超氧化物歧化酶(T-SOD)以及肠道淀粉酶、胰蛋白酶、Na+,K+-ATP酶活性均采用南京建成生物工程研究所生产的试剂盒进行测定。AKP的活性单位定义为100 mL血清在37℃与基质作用15 min产生1 mg酚为1个金氏单位;CAT的活性单位定义为每毫升血清每秒钟分解1μmol H2O2的量为1个活性单位(U);T-SOD的活性单位定义为每毫升反应液中T-SOD抑制率大于50%时所对应的T-SOD量为1个活性单位(U);淀粉酶的活性单位定义为每毫克组织蛋白质在37℃与底物作用30 min,水解10 mg淀粉为1个活性单位(U);胰蛋白酶的活性单位定义为在 pH 8.0、37℃条件下,每毫克组织蛋白质含有的胰蛋白酶每分钟使吸光度变化0.003为1个活性单位(U);Na+,K+-ATP酶的活性单位定义为每小时每毫克组织蛋白质中 Na+,K+-ATP酶分解 ATP产生1μmol无机磷的量为1个活性单位(U)。组织中蛋白质含量采用考马斯亮蓝法测定。
1.4 计算公式
特定生长率(specific growth rate,SGR,%/d)=100×[ln末重(g)-ln初重(g)]/试验天数(d);
饲料系数(feed conversion ratio,FCR)=总干物质摄食量(g)/鱼体总增重(g);
蛋白质效率(protein efficiency rate,PER,%)=100×[末重(g)-初重(g)]/[总干物质摄食量(g)×蛋白质含量];
摄食量(feed intake,FI,g/d)=总干物质摄食量(g)×2/[(鱼初始尾数+鱼终末尾数)×试验天数(d)];
成活率(survival ratio,SR,%)=100 ×终末鱼尾数(尾)/初始鱼尾数(尾)。
1.5 数据处理与分析
数据均以平均值和标准误表示,采用SPSS 17.0对所得数据进行单因素方差分析(one-way ANOVA),若差异达到显著水平,则进行Tukey多重比较,显著性水平为P<0.05。
2 结果与分析
2.1 甘露聚糖酶对罗非鱼生长性能的影响
由表2可知,1 000 U/kg组罗非鱼的末重、SGR和PER均显著高于对照组和500 U/kg组(P<0.05),而对照组与500 U/kg组之间差异不显著(P>0.05)。各组罗非鱼的 FCR、FI均差异不显著(P>0.05)。试验期间,各组罗非鱼的SR均为100.00%。
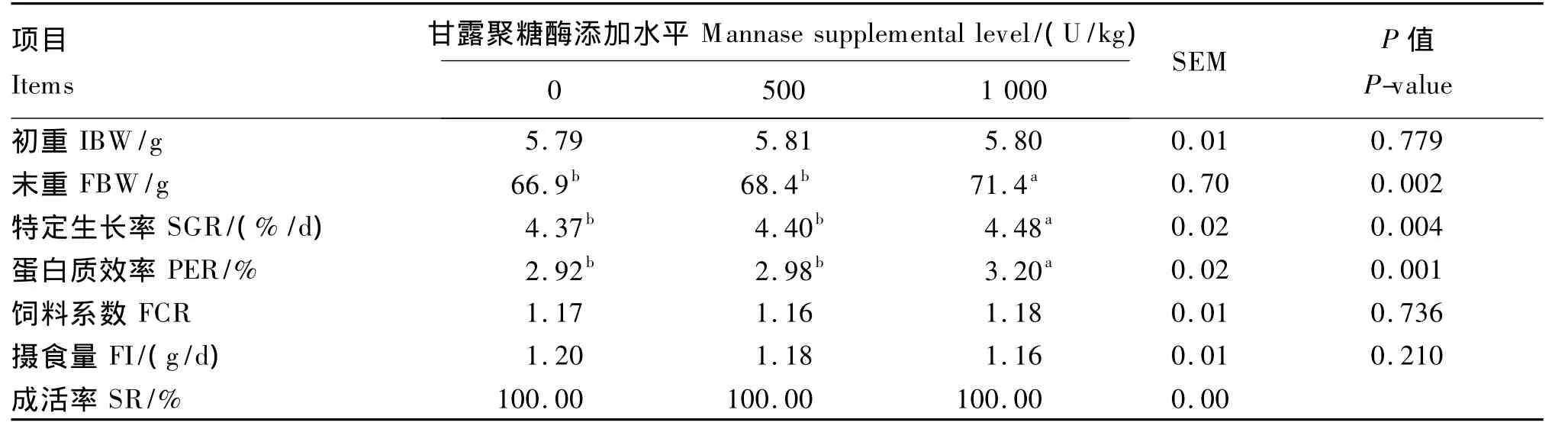
表2 甘露聚糖酶对罗非鱼生长性能的影响Table 2 Effects of mannose on growth performance of tilapia
2.2 甘露聚糖酶对罗非鱼肠道消化酶活性的影响
由表3可知,随着饲料中甘露聚糖酶添加水平的增加,罗非鱼肠道中淀粉酶、胰蛋白酶、Na+,K+-ATP酶的活性均显著升高(P<0.05)。
2.3 甘露聚糖酶对罗非鱼血液代谢指标的影响
由表4可知,1 000 U/kg组罗非鱼血液AST活性、HDL-C含量显著低于对照组和500 U/kg组(P <0.05),而 TC、VLDL-C 含量却显著高于对照组和500 U/kg组(P<0.05)。500 U/kg组罗非鱼血液AST活性及 TC、VLDL-C和HDL-C含量与对照组差异不显著(P>0.05)。各组罗非鱼血液TG、LDL-C含量及ALT活性均无显著差异(P>0.05)。
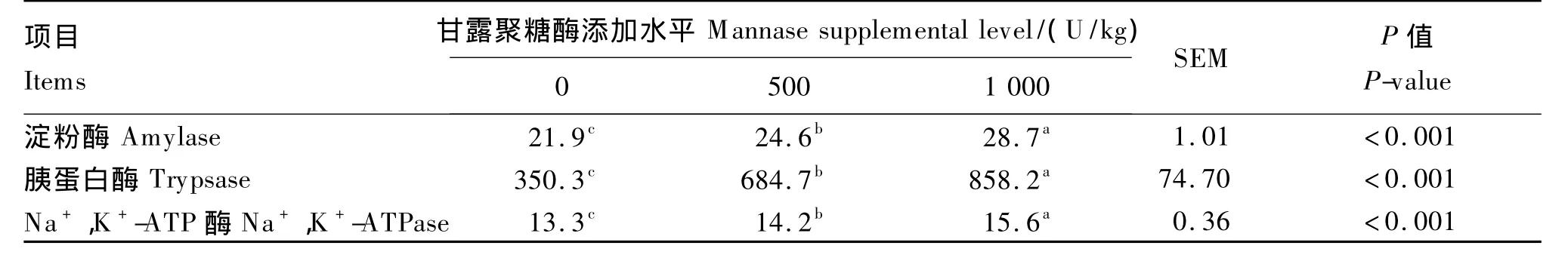
表3 甘露聚糖酶对罗非鱼肠道消化酶活性的影响Table 3 Effects of mannase on intestinal digestive enzyme activities of tilapia U/mg prot
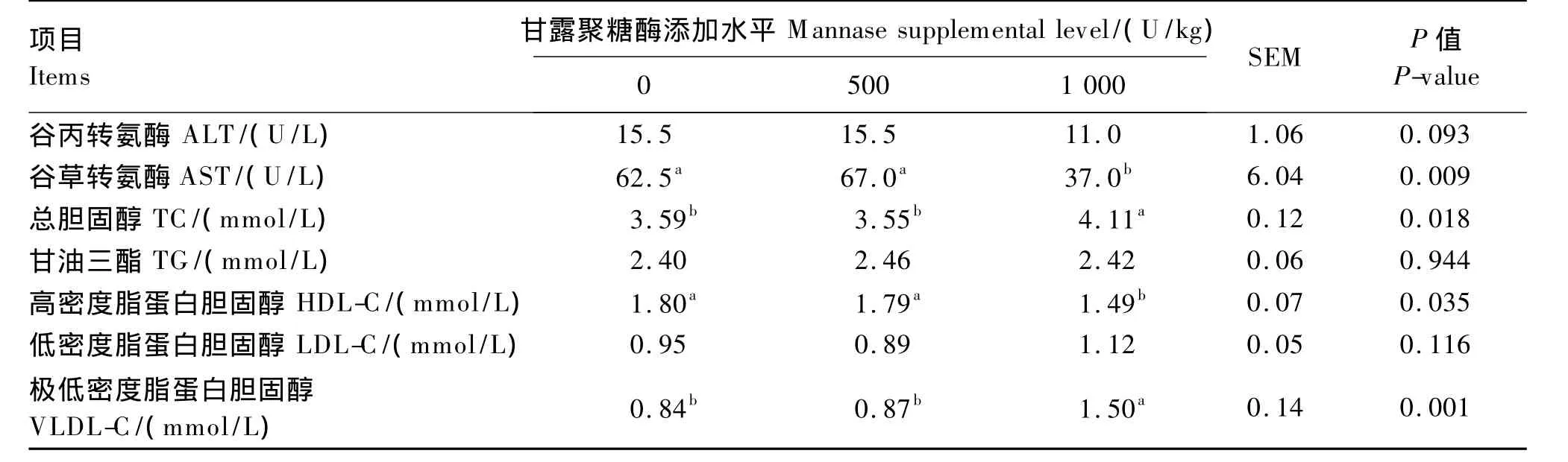
表4 甘露聚糖酶对罗非鱼血液代谢指标的影响Table 4 Effects of mannase on blood metabolic indexes of tilapia
2.4 甘露聚糖酶对罗非鱼非特异性免疫力的影响
由表5可知,饲料中添加甘露聚糖酶对罗非鱼全血白细胞总数无显著影响(P>0.05)。500和1 000 U/kg组罗非鱼全血中性粒细胞、单核细胞百分比以及血清AKP活性均显著高于对照组(P<0.05),而全血淋巴细胞百分比却显著低于对照组(P<0.05)。500 U/kg组罗非鱼全血淋巴细胞、中性粒细胞和单核细胞百分比以及血清AKP活性与1 000 U/kg组之间差异不显著(P>0.05)。500 U/kg组罗非鱼血清CAT活性最高,其次是1 000 U/kg组,以对照组最低,各组间差异显著(P<0.05)。各组罗非鱼血清T-SOD活性差异不显著(P >0.05)。
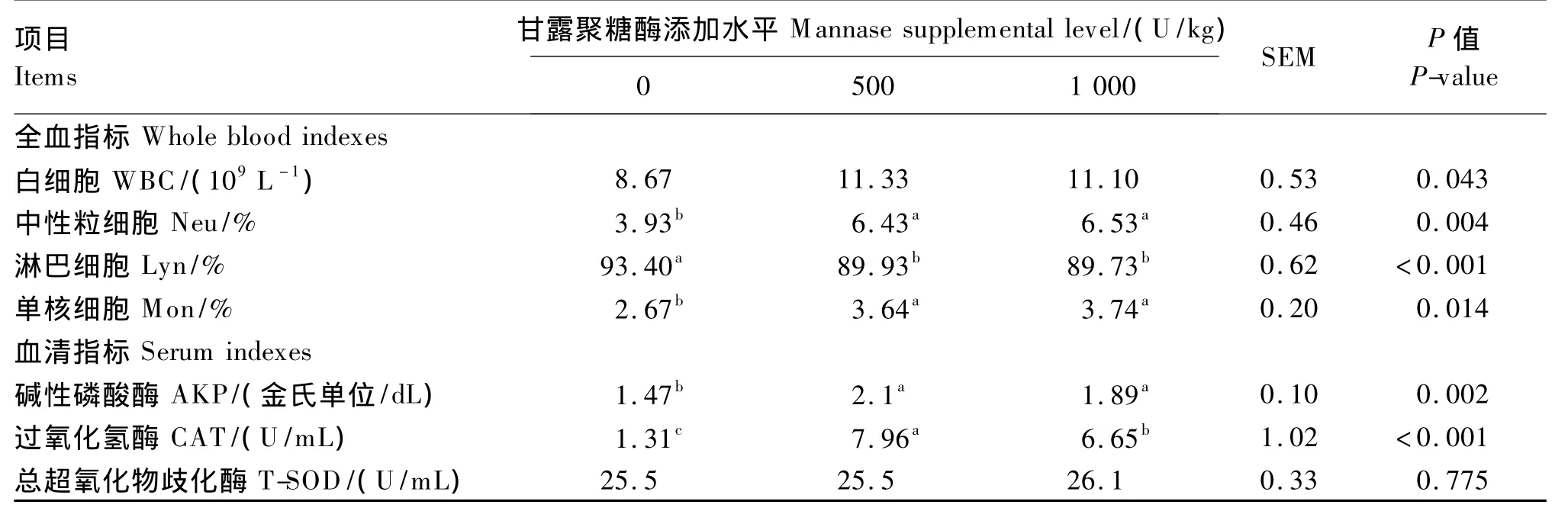
表5 甘露聚糖酶对罗非鱼非特异性免疫力的影响Table 5 Effects of mannose on non-specific immunity of tilapia
3 讨论
3.1 甘露聚糖酶对罗非鱼生长性能的影响
本试验结果表明,在饲料中添加甘露聚糖酶能显著促进罗非鱼的生长。同样,在饲料中添加甘露聚糖酶也能够改善鸡[5,12]和猪[6]的生长效果。研究认为,甘露聚糖酶能够减轻或消除甘露聚糖的抗营养作用,降低动物肠道食糜黏度,提高饲料能量和营养物质的表观消化率。此外,甘露聚糖酶还能破坏植物饲料中细胞壁的结构,使细胞内的营养物质释放出来以供动物机体利用,从而促进动物的生长[13]。也有研究发现,饲料中添加甘露聚糖酶显著提高仔猪血清中胰岛素样生长因子-1(IGF-1)的含量[14]。本试验结果还表明,甘露聚糖酶对罗非鱼生长的促进作用具有一定的剂量依赖性。关于甘露聚糖酶对罗非鱼的促生长作用机理还有待进一步研究。
3.2 甘露聚糖酶对罗非鱼消化代谢的影响
研究发现饲料中添加甘露聚糖酶可以提高肉鸡[12]、断奶仔猪[15]肠道中淀粉酶和胰蛋白酶的活性。本研究也发现,饲料中添加甘露聚糖酶不仅能够提高罗非鱼肠道淀粉酶和胰蛋白酶活性,还能够提高肠道Na+,K+-ATP酶活性。这可能是鱼类消化酶活性对饲料营养组成变化的适应性调整。而饲料中添加外源性甘露聚糖酶不影响罗非鱼的摄食量,这进一步说明甘露聚糖酶可能是通过提高罗非鱼肠道对营养物质的消化吸收能力,进而促进其生长性能的改善。
大量研究证实,饲料中NSP含量升高会降低鱼类饲料蛋白质[16-17]或脂肪[17-18]的消化率,还会降低鱼类血浆、肌肉中胆固醇含量[19-20]。本试验结果发现,甘露聚糖酶高剂量(1 000 U/kg)组罗非鱼血液中AST活性显著降低,鱼体蛋白质沉积率增加,同时也发现甘露聚糖酶高剂量组罗非鱼血液中TC含量显著升高。这可能是因为甘露聚糖酶降低了饲料中NSP的含量,提高了饲料中营养物质(蛋白质和脂肪)的消化率。饲料中NSP的存在会使鱼类肠道黏度增加,脂肪的乳化、分解受阻[21]。也有研究指出,NSP能包埋胆汁盐,进而使得动物对脂肪的消化吸收减少[22]。由此可见,采用NSP酶制剂降低饲料中NSP含量可能是提高动物对脂肪利用的一种有效途径。
3.3 甘露聚糖酶对罗非鱼非特异性免疫力的影响
本试验结果表明,饲料中添加甘露聚糖酶可以显著提高罗非鱼血液中性粒细胞和单核细胞的百分比以及血清AKP和CAT活性,这在畜禽上也有相关的研究报道。研究发现,甘露聚糖酶能提高肉鸡胸腺指数、脾脏指数和法氏囊指数[7],增加爱拔益加鸡血液中免疫球蛋白(Ig)M、IgG和IgA的含量[8];在饲料中添加甘露聚糖酶会显著提高断乳仔猪血液中T淋巴细胞转化率,血清IgA、IgG含量以及血清超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和AKP活性与总抗氧化能力(T-AOC),而显著降低血清丙二醛(MDA)含量[14]。这表明甘露聚糖酶能够提高动物机体的免疫力,但不同的动物所表现的免疫指标不同。在猪[14]、鸡[23]和一些水产动物[24-26]上的研究证实,甘露寡糖具有一定的免疫原性,能作为外源抗原佐剂与某些病原体表面结合刺激机体免疫应答;也可结合或者阻塞病原体上的糖蛋白受体抑制其在宿主肠道内增殖,调整肠道微生物区系;还能改善肠道黏膜形态结构,增强肠道对病原微生物的防御作用。本试验中添加甘露聚糖酶能增强罗非鱼的非特异性免疫相关指标,很可能是由于甘露聚糖酶降解甘露聚糖的产物甘露寡糖在发挥作用。有关甘露聚糖酶在鱼类方面的免疫作用机理还有待深入研究。
4 结论
饲料中添加适宜水平的甘露聚糖酶可以提高罗非鱼的消化吸收能力,增强非特异性免疫力,进而促进其生长。
[1] OLAV F K,MICHAEL P,TROND S,et al.Nutrient digestibilities and gut function in Atlantic salmon(Salmo salar)fed diets with cellulose or non-starch polysaccharides from soy[J].Aquaculture,2007,273(1):96-107.
[2] HANSEN J O,STOREBAKKEN T.Effects of dietary cellulose level on pellet quality and nutrient digestibilities in rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,2007,272(26):458 -465.
[3] 王纪亭,万文菊,吴淑勤,等.非淀粉多糖酶对奥尼罗非鱼蛋白酶、淀粉酶活性影响的研究[J].动物营养学报,2008,20(5):599 -605.
[4] 陈京华.非淀粉多糖酶对牙鲆消化酶活性和饲料消化率的影响[J].中国农学通报,2009,13:268-272.
[5] 李海英,郭云,刘武军,等.β-甘露聚糖酶对蛋雏鸡生长性能及发酵粪中氨气和硫化氢释放量的影响[J].中国饲料,2008(19):23 -26.
[6] YOON S Y,YANG Y X,SHINDE P L,et al.Effects of mannanase and distillers dried grain with soluble on growth performance,nutrient digestibility,and carcass characteristics of grower-finisher pigs[J].Journal of Animal Science,2010,88(1):181 -191.
[7] 李路胜,周响艳.甘露聚糖酶对肉鸡肠道微生物和免疫机能的影响[J].饲料工业,2010(6):15-18.
[8] 王书全.β-甘露聚糖酶对AA+鸡生产性能和免疫功能的影响[J].中国农学通报,2011,20:54 -57.
[9] JO J K,INGALE S L,KIN JS,et al.Effects of exogenous enzyme supplementation to corn-and soybean meal-based or complex diets on growth performance,nutrient digestibility,and blood metabolites in growing pigs[J].Journal of Animal Science,2012,90(9):3041-3048.
[10] LEE JT,BAILEY C A,CARTWRIGHT A L.β-mannanase ameliorates viscosity-associated depression of growth in broiler chickens fed guar germ and hull fractions[J].Poultry Science,2003,82:1925 - 1931.
[11] MEHRI M,ADIBMORADI M,SAMIE A,et al.Effects of β-mannanase on broiler performance,gut morphology and immune system[J].African Journal of Biotechnology,2010,37:6221 -6228.
[12] LI Y H,CHEN X A,CHEN Y Q,et al.Effects of beta-mannanase expressed by Pichia pastoris in cornsoybean meal diets on broiler performance,nutrient digestibility,energy utilization and immunoglobulin levels[J].Animal Feed Science and Technology,2010,159:59-67.
[13] PETTEY L A,CARTER S D,SENNE B W,et al.Effects of beta-mannanase addition to corn-soybean meal diets on growth performance,carcass traits,and nutrient digestibility of weanling and growing-finishing pigs[J].Journal of Animal Science,2002,80:1012 -1019.
[14] 李学俭.β-甘露聚糖酶对断乳仔猪生产性能的影响及其机理的研究[D].博士学位论文.沈阳:沈阳农业大学,2008.
[15] 应琳琳.β-甘露聚糖酶对断乳仔猪消化酶活性的影响[J].养殖与饲料,2009(4):52-56.
[16] LEENHOUWERS J I,TER V M,VERRETH JA J,et al.Digesta characteristiscs and performance of African catfish(Clarias gariepinus)fed cereal grains that differ in viscosity[J].Aquaculture,2007,264:330 -341.
[17] STOREBAKKEN T.Binders in fish feeds:Ⅰ.Effect of alginate and guar gum on growth,digestibility,feed intake and passage through the gastrointestinal tract of rainbow trout[J].Aquaculture,1985,47:11 - 26.
[18] KUMAR V,MAKKAR H P S,BECKER K.Physiological and haematological responses in rainbow trout(Oncorhynchus mykiss)juveniles fed detoxified Jatropha curcas kernel meal[J].Aquaculture Nutrition,2011,17(4):451 -467.
[19] HOSSAIN M A,FOCKEN U,BECKER K.Galactomannan-rich endosperm of Sesbania(Sesbania aculeate)seeds responsible for retardation of growth and feed utilisation in common carp,Cyprinus carpio L[J].Aquaculture,2001,203(1/2):121 -132.
[20] HOSSAIN M A,FOCKEN U,BECKER K.Antinutritive effects of galactomannan-rich endosperm of Sesbania(Sesbania aculeata)seeds on growth and feed utilisation in tilapia,Oreochromis niloticus[J].Aquaculture Research,2003,34:1171 -1179.
[21] PASQUIER B,ARMAND M,CASTELAIN C,et al.Emulsification and lipolysis of triacylglycerols are altered by viscous soluble dietary fibre in acidic gastric medium in vitro[J].Biochemical Journal,1996,314:269-275.
[22] EBIHARAM K,SCHNEEMAN B O.Interaction of bile acids,phospholipids,cholesterol and triglyceride with dietary fibres in the small intestine of rats[J].The Journal of Nutrition,1989,119:1100 -1106.
[23] FERNANDEZ F,HINTON M,VAN GILS B.Dietary mannan-oligosaccharides and their effect on chicken caecal microflora in relation to Salmonella enteritidis colonization[J].Avian Pathology,2002,31(1):49 -58.
[24] TORRECILLAS S,MAKOL A,BENITEZ-SANTANA T,et al.Reduced gut bacterial translocation in European sea bass(Dicentrarchus labrax)fed mannan oligosaccharides(MOS)[J].Fish & Shellfish Immunology,2011,30:674 -681.
[25] DIMITROGLOU A,MERRIFIELD D L,SPRING P,et al.Effects of mannan oligosaccharide(MOS)supplementation on growth performance,feed utilisation,intestinal histology and gut microbiota of gilthead sea bream(Sparus aurata)[J].Aquaculture,2010,300:182-188.
[26] ZHANG J,LIU Y,TIAN L,et al.Effects of dietary mannan oligosaccharide on growth gut morphology and stress tolerance of juvenile Pacific white shrimp(Litopenaeus vannamei)[J].Fish & Shellfish Immunology,2012,33:1027-1032.
