脱脂蚕蛹替代饲料中鱼粉对建鲤生长性能、体成分及健康状况的影响
2013-12-20张建禄黄吉芹邱立疆
张建禄 余 平 黄吉芹 吉 红,2,3* 邱立疆 杨 克
(1.西北农林科技大学动物科技学院,杨凌 712100;2.西北农林科技大学水产科学研究所,杨凌 712100;3.西北农林科技大学安康水产试验示范站,安康 725021)
鱼粉营养全面,适口性好,是主要的水产饲料蛋白质源[1-3],但随着资源减少及海洋污染等原因,鱼粉产量逐年下降,水产业的可持续性发展面临严峻挑战。因此,用非鱼粉蛋白质资源部分或全部代替饲料中的鱼粉成为近年来的研究热点[3]。蚕蛹是缫丝业副产品,通常缫制1 t生丝可得1.5 t干蚕蛹。我国蚕蛹资源丰富,产量约占世界总产量的70%,其中鲜蚕蛹年产量达50万t,可得干蚕蛹12万t[4]。陕西省是西北蚕蛹主产区之首,仅安康地区每年就能产干蚕蛹 0.25 万 t[5]。干蚕蛹含有50%~70%的粗蛋白质,除赖氨酸含量较低外,其他氨基酸含量丰富,配比均衡,营养价值可与鱼粉相媲美,是一种优质的昆虫蛋白质源[6]。
蚕蛹直接作为饲料蛋白质源已经在镜鲤(Cyprinus carpio var.specularis)[5]、尼罗罗非鱼(Oreochromis niloticus)[7]、麦瑞加拉鲮(Cirrhinus mrigala)[8]、南亚野鲮(Labeo rohita)[9]、喀拉鲃(Catla catla)[10]、印 度 大 鲤 鱼 (Cyprinus carpio)[11]、黄 鳝 (Monopterus ablbus)[12]、泥 鳅(Misgurnus anguillicaudatus)[12]等营养饲料学方面有一定的研究,表明蚕蛹可以部分替代饲料中鱼粉,但替代水平过高时会引起生长下降,肌肉色泽改变和肝、肠损伤等问题[4-6]。
蚕蛹含有24% ~33%的脂肪,其脂肪酸组成中不饱和脂肪酸占79.88%,高水平的不饱和脂肪酸易使蚕蛹氧化酸败,营养破坏、变臭而产生特殊的腥臭味[13]。同时,蚕蛹赖氨酸含量显著低于鱼粉[14],因此,推测限制在鱼类饲料中添加较高水平的蚕蛹主要原因是油脂酸败和氨基酸不平衡。针对这一问题,本文研究了脱脂蚕蛹在建鲤(Cyprinus carpio var.Jian)饲料中的应用,探讨了在蚕蛹高水平替代基础上添加晶体赖氨酸的效果,旨在明确脱脂蚕蛹替代鱼粉的最适水平及替代后添加晶体赖氨酸的可行性,为鲤全价人工配合饲料开发及蚕蛹利用提供科学依据。
1 材料与方法
1.1 试验饲料
试验蚕蛹[粗蛋白质56.7%,粗脂肪27.6%]购自陕西省安康市第二缫丝厂,在40℃下,石油醚∶蚕蛹为4∶1(v∶w),重复2次脱脂后获得脱脂蚕蛹(粗蛋白质70.2%,粗脂肪4.1%)。鱼粉(粗蛋白质62.8%,粗脂肪9.1%)及其他饲料原料购于陕西某饲料厂。
试验配制5种等氮等能饲料(粗蛋白质36.8%,粗脂肪5.5%),即含10%鱼粉的基础饲料(DSP0),脱脂蚕蛹分别替代基础饲料中25%、50%和75%鱼粉的3种饲料(DSP25、DSP50和DSP75)以及在75%替代基础上添加0.7%晶体赖氨酸的饲料(DSP75-Lys)。晶体赖氨酸添加量参考Zhou等[15]对建鲤幼鱼赖氨酸需求量的研究结果。试验所用晶体L-赖氨酸由北京金鑫天佑生物科技有限公司提供,有效含量为99%。试验饲料组成及营养水平见表1,鱼粉、脱脂蚕蛹及试验饲料氨基酸组成见表2。所有原料粉碎后过60目筛,用小型搅拌机搅拌均匀,制成直径2.0 mm,长约2.5 mm的颗粒料,于-20℃的冰柜储存。
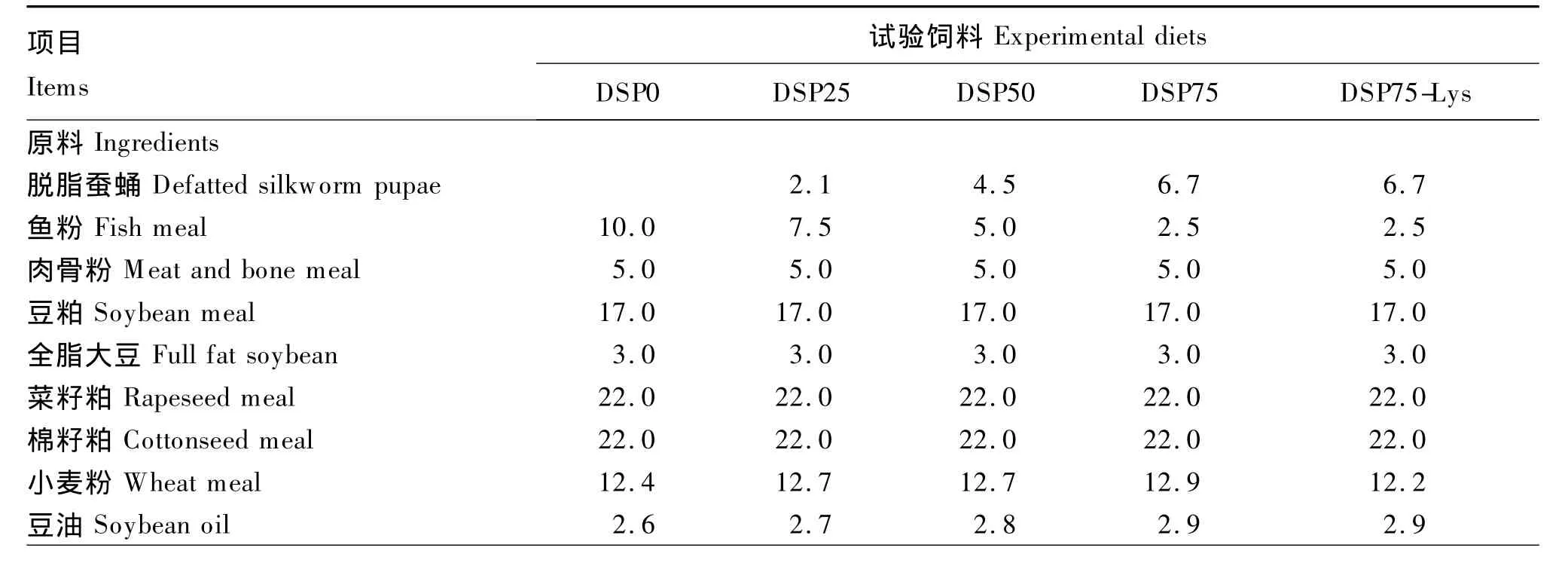
表1 试验饲料组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
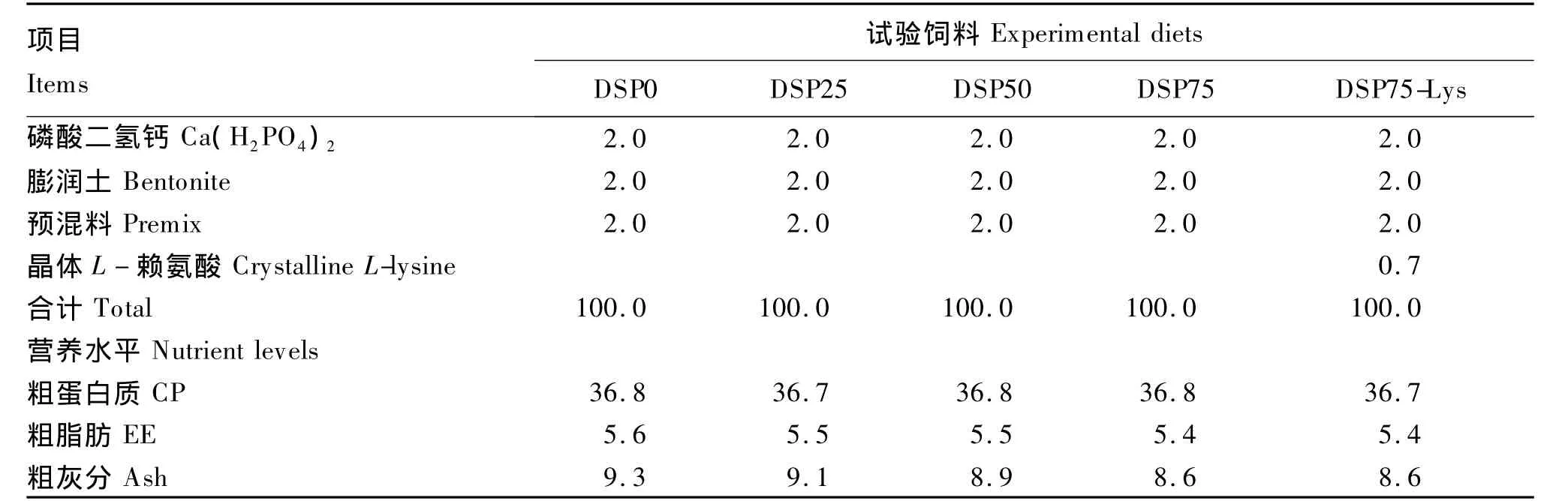
续表1
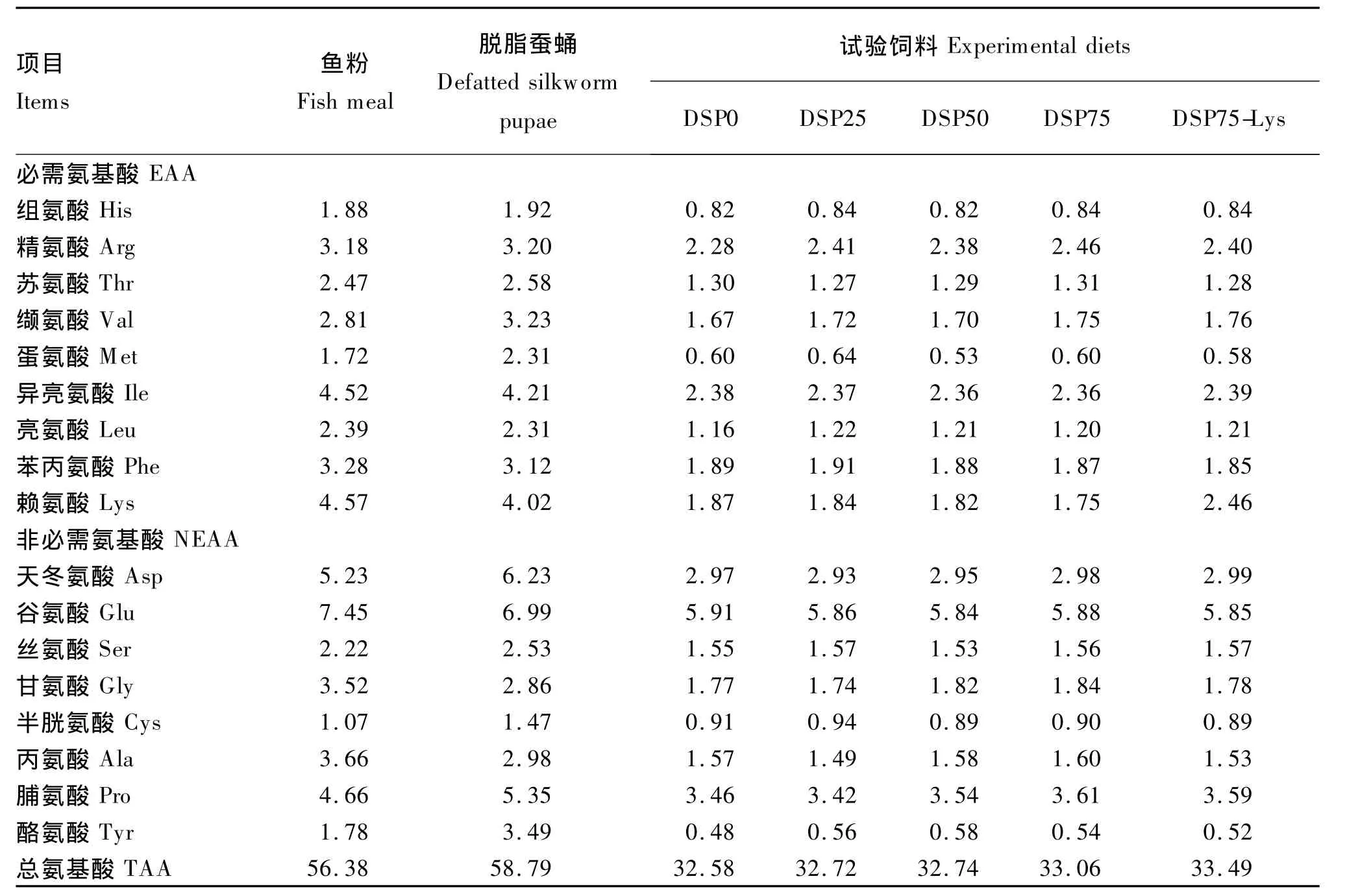
表2 鱼粉、脱脂蚕蛹及试验饲料氨基酸组成(风干基础)Table 2 Amino acid composition of fish meal,defatted silkworm pupae and experimental diets(air-dry basis) %
1.2 试验方法
1.2.1 试验鱼及饲养管理
试验建鲤由西北农林科技大学安康水产试验示范站繁育、提供。选择初始体质量均匀的健康鱼种270尾,随机分为5组,每个组3个重复,每个重复18尾鱼,以重复为单位随机分配到15个养殖缸(容积为130 L)中,饲养于西北农林科技大学安康水产试验示范站室内循环水养殖系统内。正式试验开始前用饲料DSP0驯养14 d后重新随机分配,称重、测体长,初始体质量为(15.30 ±2.97)g。试 验期间 饱食 投 喂,日 投 喂 3次(08:30、12:30、16:30),共饲养 56 d。期间水温为25.3 ~28.5 ℃,溶氧为 5.0 ~8.0 mg/L,pH 为7.2 ~ 8.1,氨氮低于 0.20 mg/L,亚硝酸盐低于0.10 mg/L,硫化物低于0.10 mg/L,水质符合《渔业水质标准》(GB 11607—89)。
1.2.2 样品采集与检测
饲养试验结束时,试验鱼禁食24 h,MS-222(化学名称:间氨基苯甲酸乙酯甲磺酸盐)麻醉后每尾称质量,测体长、全长;每缸随机取6尾鱼尾静脉抽血,血液样品4℃冰箱静置12 h后,4℃下3 000 r/min离心10 min制备血清;每缸另随机取2尾鱼采用组织捣碎机匀浆,作为全鱼样本;其他鱼解剖,测量肠长,称量空壳、肝胰脏、腹腔脂肪及脾脏重;取肝胰脏组织(4尾/缸)迅速置液氮中保存,随后转至超低温冰箱待测肝胰脏抗氧化指标。肌肉、全鱼样品于-20℃保存待用。


粗蛋白质、粗脂肪、粗灰分和干物质含量分别采用凯氏定氮法、索氏抽提法、马福炉高温(550℃)灼烧法和恒温(105℃)干燥法测定;氨基酸含量采用酸水解法测定,取样品0.5 g,用6 mol/L的盐酸于110℃下水解22 h,过滤定容至50 mL,取0.5 mL真空干燥制作成样品,使用氨基酸自动分析仪(BECKMAN,121 MB,USA)测定样品氨基酸组成及比例。血清样品送至陕西杨凌示范区医院,采用岛津ILab 600全自动生化分析仪测定血清生化指标,包括谷丙转氨酶(ALT)、谷草转氨酶(AST)活性以及胆固醇(CHOL)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、葡萄糖(GLU)、总蛋白(TP)含量;肝胰脏总超氧化物歧化酶(T-SOD)活性和丙二醛(MDA)含量采用南京建成生物工程研究所生产的试剂盒进行测定。
1.3 数据统计和分析
试验数据均以平均值±标准差表示,采用SPSS 17.0数据统计包中的单因子方差分析(oneway ANOVA)对试验结果进行统计分析,采用Duncan氏法多重比较分析组间的差异显著性,以P<0.05为显著性标准。
2 结果
2.1 脱脂蚕蛹粉替代鱼粉对建鲤生长性能的影响
脱脂蚕蛹粉替代鱼粉对建鲤生长性能的影响见表3。饲养过程中试验鱼摄食良好,成活率均在98%以上。直接替代组(DSP0、DSP25、DSP50、DSP75组)的终末鱼体质量(FBW)、WGR、SGR、FI和PER随替代水平的升高而逐渐下降,添加晶体赖氨酸后又有所上升。DSP75组的FBW显著低于 DSP0组(P <0.05),WGR、PER和 SGR 均显著低于DSP0和DSP25组(P<0.05)。直接替代组的FCR随替代水平的升高而逐渐升高,其中DSP75组显著高于DSP0和DSP25组(P<0.05)。DSP75-Lys组的 FBW、WGR、SGR、PER 较 DSP75组均有升高(P >0.05),且 FBW、SGR、PER 与DSP0组无显著差异(P>0.05),而WGR则显著低于 DSP0组(P<0.05)。DSP75-Lys组的 FCR较DSP75组有降低趋势(P>0.05),且与DSP0组无显著差异(P>0.05)。各组之间FI差异不显著(P >0.05)。

表3 脱脂蚕蛹替代鱼粉对建鲤生长性能的影响Table 3 Effects of fish meal replacement by defatted silkworm pupae on growth performance of Jian carp(Cyprinus carpio var.Jian)
2.2 脱脂蚕蛹替代鱼粉对建鲤生物学性状的影响
脱脂蚕蛹替代鱼粉对建鲤生物学性状的影响见表4。各组之间HSI和SI均差异不显著(P>0.05),但DSP75-Lys组HSI有降低趋势。直接替代组的CF和IFI均有随替代水平的升高先降低后升高的趋势,其中DSP75组的CF和IFI显著高于DSP25组(P<0.05)。直接替代组的RGL随替代水平的升高逐渐升高,且DSP75组显著高于DSP0组(P<0.05);添加晶体赖氨酸后RGL又有降低趋势,且 DSP75-Lys组与 DSP0组无显著差异(P >0.05)。
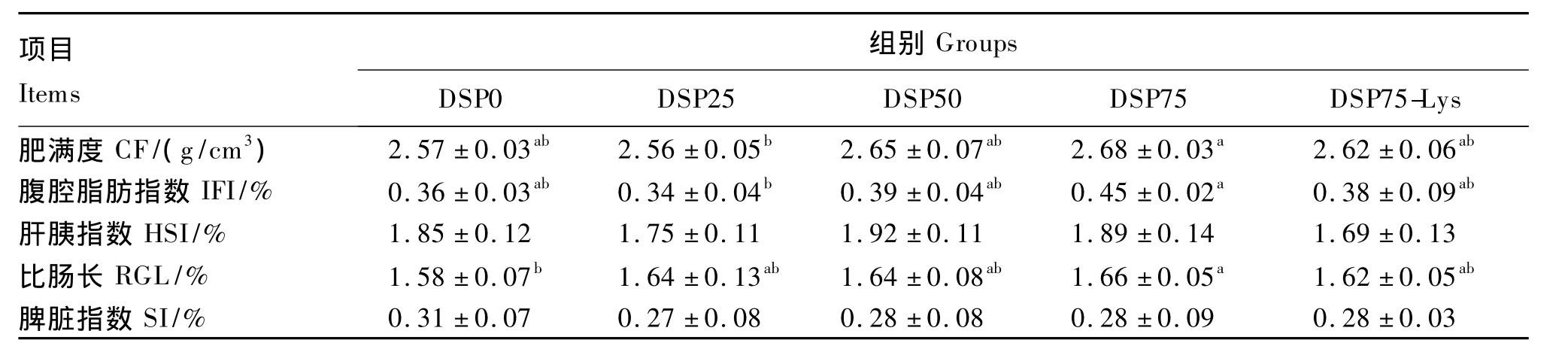
表4 脱脂蚕蛹替代鱼粉对建鲤生物学性状的影响Table 4 Effects of fish meal replacement by defatted silkworm pupae on biological traits of Jian carp(Cyprinus carpio var.Jian)
2.3 脱脂蚕蛹替代鱼粉对建鲤体成分的影响
2.3.1 对鱼体一般营养成分的影响
脱脂蚕蛹替代鱼粉对建鲤鱼体一般营养成分的影响见表5。随替代水平的升高全鱼粗蛋白质含量逐渐升高,但各直接替代组之间无显著差异(P>0.05);DSP75-Lys组显著高于 DSP0和DSP25组(P<0.05)。直接替代组的全鱼粗脂肪含量随替代水平的升高逐渐升高,且DSP75组显著高于 DSP0、DSP25和 DSP50组(P <0.05);添加晶体赖氨酸后全鱼粗脂肪含量有所降低,但无显著差异(P>0.05)。随替代水平的升高全鱼水分含量呈降低趋势,但各直接替代组之间无显著差异(P>0.05);DSP75-Lys组全鱼水分含量最低,且显著低于DSP0组(P<0.05)。直接替代组的全鱼粗灰分含量随替代水平的升高呈降低趋势,DSP75组显著低于 DSP0、DSP25和DSP50组(P<0.05);添加晶体赖氨酸后对全鱼粗灰分含量无显著影响(P>0.05)。
2.3.2 对肌肉氨基酸组成的影响
脱脂蚕蛹替代鱼粉对建鲤肌肉氨基酸组成的影响见表6。脱脂蚕蛹替代饲料中鱼粉后肌肉各氨基酸水平和总氨基酸水平均无显著变化(P>0.05),脱脂蚕蛹替代饲料中鱼粉后再补充晶体赖氨酸对肌肉赖氨酸水平无显著影响(P>0.05)。
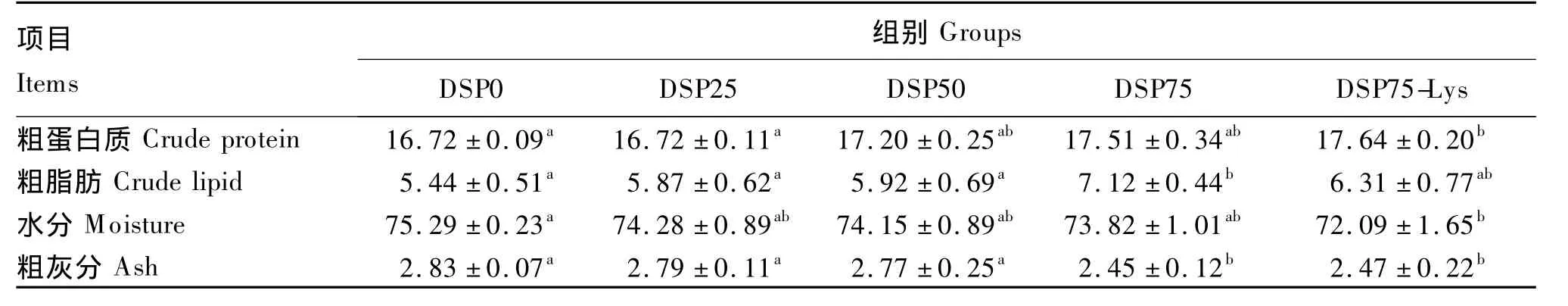
表5 脱脂蚕蛹替代鱼粉对建鲤鱼体一般营养成分的影响Table 5 Effects of fish meal replacement by defatted silkworm pupae on general nutrients in body of Jian carp(Cyprinus carpio var.Jian)
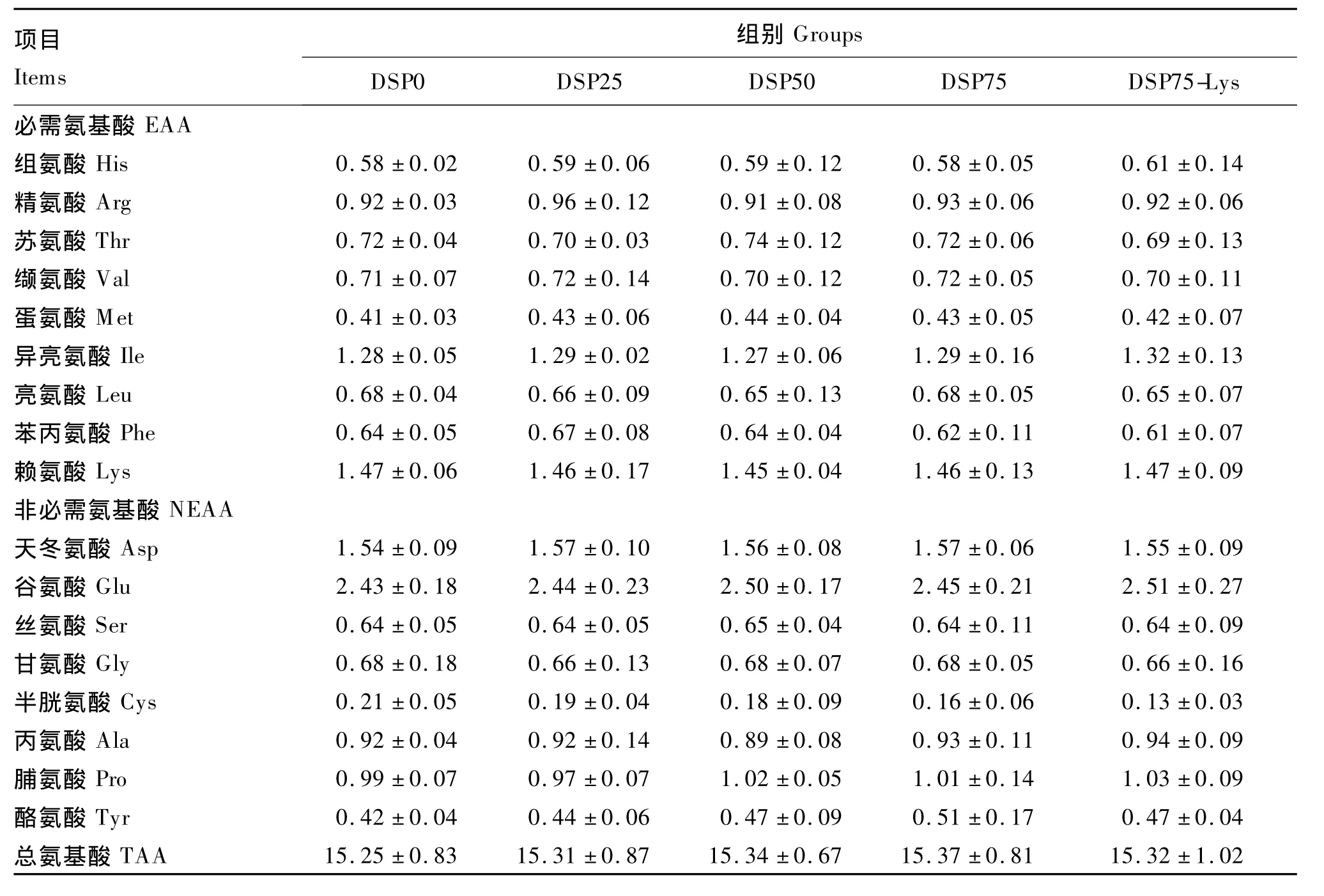
表6 脱脂蚕蛹替代鱼粉对建鲤肌肉氨基酸组成的影响(湿重基础)Table 6 Effects of fish meal replacement by defatted silkworm pupae on amino acid composition in muscle of Jian carp(Cyprinus carpio var.Jian)(wet weight basis) %
2.4 脱脂蚕蛹替代鱼粉对建鲤血清生化指标的影响
脱脂蚕蛹替代鱼粉对建鲤血清生化指标的影响见表7。直接替代组的血清ALT活性随替代水平的升高而逐渐上升,且DSP75组显著高于DSP0、DSP25和 DSP50组(P <0.05);添加晶体赖氨酸后血清ALT活性无显著变化(P>0.05)。直接替代组的血清AST活性随替代水平的升高有所降低,添加晶体赖氨酸后又有所升高,但各组之间差异不显著(P>0.05)。随替代水平的升高血清CHOL含量呈降低趋势,但各直接替代组之间无显著差异(P>0.05);DSP75-Lys组血清CHOL含量最低,且显著低于DSP0组(P<0.05)。随替代水平的升高血清LDL-C含量逐渐降低,但各直接替代组之间无显著差异(P>0.05);DSP75-Lys组血清 LDL-C含量最低,且显著低于 DSP0组(P<0.05)。直接替代组的血清GLU含量随替代水平的升高而逐渐降低,其中DSP50和DSP75组显著低于DSP0组(P<0.05);添加晶体赖氨酸后血清GLU含量又有所升高,且DSP75-Lys组与DSP0无显著差异(P>0.05)。各组之间血清HDL-C和TP含量差异不显著(P>0.05)。
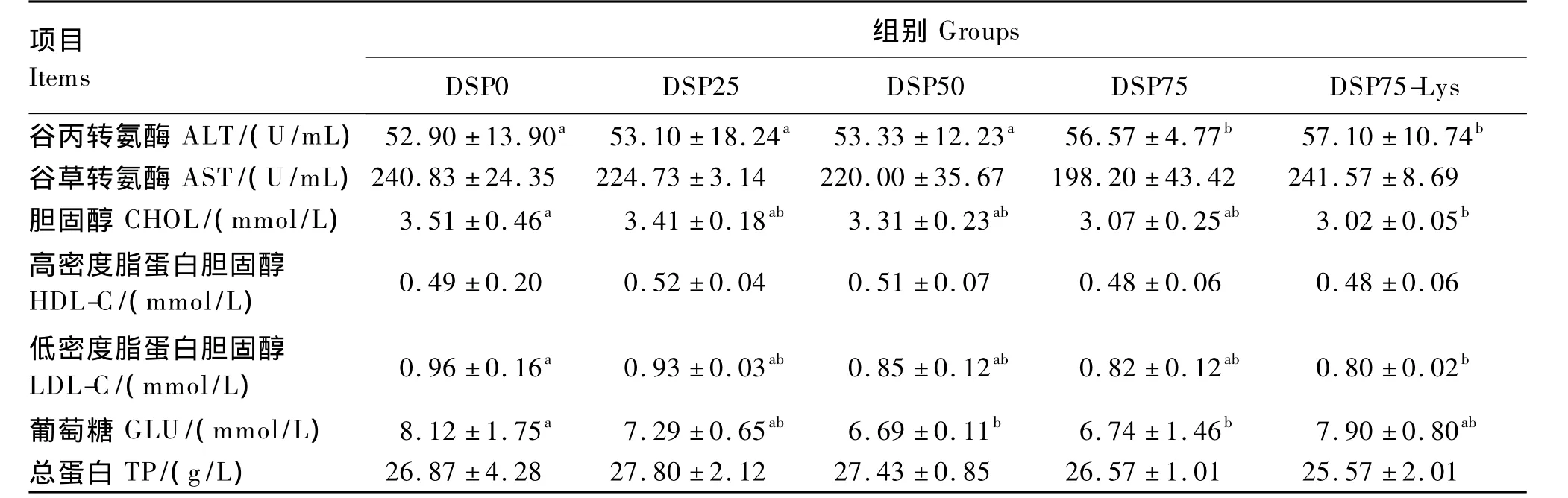
表7 脱脂蚕蛹替代鱼粉对建鲤血清生化指标的影响Table 7 Effects of fish meal replacement by defatted silkworm pupae on serum biochemical indices of Jian carp(Cyprinus carpio var.Jian)
2.5 脱脂蚕蛹替代鱼粉对建鲤肝胰脏抗氧化指标的影响
脱脂蚕蛹替代鱼粉对建鲤肝胰脏抗氧化指标的影响见表8。随着替代水平的升高,直接替代组肝胰脏T-SOD活性逐渐降低,且DSP75和DSP75-Lys组显著低于 DSP0和 DSP25组(P<0.05)。血清MDA含量随替代水平的升高逐渐升高,但各组之间无显著差异(P>0.05)。添加晶体赖氨酸后对肝胰脏T-SOD活性和MDA含量均无显著影响(P >0.05)。
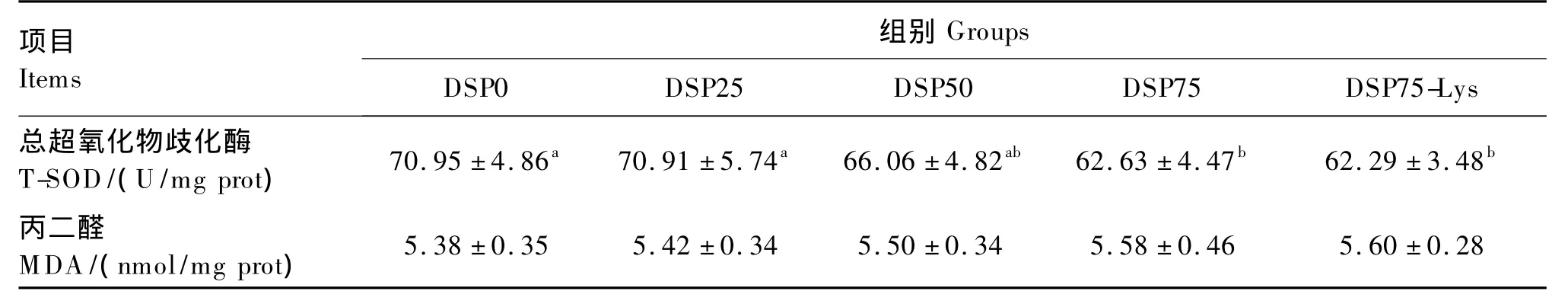
表8 脱脂蚕蛹替代鱼粉对建鲤肝胰脏抗氧化指标的影响Table 8 Effects of fish meal replacement with DSP on hepatopancreas antioxidant indices of Jian carp(Cyprinus carpio var.Jian)
3 讨论
3.1 脱脂蚕蛹替代鱼粉对建鲤生长性能的影响
本研究室对蚕蛹作为鱼粉替代蛋白质源做了较深入的研究,刘丹丹等[12]从消化率的角度研究表明,蚕蛹可以完全或者部分替代黄鳝饲料中的鱼粉;吉红等[6]发现,镜鲤饲料中蚕蛹添加量至5.5%,替代镜鲤饲料中50%的鱼粉蛋白质,并没有对其生长和生物性状及饲料效率产生不利影响,且替代后有降低FCR,提高PER的趋势。国外蚕蛹作为鱼粉替代蛋白质源的研究主要集中在对生长和饲料效率方面的探讨。Boscolo等[7]研究指出,蚕蛹组的尼罗罗非鱼仔鱼的增重和饲料转化率较鱼粉组差,但摄食量却没有显著差异,这与本研究结果一致。Rangacharyulu等[8]分别用发酵蚕蛹和天然蚕蛹完全替代鱼粉(4.5%)池塘混养麦瑞加拉鲮、喀拉鲃、南亚野鲮和鲢鱼,结果表明发酵蚕蛹组的WGR、FCR、SGR显著好于鱼粉组和天然蚕蛹组,天然蚕蛹组和鱼粉组之间差异不显著;Begum等[9]研究发现,用蚕蛹粉和蚌肉粉的混合物替代南亚野鲮仔鱼饲料中50%鱼粉蛋白质时饲料效率最好。Nandeesha等[16]研究表明,蚕蛹可以完全替代鲤鱼饲料中的鱼粉(全鱼粉组饲料含30%鱼粉),完全替代鱼粉(即蚕蛹占饲料30%)后鲤鱼生长状况优于含10%蚕蛹和20%鱼粉的饲料以及含20%蚕蛹和10%鱼粉的饲料,但组间无显著差异,且发现含蚕蛹饲料组的PER更高。而本研究发现,随着脱脂蚕蛹替代鱼粉水平的升高,建鲤的FCR逐渐升高,PER逐渐降低,推测一定水平的脱脂蚕蛹有降低建鲤 FCR,提高PER的正面效果。本研究还发现,随着脱脂蚕蛹替代鱼粉水平的升高,建鲤的RGL逐渐升高,添加晶体赖氨酸后又有所降低。这一现象可能是由于脱脂蚕蛹营养水平不及鱼粉,添加晶体赖氨酸后饲料营养水平有所升高,进而造成了鱼体肠道出现补偿性发育。这与本研究室前期研究结果一致[17]。
一般认为,在虹鳟等鲑鳟鱼类饲料中补充晶体氨基酸较为有效,而对于我国主要养殖的鲤科鱼类,研究结果则呈现很大差异[18]。国外对于鱼类饲料中添加晶体氨基酸的作用效果,除鲑鳟鱼及海水鱼类外,仍未形成统一认识。国内有关水产饲料中晶体氨基酸使用的研究报道主要集中在鲤鱼、草鱼以及鲫鱼等无胃鲤科鱼类,研究结果也不统一[19-22]。赖氨酸作为鱼类饲料中的第一限制性氨基酸,对维持动物的正常生长、发育和神经系统的正常机能具有重要的作用[23]。本研究首次评估了在脱脂蚕蛹替代鱼粉饲料中补充晶体氨基酸的效果,发现添加晶体赖氨酸后建鲤的饲料效率、WGR、PER均比未添加时有所升高,但无显著差异,本研究条件下脱脂蚕蛹替代饲料中鱼粉后添加晶体赖氨酸未显示显著的正面效果,相关研究还有待进一步进行。
3.2 脱脂蚕蛹替代鱼粉对建鲤体成分的影响
饲料与鱼体营养成分密切相关[24]。本研究表明,各直接替代组之间鱼体粗蛋白质和水分含量无显著差异。Rangacharyulu等[8]报道,麦瑞加拉鲮、喀拉鲃、南亚野鲮饲料中分别用天然蚕蛹和发酵蚕蛹完全替代鱼粉,试验组全鱼的粗蛋白质、水分含量与鱼粉组均没有显著差异,与本研究结果相同。本研究还表明,随脱脂蚕蛹替代鱼粉水平的升高,建鲤全鱼粗脂肪含量逐渐升高,粗灰分含量逐渐降低。而 Nandeesha等[16]对鲤的研究表明,蚕蛹饲料组全鱼的粗脂肪含量低于鱼粉组,并且随着蚕蛹添加量的增加这一差距逐渐加大,与本研究结果相反,可以认为,饲料中添加的蚕蛹脱脂对鱼体粗脂肪含量的影响最为显著,且粗脂肪主要蓄积于腹腔部位。本研究室前期研究表明,蚕蛹替代饲料中50%的鱼粉会显著降低镜鲤肌肉酪氨酸和全鱼赖氨酸含量[6]。本研究则发现,各组建鲤的肌肉氨基酸组成无显著差异,推测本试验中出现的脱脂蚕蛹的营养功能不及鱼粉的现象可能是由于脱脂蚕蛹中含有较高水平的难以消化的甲壳素[5]以及替代后摄食量下降所致。
赖氨酸对体蛋白质含量的影响主要是通过影响蛋白质沉积量来实现的,即使蛋白质的合成率和分解率发生变化。赖氨酸除了作为底物参与蛋白质的生物合成之外,还可能通过调控生长激素、胰岛素和类胰岛素样生长因子-Ⅰ等内分泌激素,作为信号分子直接调控翻译起始因子的活性以及调控与氮代谢相关基因的表达等途径影响蛋白质代谢[25];赖氨酸是肉碱的前体,大量研究表明,赖氨酸经肠道吸收后有极少部分在甲基转移酶的作用下转化为N-三甲基赖氨酸,N-三甲基赖氨酸在一系列酶的作用下最终生成肉碱。肉碱参与胞内脂肪酸的转运过程,将长链脂肪酸转运至线粒体内后进行β-氧化,为蛋白质的合成提供能量和碳架[24]。本研究中晶体赖氨酸组(DSP75-Lys组)建鲤全鱼粗蛋白质含量显著高于鱼粉对照组(DSP0组),而粗脂肪含量略有降低则可能与以上过程有关。Rodehutscord等[26]也发现,当虹鳟饲料中添加0.8%赖氨酸时,鱼体粗脂肪含量降低21%。冷向军等[20]研究发现,低鱼粉饲料(含6%鱼粉)中添加晶体氨基酸(0.21%赖氨酸、0.08%蛋氨酸)可提高异育银鲫肌肉粗蛋白质含量,降低水分含量,但效果不显著,这与本研究结果一致。
3.3 脱脂蚕蛹替代鱼粉对建鲤健康状况的影响
鱼类血液与机体的代谢、营养状况及疾病有着密切关系[23]。在正常情况下ALT和AST主要存在于肝细胞的可溶性部分,在血清中含量很低,当肝细胞受损细胞膜通透性增加或细胞坏死时才会大量进入血液,使血清中的ALT和AST活性升高,其升高的程度与肝细胞受损的程度相一致[27]。目前尚无建鲤正常血清生化指标的标准数据,研究结论大多是根据试验结果的差异性进行比较而得出。本试验中,随着脱脂蚕蛹替代鱼粉水平的升高,血清ALT活性逐渐升高,且DSP75组显著高于DSP0、DSP25和DSP50组,表明脱脂蚕蛹替代建鲤饲料中75%的鱼粉后可能会造成一定程度的肝胰脏细胞损伤,且补充晶体赖氨酸后也未能改变这一状况。
LDL-C指低密度脂蛋白(LDL)所携带的CHOL量,可以反映 CHOL代谢状态,血清总CHOL则是指血液中所有脂蛋白所含CHOL之总和。植物蛋白质降低血清CHOL含量的作用在陆生哺乳动物和鱼类中均有报道[28-29],Abdul-Kader等[30]用发酵豆粕和扇贝粉混合物(3∶2)替代饲料中30%以上鱼粉会引起真鲷血清CHOL和HDL-C含量显著降低,全鱼粗脂肪含量也显著降低,作者指出这可能是由于高替代组试验鱼脂质代谢异常所致。本研究中,随着脱脂蚕蛹替代鱼粉水平的升高,全鱼粗脂肪含量逐渐升高,血清LDL-C和CHOL含量逐渐降低,对血清HDL-C含量则无显著影响。从对鱼体粗脂肪含量的影响来看,菜籽粕和脱脂蚕蛹对鱼类脂质代谢的作用存在差异,具体机理目前还不清楚。Shafaeipour等[31]指出,菜籽粕对血清CHOL含量的影响在虹鳟和陆生哺乳动物上的研究结果矛盾,可能预示鱼类CHOL代谢和陆生哺乳动物有所差异,或者CHOL代谢途径具有多样性,这需要进一步研究。
机体的抗氧化防御系统作为需氧生物体内清除活性氧自由基(O-2·)、防止过氧化损伤的主要保护机制,负责清除组织细胞代谢产生的活性氧自由基,使之始终维持在较低的水平而不致在体内聚积,以保持机体正常的生理功能。T-SOD活性的高低可以间接地反映鱼体内活性氧的水平和细胞受氧化损伤的程度;MDA是脂质过氧化作用的最终分解产物,其含量的升高对机体健康不利[30]。本试验中,随着脱脂蚕蛹替代鱼粉水平的升高,肝胰脏T-SOD活性呈下降趋势,且DSP75组显著低于DSP0和DSP25组;肝胰脏MDA含量呈上升趋势。上述结果说明脱脂蚕蛹替代饲料中鱼粉后建鲤机体抗氧化能力减弱,且随替代水平的升高,这种趋势愈加明显。
4 结论
本试验条件下,综合考虑生长性能、体成分及健康状况指标,脱脂蚕蛹可以替代建鲤饲料中50%以下的鱼粉,同时补充晶体赖氨酸可提高鱼体的蛋白质沉积水平。
[1] 周歧存,麦康森,刘永坚,等.动植物蛋白源替代鱼粉研究进展[J].水产学报,2009,29(3):404 -410.
[2] OLSEN R L,HASAN M R.A limited supply of fishmeal:impact on future increases in global aquaculture production[J].Trends in Food Science and Technology,2012,27:120 -128.
[3] WATANABE T.Strategies for further development of aquatic feeds[J].Fish Science,2002,68:242 - 252.
[4] 杨吉园,叶明强,邝哲师,等.饲料用蚕蛹的加工技术及其在畜牧水产业中的应用[J].中国蚕业,2009(4):11-17.
[5] 吉红,程小飞,李杰,等.蚕蛹替代鱼粉对框鳞镜鲤幼鱼生长性能、体成分及健康状况的影响[J].水产学报,2012,36(10):1599 -1611.
[6] 谢华.安康蚕桑综合利用的现状与发展建议[J].北方蚕业,2007,28(2):47 -48.
[7] BOSCOLO W R,HAYASHI C,MEURER F,et al.Fish,meat and bone,poultry by-products and silkworm meals as attractive in diets for Nile tilapia(Oreochromis niloticus)fingerlings[J].Brazilian Journal of Animal Science,2001,30(5):1397 -1402.
[8] RANGACHARYULU P V,GIRI S S,PAUL B N,et al.Utilization of fermented silkworm pupae silage in feed for carps[J].Bioresource Technology,2003,86(1):29-32.
[9] BEGUM N N,CHAKRABORTY S C,ZAHER M,et al.Replacement of fishmeal by low-cost animal protein as a quality fish feed ingredient for Indian major carp,Labeo rohita,fingerlings[J].Journal of the Science of Food and Agriculture,1994,64:191 -197.
[10] VIJAYAKUMARASWAMY H V,DEVARAJ K V.Growth response of fry of Catla catla and the three formulated feeds[J].Environment and Ecology,1994,12(3):519 -523.
[11] NANDEESHA M C,GANGADHARA B,VARGHESE T J,et al.Growth response and flesh quality of common carp,Cyprinus carpio fed with high levels of nondefatted silkworm pupae[J].Asian Fisheries Science,2000,13:235 -242.
[12] 刘丹丹,吉红,范宇友,等.黄鳝和泥鳅对蚕蛹离体消化率的研究[J].湖北农业科学,2009,48(1):153-155.
[13] 许晋,李竞,黄先智.影响蚕蛹油酸败的因素研究[J].丝绸研究与技术,2011,48(5):7 -9.
[14] 张恭勤,徐伟,谢维刚,等.蚕蛹蛋白的生产与应用的研究[J].同济大学学报,1992(2):98-101.
[15] ZHOU X Q,ZHAO C R,JIANG J,et al.Dietary lysine requirement of juvenile Jian carp(Cyprinus carpio var.Jian)[J].Aquaculture Research,2008,14:381-386.
[16] NANDEESHA M C,SRIKANTH G K,KESHAVAPPA P V,et al.Effect of non-defatted silkworm pupae in diets on the growth of common carp,Cyprinus carpio[J].Biological Wastes,1990,33:17 - 23.
[17] 吉红,朱天和,周继术.日粮中鱼粉添加量对鲤鱼种生长、生物学性状及血清生化指标的影响[J].西北农林科技大学学报,2008,36(7):33 -39.
[18] HAULER R C,CARTER C G.Reevaluation of the quantitative dietary lysine requirements of fish[J].Reviews in Fisheries Science,2001,9:133 -163.
[19] 刘永坚,田丽霞,刘栋辉,等.实用饲料补充结晶或包膜氨基酸对草鱼生长、血清游离氨基酸和肌肉蛋白质合成率的影响[J].水产学报,2002,26(3):252-258.
[20] 冷向军,王冠,李小勤,等.饲料中添加晶体或包膜氨基酸对异育银鲫生长和血清游离氨基酸水平的影响[J].水产学报,2007,31(12):743 -748.
[21] 蒋艾青,王晓华.青鱼饲料中添加组氨酸的试验[J].中国水产,2002,(2):67 -73.
[22] 刘长忠,周克勇.添加晶体氨基酸降低蛋白质水平对鲫鱼生产性能的影响[J].饲料工业,2001,22(6):9-11.
[23] 周玉,郭文场,杨振国,等.鱼类血液学指标研究的进展[J].上海水产大学学报,2001,10(2):163-165.
[24] 李爱杰.水产动物营养与饲料学[M].北京:中国农业出版社,1996:8-107.
[25] 罗钧秋,陈代文.赖氨酸对蛋白质代谢的影响及其可能调控机制[J].饲料工业,2006(16):40-43.
[26] RODEHUTSCORDA M,BORCHERTA F,GREGUS Z,et al.Availability and utilization of free lysine in rainbow trout(Oncorhynchus mykiss):1.Effect of dietary crude protein level[J].Aquaculture,2000,187:163-176.
[27] NYBLOM H,BERGGREN U,BALLDIN J,et al.High AST/ALT ratio may indicate advanced alcoholic liver disease rather than heavy drinking[J].Alcohol,2004,39(4):336 -339.
[28] KAUSHIK S J,CRAVEDI J P,LALLES J P,et al.Partial or total replacement of fishmeal by soybean protein on growth,protein utilization,potential estrogenic or antigenic effects,cholesterolemia and flesh quality in rainbow trout[J].Aquaculture,1995,133:257-274.
[29] DE FRANCESCO M,PARISIA G,MEDALEB F,et al.Effect of long-term feeding with a plant protein mixture based diet on growth and body/fillet quality traits of large rainbow trout(Oncorhynchus mykiss)[J].Aquaculture,2004,236:413 -429.
[30] ABDUL-KADER M,KOSHIO S,ISHIKAWA M,et al.Growth,nutrient utilization,oxidative condition,and element composition of juvenile red sea bream Pagrus major fed with fermented soybean meal and scallop by-product blend as fishmeal replacement[J].Aquaculture,2011,77:119 -128.
[31] SHAFAEIPOUR A,YAVARI V,FALAHATKAR,et al.Effects of canola meal on physiological and biochemical parameters in rainbow trout(Oncorhynchus mykiss)[J].Aquaculture Nutrition,2008,14:110 -119.
