稀释率对新型固液气分流式瘤胃模拟系统发酵效果的影响
2013-12-20包万华王加启卜登攀姜雅慧金恩望雒秋江
包万华 王加启 卜登攀 姜雅慧 金恩望 雒秋江
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193;2.新疆农业大学动物科学学院,乌鲁木齐 830052)
动物活体试验是研究瘤胃发酵理想的方法,但存在试验周期长、成本高且易受试验动物个体差异及应激等诸多不利因素影响,研究者们便设计了体外连续培养系统进行瘤胃模拟发酵试验。目前国外具有代表性的连续模拟培养系统主要有Hoover等[1]在 1976年设计的持续人工瘤胃、Teather等[2]在1988年设计的连续培养系统和Martínez等[3]在 2009 年改进的自动控制连续培养系统;我国较有代表性的有王加启等[4]在1993年设计的瘤胃持续模拟装置(RSI)和孟庆翔[5]在1999年设计的双外流连续培养系统(CCS)。沈维军等[6]结合瘤胃发酵的特征和目前所应用的双外流瘤胃模拟装置的优缺点,设计出一种新型固液气分流式瘤胃模拟系统。瘤胃液稀释率是体外瘤胃模拟系统的主要运行参数之一,也是影响瘤胃发酵和瘤胃微生物生长的重要因素之一。但目前对于稀释率对瘤胃发酵影响的研究报道不尽一致,部分研究者[7-9]认为在体外瘤胃模拟培养发酵中增加液相稀释率并减少固相的滞留时间,可以提高挥发性脂肪酸(VFA)产量并有利于微生物的生长,而另外一些研究者[10-11]却认为稀释率对VFA、瘤胃微生物的生长没有影响,因此有必要研究稀释率到底对瘤胃发酵有多大的影响、稀释率在哪一范围内更有利于瘤胃的发酵及更适合本模拟系统。本试验通过考察不同稀释率下新型固液气分流式瘤胃模拟系统中原虫数量的动态变化、人工瘤胃的发酵参数和饲料常规养分消失率的变化,探究稀释率对新型固液气分流式瘤胃模拟系统发酵效果的影响,从而确定出本装置稳定运行条件下的最佳稀释率,同时进一步验证此装置的稳定性。
1 材料与方法
1.1 新型固液气分流式瘤胃模拟系统及缓冲液(人工唾液)
新型固液气分流式瘤胃模拟系统(中国农业科学院北京畜牧兽医研究所研制),包括发酵装置、搅拌装置、缓冲液注入装置、排气装置、排液装置、排固装置和恒温装置。发酵装置作为核心部分,由12个有效体积为(1 000±10)mL的发酵罐组成。人工瘤胃操作方法参照沈维军等[6]的方法。人工唾液采用 McDougall[12]设计的配方,待试剂全部溶解后,加入CaCl2避免产生白色沉淀,向缓冲液中持续通入CO2使溶液pH为6.9±0.1。
1.2 试验动物饲养及管理
试验动物为3头安装永久性瘘管的健康荷斯坦奶牛。每天于08:00和20:00饲喂全混合日粮,全天自由饮水。人工瘤胃试验用饲粮与试验动物的饲粮组成一致,饲粮组成(干物质基础)为:苜蓿干草 8.33%,羊草 16.67%,玉米青贮25.00%,玉 米 26.67%,麦 麸 6.89%,豆 粕13.75%,石粉 1.11%,磷酸氢钙 0.61%,食盐0.44% ,预混料 0.50%。
1.3 试验设计
本试验采用单因素完全随机试验设计,共设4个处理,各处理稀释率分别为 6%/h、8%/h、10%/h和12%/h,每个处理3个重复,每个处理1个发酵罐。试验期为10 d。
1.4 瘤胃液的采集和接种
采集晨饲2 h后的3头供体奶牛的瘤胃液,混合均匀后用4层纱布过滤后放入保温瓶迅速带回实验室。向每个发酵罐按缓冲液与瘤胃液为1∶1的比例接种瘤胃液。整个操作过程需要持续通入氮气以保持发酵罐的厌氧环境。接种后每天向发酵罐中投放40 g(干物质)饲粮。
1.5 样品采集与分析
1.5.1 采样与补料
每天分别在08:00和20:00补料前从发酵罐中部采集5 mL发酵液,将发酵液与甲基绿染色液(MFS)[13]以 1∶2 混合染色,用于原虫数量的测定,从集液瓶中采集1 mL发酵液用于氨态氮(NH3-N)浓度、VFA含量和酶活性的测定,再采集10 mL发酵液用于微生物蛋白质(MCP)产量等指标的测定。同时从发酵罐底部收集消化后过筛网的食糜于尼龙袋中用于饲料常规养分的测定。待取样完毕后通过发酵罐盖上的投料口向每个发酵罐投入20 g(干物质)的饲粮,整个操作过程持续通入氮气保持厌氧。
1.5.2 测定方法
固体食糜样品中的干物质、粗蛋白质(CP)和中性洗涤纤维(NDF)等营养成分的测定参照《饲料分析与检测》[14]中的方法。发酵液pH由安装在罐内的pH电极自动检测,并自动录入计算机。所采集的溢流液样品按3∶1加入25%的偏磷酸,摇匀后在12 000×g下离心20 min,取上清液采用靛酚比色法[15]进行NH3-N浓度的测定。采集的样品按10∶1比例加入25%的偏磷酸处理后用气相色谱法测定VFA含量。将从发酵罐中部取得的5 mL溢流液加入10 mL甲基绿染色液,摇匀静置过夜,采用Sedgewick-Rafter原虫计数板在显微镜下观测原虫数量[16]。样品中MCP产量采用凯氏定氮法进行测定[17]。将溢流液样品1 000×g离心5 min后取上清液,参考Yue等[18]的方法用酶标仪测定纤维素类酶活性。各营养物质消失率按以下公式计算:

1.5.3 统计分析
数据用Excel进行初步的处理和统计,采用SAS 9.1.3 Mix模型进行方差分析,数据用平均值表示,P<0.05为显著性水平,P<0.01为极显著水平。
2 结果
2.1 稀释率对发酵参数的影响
由表1可以看出,当稀释率由6%/h提高到10%/h时,发酵液 pH极显著上升(P<0.01),NH3-N浓度极显著下降(P<0.01),且当上升到12%/h时,NH3-N浓度显著高于稀释率为10%/h时。稀释率由6%/h提高到10%/h时,总挥发性脂肪酸(TVFA)和戊酸浓度分别极显著下降了48.59%和 16.78%(P <0.01),但当稀释率达到12%/h时,并没有继续下降的趋势(P>0.05)。高稀释率[10%/h(P<0.05)、12%/h(P>0.05)]下的丙酸浓度高于低稀释率(6%/h、8%/h),稀释率为6%/h时,戊酸浓度显著或极显著高于其他各处理(P<0.05或 P<0.01)。乙酸/丙酸在10%/h稀释率条件下显著低于稀释率为6%/h和8%/h(P <0.05)。
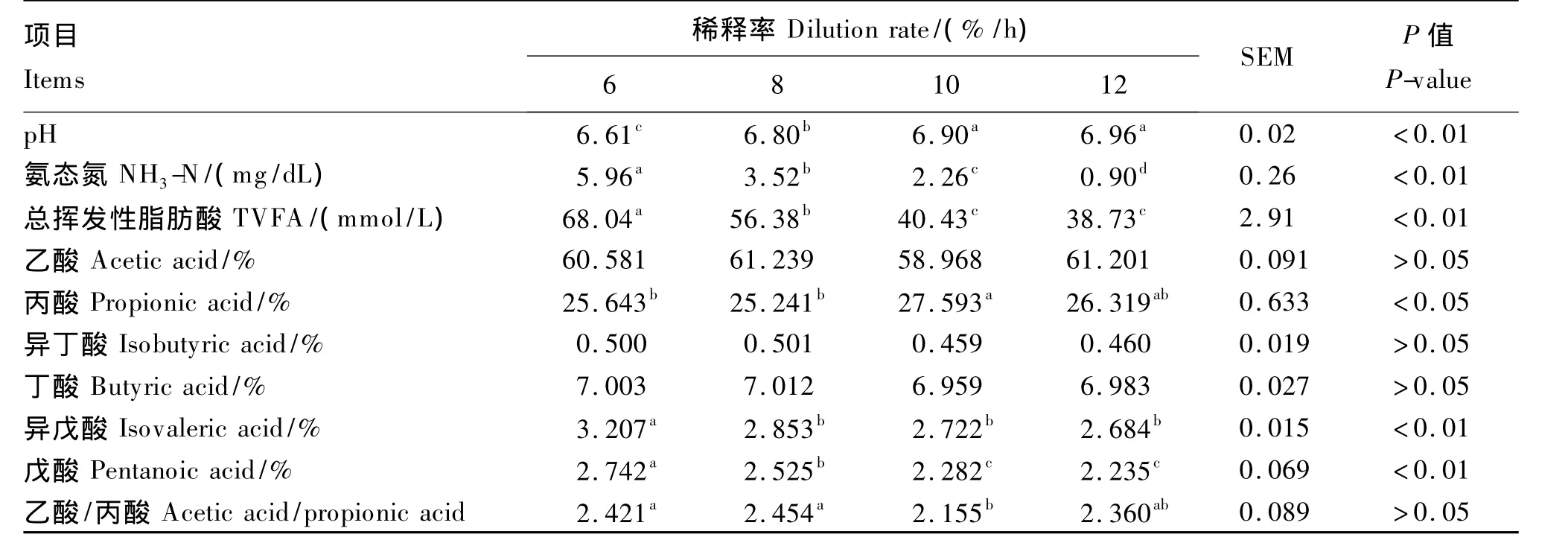
表1 稀释率对发酵参数的影响Table 1 Effects of dilution rate on fermentation parameters
2.2 稀释率对原虫数量、纤维素类酶活性及MCP产量的影响
从图1可以看出,各个发酵液中的原虫数量在试验2 d后有急剧下降的趋势,随着试验时间的延续,原虫数量的变化趋势渐平缓。5~10 d时,稀释率为6%/h、8%/h、10%/h和12%/h的发酵液的原虫数量分别基本维持在0.84×104mL-1、1.21 × 104mL-1、1.08 × 104mL-1和 0.96 ×10 mL-1。
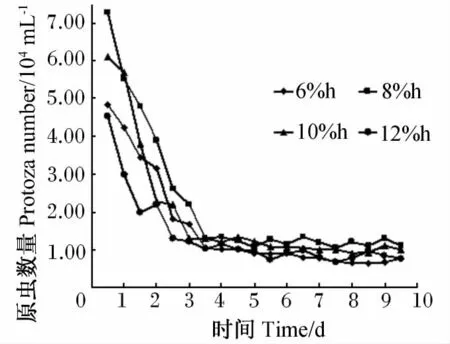
图1 发酵10 d内稀释率对原虫数量的影响Fig.1 Effects of dilution rate on protozoza number during 10 days of fermentation
从表2可以看出,随着稀释率从6%/h增高到10%/h,木聚糖酶的活性极显著降低(P<0.01),微晶纤维素酶和羧甲基纤维素酶的活性也呈现下降趋势,但未达到显著水平(P>0.05)。随着稀释率由8%/h提高到10%/h,MCP产量显著降低了22.81%(P <0.05)。
2.3 稀释率对饲粮营养物质体外消失率的影响
从表3可以看出,随着稀释率由6%/h增加到10%/h,CP体外消失率升高了 15.56%(P<0.01),当稀释率为12%/h时,CP体外消失率虽比10%/h时下降了0.88%,但未达到显著水平(P>0.05)。稀释率为10%/h和12%/h的2个处理,NDF体外消失率显著高于另外2个处理(P<0.05)。稀释率对干物质体外消失率和ADF体外消失率无显著影响(P>0.05)。
3 讨论
3.1 稀释率对发酵参数的影响
Crawford 等[19]和Meng 等[20]的研究都曾证明增加发酵液的稀释率可以导致pH升高,可能由于高稀释率(10%/h、12%/h)条件下,缓冲液注入的量比较大,从而冲淡了发酵罐内容物而致pH上升。本次试验得出NH3-N浓度随着稀释率水平的提高极显著下降的结果与王加启等[4]和Firkins等[21]的研究结果相一致;而 Hoover等[10]研究的试验则表明增加稀释率可以使发酵液NH3-N浓度升高,产生不一致结果的原因可能是虽然试验采用的液相稀释率相似,但固体食糜在发酵罐中滞留时间不同,从而影响了发酵液pH,pH对溢流液NH3-N 浓度也能产生影响[11,22]。Ribeiro 等[23]曾得出pH在一定程度上是瘤胃发酵产物TVFA在反刍动物瘤胃中的浓度的体现,TVFA越低,pH就越高,反之则越低,本试验的结果与此也相一致。Crawford 等[19]曾研究了 7%/h、11%/h 和 15%/h 3水平的稀释率对瘤胃发酵参数的影响,结果显示稀释率从7%/h提高到11%/h时TVFA浓度呈上升趋势,而当稀释率达到15%/h时,又呈现出下降趋势,但并无显著差异;Patterson等[24]也曾证明出稀释率达到10%/h时,TVFA浓度、乙酸和丙酸的浓度呈现下降的趋势。TVFA浓度受稀释率影响显著降低的原因可能由于装置在较高稀释率条件下,发酵液的单糖还没有来得及被微生物降解成VFA,便已经随其余发酵终产物同溢流液流出罐外。
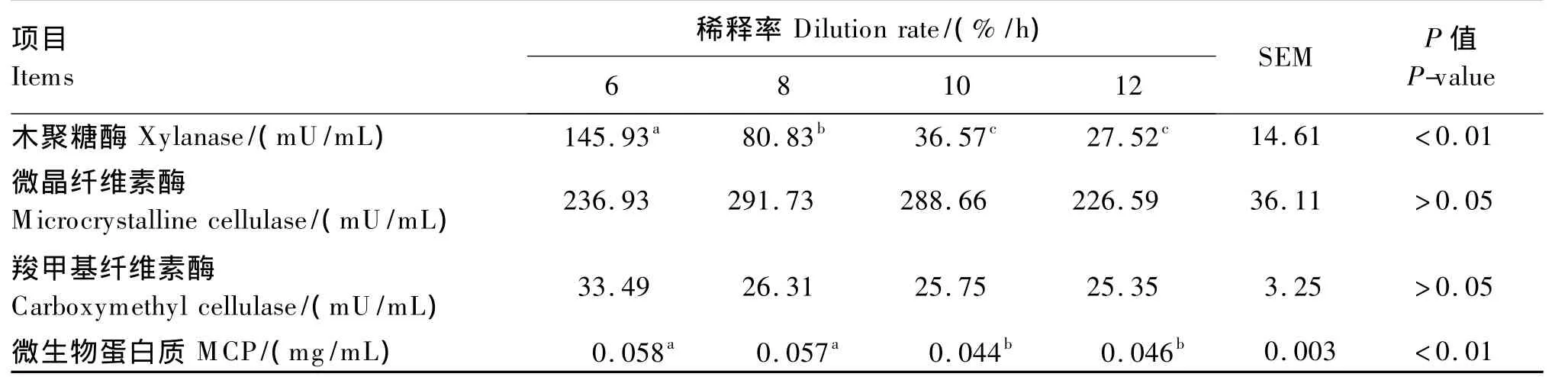
表2 稀释率对纤维素类酶活性及MCP产量的影响Table 2 Effects of dilution rate on cellulase activities and MCP production
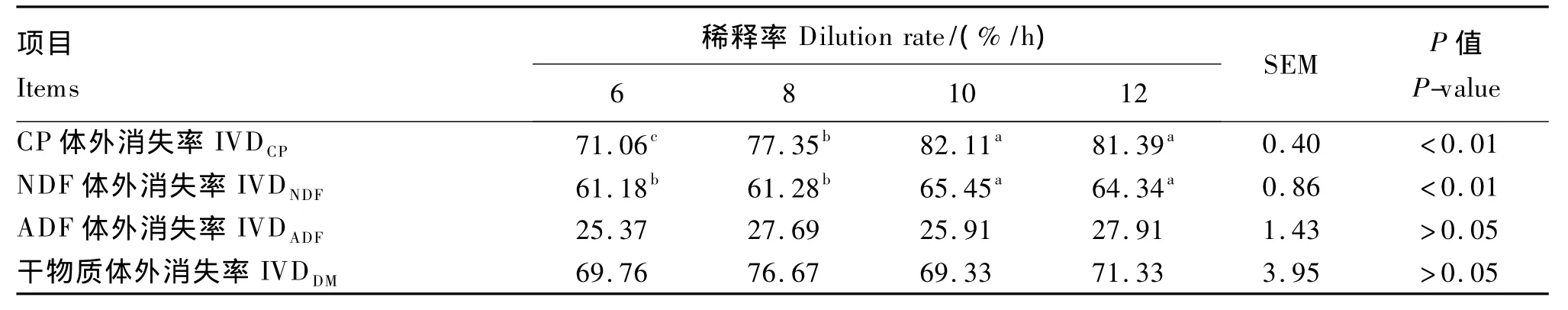
表3 稀释率对饲粮营养物质体外消失率的影响Table 3 Effects of dilution rate on in vitro disappearance rate of dietary nutrients
3.2 稀释率对原虫数量、纤维素类酶活性及MCP产量的影响
本试验中所有发酵罐的原虫数量在试验第2天均大量下降。试验期内,原虫数量的随着稀释率从6%/h上升到8%/h而显著上升,但当稀释率从8%/h上升到12%/h时,原虫数量又极显著下降,这可能是由于6%/h的最低稀释率条件下,注入到发酵罐的人工唾液量较少,引起发酵产物和部分饲料的积累,导致pH下降而不利于罐中的原虫生长。但稀释率太大,附着在饲料颗粒生存的原虫会随着过高外流速度的溢流液而流出罐外。进入试验后期,虽然原虫数量较接种时牛体的原虫数量低,但都可以维持在104的数量级,这与Hoover等[1]采用的连续培养系统所得出的结果相近,他们得出原虫数量能够维持在6.7×104mL-1。Crawford等[19]的研究结果则显示瘤胃稀释率对原虫数量无显著影响。研究结果不一致可能由于系统内部结构存在部分差异,以及瘤胃液供体牛的品种状况以及接种时采用的瘤胃液与缓冲液比例不同等原因。
本试验中木聚糖酶活性随稀释率的升高而降低,而 Martínez 等[3]曾得出木聚糖酶活性在高稀释率(5.42%/h)条件下,显著高于低稀释率(3.78%/h)条件,结果不一致的原因是模拟装置本身的差异,且选用的稀释率范围不同,本试验采用的稀释率的范围为 6%/h ~ 12%/h,Martínez等[3]采用的范围是 3.78%/h ~5.42%/h。提高稀释率可以降低溢流液中MCP产量的结果与Meng等[20]的研究结果相似,他们指出当稀释率从2.5%/h提高到10%/h时,MCP产量逐渐增加,但当稀释率超过10%/h时,MCP产量却开始下降。瘤胃和发酵液的厌氧微生物利用饲粮中的蛋白质降解成的氨基酸等作为氮源,利用饲粮有机物发酵产生的VFA和能量等合成MCP。当稀释率高于10%/h,食糜停留在瘤胃中时间过短,以致影响厌氧微生物的增殖,同时降低并带走发酵终产物,从而也就降低了MCP产量。
3.3 稀释率对饲粮营养物质消失率的影响
双外流连续培养系统现已被广泛应用于饲粮营养价值的评定[4]。本试验中得出稀释率对饲粮干物质体外消失率无显著影响,这与王照华等[25]研究得出稀释率对饲粮营养物质的消失率无显著影响基本一致。孟庆翔等[5]采用稀释率为0.05%/h~0.15%/h进行双外流模拟试验,得出稀释率对干物质、有机物和CP的体外消失率均没有显著影响。但也有部分学者研究得出提高稀释率能够显著的增加干物质及NDF等的体外消失率[3,26],Meng 等[20]曾发现增加稀释率可以降低 3种不同饲粮的干物质消失率。Hoover等[10]得出在低稀释率(4%/h、8%/h)条件下时,CP消失率较高,可以达到60% ~70%,且随着稀释率的增高,CP消失率降低到不多于40%。导致这些不同研究结果的原因可能是由于各个双外流培养系统的结构、试验饲粮精粗比、饲粮的粉碎程度等存在差异。这些研究结果表明在一定范围内提高稀释率,不会导致瘤胃中饲粮消失率降低。
4 结论
稀释率能够影响新型固液气分流式瘤胃模拟系统的发酵情况,稀释率为8%/h时,原虫数量以及纤维素类酶活性、各瘤胃发酵参数更加有利于发酵,因此可推荐作为本系统进行应用试验研究时的最优运行条件。
[1] HOOVER W H,CROOKER B A,SNIFFEN C J.Effect of differential solid-liquid removal rates on protozoa numbers in continuous cultures[J].Journal of Animal Science,1976,43(2):528-534.
[2] TEATHER R M,SAUER F D.A naturally compartmented rumen simulation system for the continuous culture of rumen bacteria and protozoa[J].Journal of Dairy Science,1988,71(3):666-673.
[3] MARTÍNEZ M E,RANILLA M J,RAMOS S,et al.Effects of dilution rate and retention time of concentrate on efficiency of microbial growth,methane production,and ruminal fermentation in Rusitec-fermenters[J].Journal of Animal Science,2009,92:3930-3938.
[4] 王加启,冯仰廉.瘤胃持续模拟技术的研究[J].动物营养学报,1995,7(1):29-35.
[5] 孟庆翔.瘤胃稀释率对蛋白质发酵和微生物生长效率的影响[J].中国农业科学,1998(3):1-4.
[6] 沈维军,姜雅慧,王加启,等.固液气分流式瘤胃模拟系统的设计与测试[J].农业工程学报,2012(3):20-26.
[7] HOOVER W H,CRAWFORD R J,Jr,et al.Effect of solid and liquid flows on fermentation in continuous cultures.Ⅲ.Solids retention time[J].Journal of Animal Science,1982,54(4):849-854.
[8] SHRIVER B J,HOOVER W H,SARGENT JP,et al.Fermentation of a high concentrate diet as affected by ruminal pH and digesta flow[J].Journal of Dairy Science,1986,69(2):413-419.
[9] SCHADT I,HOOVER W H,WEBSTER M,et al.Degradation of two protein sources at three solids retention times in continuous culture[J].Journal of Animal Science,1999,77(2):485-491.
[10] HOOVER W H,KINCAID C R,VARGA G A,et al.Effects of solids and liquid flows on fermentation in continuous cultures.Ⅳ.pH and dilution rate[J].Journal of Animal Science,1984,58:692-699.
[11] EUN J S,FELLNER V,GUMPERTZ M L.Methane production by mixed ruminal cultures incubated in dual-flow fermenters[J].Journal of Dairy Science,2004,87(1):112-121.
[12] MCDOUGALL E I.Studies on ruminant saliva.1.The composition and output of sheep’s saliva[J].Biochemical Journal,1949,43(1):99-109.
[13] OGIMOTO K,IMAI S.Atlas of rumen microbiology[M].Tokyo:Japan Scientific Societies Press,1981:158.
[14] 王加启,于建国.饲料分析与检测[M].北京:中国计量出版社,2004.
[15] BRODERICK G,KANG J H.Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J].Journal of Dairy Science,1980,63:64-75.
[16] MAKKAR H P S,MCSWEENEY C S.Ciliate protozoa methods in gut microbial ecology for ruminants[M].Netherlands:Springer,2005:67-78.
[17] VINH N T,WANAPAT M,KHEJORNSART P,et al.Studies of diversity of rumen microorganisms and fermentation in swamp buffalo fed different diets[J].Journal of Animal and Veterinary Advances,2011,10:406-414.
[18] YUE Q,YANG H J,CAO Y C,et al.Feruloyl and acetyl esterase production of an anaerobic rumen fungus Neocallimastix sp.YQ2 affected by glucose and soluble nitrogen supplementations and its potential in the hydrolysis of fibrous feedstuffs[J].Animal Feed Science and Technology,2009,153:263-277.
[19] CRAWFORD R J,Jr,HOOVER W H,KNOWLTON P H.Effects of solids and liquid flows on fermentation in continuous cultures.Ⅰ.Dry Matter and fiber digestion,VFA production and protozoa numbers[J].Journal of Animal Science,1980,51:975-985.
[20] MENG Q,KERLEY M S,LUDDEN P A,et al.Fermentation substrate and dilution rate interact to affect microbial growth and efficiency[J].Journal of Animal Science,1999,77(1):206-214.
[21] FIRKINS J L.Maximizing microbial protein synthesis in the rumen[J].The Journal of Nutrition,1996,126:1347-1354.
[22] ERFLE J D,BOILA R J,TEATHER R M,et al.Effect of pH on fermentation characteristics and protein degradation by rumen microorganisms in vitro[J].Journal of Dairy Science,1982,65(8):1457-1464.
[23] RIBEIRO C V,KARNATI S K R,EASTRIDGE M L.Biohydrogenation of fatty acids and digestibility of fresh alfalfa or alfalfa hay plus sucrose in continuous culture[J].Journal of Dairy Science,2005,88(11):4007-4017.
[24] PATTERSON J A,CHALOVA V I,HESPELL R B,et al.Dilution rates influence ammonia-assimilating enzyme activities and cell parameters of Selenomonas ruminantium strain D in continuous(glucose-limited)culture[J].Applied Microbiology and Biotechnology,2010,108(1):357-65.
[25] 王照华,候先志.持续瘤胃模拟法研究不同日粮精粗比对瘤胃真菌生长和发酵参数的影响[J].饲料工业,2006,27(18):21-23.
[26] BOGUHN J,KLUTH H,RODEHUTSCORD M.Effect of total mixed ration composition on amino acid profiles of different fractions of ruminal microbes in vitro[J].Journal of Dairy Science,2006,89(5):1592-1603.
