模拟淹水对杞柳生长和光合特性的影响
2013-12-19赵竑绯徐小牛
赵竑绯,赵 阳,张 驰,徐小牛
(安徽农业大学林学与园林学院,合肥 230036)
淹水胁迫是植物主要非生物胁迫之一,当土壤中的水分含量超过了土壤田间持水量,此时的生长环境就对植物造成了淹水胁迫,在沿海、沿江地带每年都有可能发生的洪涝灾害会对在此区域分布的树种产生淹水胁迫。淹水胁迫一般会抑制植物的茎杆和根的生长,导致整株植物生物量的下降及未成熟果实的脱落等[1],但也有研究表明淹水胁迫对日本柳杉和落羽杉的生长影响不显著,对柳树及绒毛白蜡的生物量的累积有促进作用[2]。淹水胁迫下植物的光合速率、气孔导度和光化学量子效率通常会短时间(耐淹植物)或者长期(不耐淹植物)下降[3-4],淹水同时也导致叶绿素的降解、膜的渗透性的增加及根系的氧气缺乏,耐淹植物会通过形成肥大的皮孔、通气组织和不定根等来适应淹水胁迫[5]。
杞柳(Salix integra Thunb.)杨柳科柳属,多年丛生落叶灌木,主要分布在我国沿淮流域的河岸带,对水土保持和水源涵养具有十分重要的作用。每年的7—10月份大面积的杞柳林地都有可能会由于淮河河水的泛滥而淹渍在水中。目前已有对杨柳科的美洲黑杨(Poputus deltoides)与旱柳(Salix matsudana)[2]、新疆杨(Populus alba var.pyramidalis Bunge)与箭杆杨(Populus nigra L.var.thevestina)[6]、细柱柳(Salix gracilistyla)与日本三蕊柳(Salix subfragilis)[7-8]等在干旱和淹水胁迫下生长及光合生理生态机制的研究报道,而淹水对杞柳的生长和光合生理生态的影响还未见报道。
本试验以杞柳的两个不同品种红皮柳(Salix integra cv.hongpi)和青皮柳(Salix integra cv.qingpi)为研究材料,模拟了8—10月份75 d的淹水过程。主要的研究目的有两个:1)淹水胁迫对两个杞柳品种的形态、气体交换和叶绿素荧光的影响;2)合理选择和定向培养耐涝品种,减轻淹涝对农业生产的危害,并为杞柳耐淹的生理机制研究提供一定的理论依据。
1 材料与方法
1.1 试验材料及试验设计
试验材料为1年生的红皮柳与青皮柳,种条来自于安徽省阜南县黄岗镇,于2011年3月在安徽农业大学校内试验地扦插培育。2011年5月中旬,在试验地挑选生长一致的苗木进行盆栽(直径23cm,高28cm),栽培基质选用黄岗地区常见的砂姜黑土与泥炭土3∶1混合,未施肥,每盆基质6kg,每盆2株。为保证苗木的相对一致性,所有苗木都处于相同的光照和雨水环境中,苗木生长期间正常浇水和管理。2011年8月每个品种挑选60盆大小和长势基本相同的苗木,分为3组进行室外淹水试验,将盆放进水箱里,水箱根据设计注水,3个处理水平分别为:A为对照处理,正常浇水;B为渍水,水面在土壤表面以下15 cm,模拟地下水位过高;C为轻度淹水胁迫,水面高于土面4cm左右。淹水处理时间为75 d,从2011年8月至10月,基本与黄岗地区夏季多雨期持续时间相同。
1.2 形态特征的观察及苗高、基径的测定
定期观察试验苗木有无叶片发黄脱落、不定根形成以及肥大皮孔出现等现象,进行详细记录。苗高用卷尺测量(精确到0.1cm),基径测定部位为高于土面5cm处,每株用游标卡尺交叉测定2次(精确到0.01mm),取平均值。
1.3 生物量的测定
淹水处理前和结束时各测1次,淹水前每个品种各测定了15盆植株,淹水后对两个品种不同处理下的45盆植株全部进行了测定,分根、茎、叶3部分分别称重,在60℃烘箱内烘干至恒重,计算生物量及其分配。
1.4 光合作用和气孔导度的测定
选择晴天9:00—13:00,自然光照在1000—1500 μmol·m-2·s-1(光饱和点是1400 μmol·m-2·s-1)时,对两个品种不同处理下的净光合速率、气孔导度用Li-6400(LI-COR Inc.,Lincoln,USA)光合仪的标准透明叶室进行测定。测定叶片为从顶部数第4—7片完全展开叶,每次每个处理测定10个重复,取平均值。叶室空气温度测定控制在30℃,叶室空气湿度控制在40%—60%,与室外温湿度保持基本一致。
1.5 叶绿素荧光的测定
叶绿素荧光相关参数(Fv/Fm、NPQ)的测定采用Li-6400光合仪的标准荧光叶室进行测定。在清晨测定之前必须对要测定的叶片进行标记,并用暗适应夹进行暗适应30—40min后,测定最大光化学效率Fv/Fm。在测定完Fv/Fm后,将标记过的叶片依次置于叶室内光照活化20 min后,测定非光化学淬灭系数NPQ。
1.6 叶绿素含量的测定
采集与测定光合作用相同位置和相同成熟度的叶片,将采集的新鲜叶片分为两份,从其中一份称取0.1g新鲜叶片用80%的丙酮提取,并用紫外分光光度计进行测定,采用Aron方法计算叶绿素a、叶绿素b及总叶绿素含量。另一份置于60℃干燥箱中烘干至恒重,计算叶片的含水率。每个品种每个处理任取10个植株的叶片混合,重复3次,取平均值,最后根据提取液中叶绿素浓度和叶片含水率,换算为每克干叶中叶绿素含量(mg/g)。
1.7 数据统计分析
利用Excel 2003整理数据,DPS分析软件进行方差分析,并用LSD进行多重比较,显著性差异水平为P=0.05。
2 结果与分析
2.1 淹水胁迫对不同杞柳品种形态特征的影响
经过75 d的淹水处理后,红皮柳和青皮柳的存活率都为100%,但两个品种的形态特征却存在明显差异。青皮柳在B处理下,叶片形态与对照基本一致,在C处理的后期(55 d),下部有少量叶片变黄脱落。红皮柳在B处理下,第40天开始有部分叶片脱落,在C处理淹水至33 d时,叶片开始失绿且有枯死斑点,叶片大量脱落,生长减缓。
B处理下,红皮柳和青皮柳的茎基部与对照一致,都未出现肥大皮孔及不定根。淹水15 d时,C处理下青皮柳水面以下的茎基部产生白色肥大皮孔及红色的不定根;红皮柳在C处理下,第20天时在淹水部位的茎上有白色的附着物,24 d时出现肥大的皮孔和少量的不定根,随着淹水时间的延长,青皮柳不定根的数量进一步增多,明显大于红皮柳不定根增加的数量。
2.2 淹水胁迫对杞柳生长的影响
淹水开始时,虽然青皮柳的条高和基径都高于红皮柳,但是经方差分析检验,不同品种的条高和基径之间差异不显著(P >0.05),不同水分处理的条高和基径之间差异也不显著(P >0.05)(表1),两个品种的生长状况相似。在淹水胁迫的前20d,在B、C处理下,两个类型的基径和条高与对照相比没有明显的减少(P>0.05),但20d后红皮柳基径和条高的生长受到明显的影响,且随淹水胁迫时间的增加,高生长所受到的抑制越明显(图1)。淹水试验结束时,B、C处理下红皮柳的基径分别比对照减少了6%、9%,条高分别比对照减少了7%、10%。在整个淹水过程中,青皮柳的基径和条高与对照相比差异不显著(P >0.05),B处理在一定程度上促进了其基径与条高的生长,说明青皮柳可以适应地下水位较高的环境且生长良好。

表1 淹水初始时的方差分析Table 1 Analysis of variance at the beginning of the flooding
2.3 淹水胁迫对杞柳生物量的影响
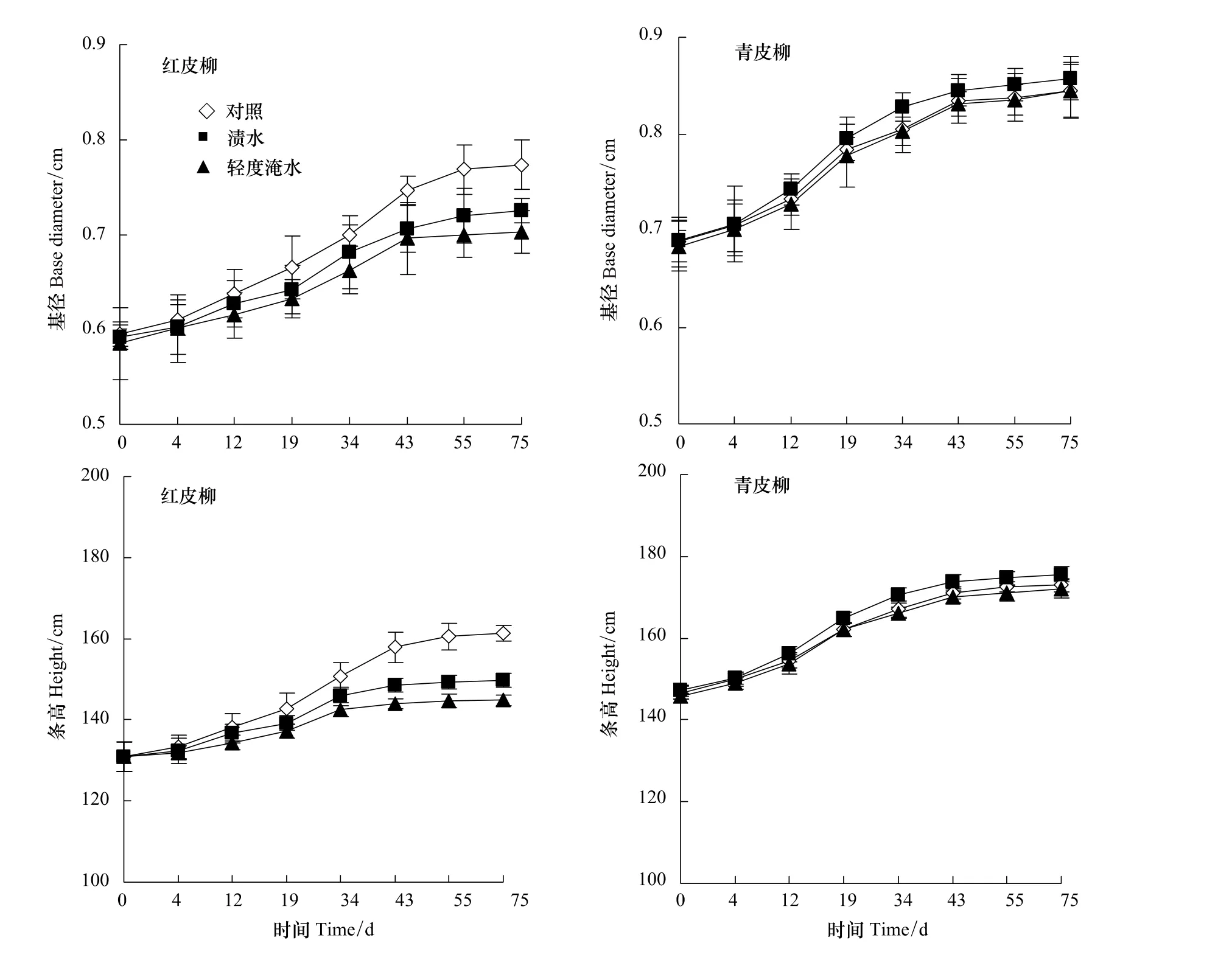
图1 淹水期间杞柳不同类型基径、条高的变化(平均值±标准误差,n=10)Fig.1 Changes of base diameter and height of the two types of Salix integra during the flooded period(Mean ± SD,n=10)
与处理前相比红皮柳在B处理下与对照差异不显著(表2),C处理则抑制了生物量的积累,主要表现为茎生物量的减少。青皮柳在B处理下总生物量较对照有较明显的提高,而在C处理下与对照无显著差异;B与C处理显著增加了青皮柳根系的生物量,分别比对照增加了37%、20%。淹水结束时,两类型在不同处理下的生物量都较淹水开始时有不同程度的增加,生物量增长率的变化范围为41.06%—125.15%。
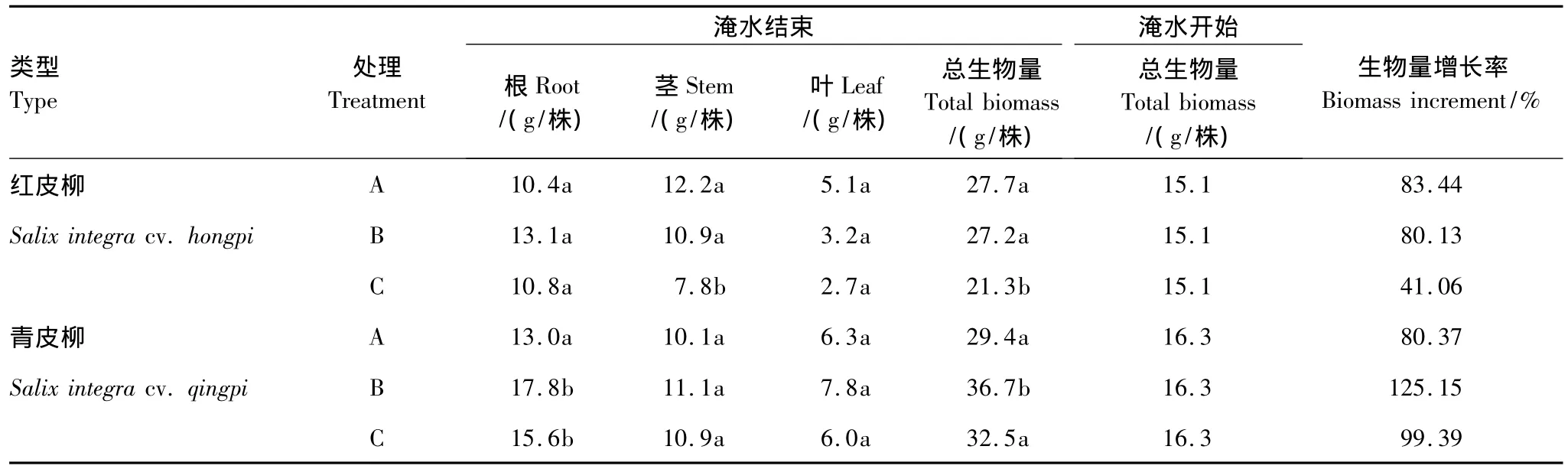
表2 淹水胁迫前后杞柳生物量及其组成Table 2 Changes of biomass before and after flooding
2.4 淹水胁迫对杞柳光合速率和气孔导度的影响
淹水19d时,与对照相比,红皮柳的净光合速率明显下降(图2),B、C处理下的净光合速率分别下降25%、48%,随着淹水时间的增加净光合速率降低的幅度有所回升,淹水结束时红皮柳在B、C处理下净光合速率比对照分别下降了34%、46%。青皮柳在三个处理下的净光合速率无显著差异(P>0.05)。
淹水胁迫下红皮柳与青皮柳的气孔导度变化与净光合速率的变化相似,与对照相比,淹水19d时红皮柳在B、C处理下的气孔导度分别下降了35%、56%,随着淹水时间的延长气孔导度逐渐下降;青皮柳的气孔导度在B处理下比对照高24%,C处理与对照差异不显著(P>0.05)。淹水结束时,B、C处理下红皮柳的气孔导度分别比对照下降24%、51%;青皮柳在B、C处理下的气孔导度和对照没有差别。

图2 淹水对红皮柳和青皮柳光合速率及气孔导度的影响(平均值±标准误差,n=10)Fig.2 Effect of flooding on net photosynthesis rate(PN)and stomatal conductance(Gs)in seedlings of the two types of Salix integra(Mean±SE,n=10)
2.5 淹水过程中杞柳叶绿素含量的变化
不同植物在淹水胁迫的不同时期,其叶绿素a(Chla)、叶绿素b(Chlb)及总叶绿素(Chl(a+b))的变化存在一定的差异。对红皮柳来说,整个淹水过程中Chla、Chl(a+b)含量差异显著,而青皮柳的Chla、Chlb及Chl(a+b)含量差异性不大(P<0.05)。随着淹水时间的增加,两种类型的Chla、Chlb及Chl(a+b)都呈现出相似的变化趋势。红皮柳的叶绿素含量在淹水19d开始持续下降,淹水结束时,B处理下Chla、Chlb和Chl(a+b)的平均值分别为1.08、0.59、1.67mg/g,C 处理下的 Chla、Chlb 和 Chl(a+b)的平均值分别为 0.91、0.52、1.43 mg/g。青皮柳在整个淹水过程中叶绿素含量波动较小,在淹水43d之后有小幅的下降(图3)。

图3 淹水对红皮柳和青皮柳叶绿素含量的影响(平均值±标准差,n=10)Fig.3 Effect of flooding on leaf chlorophyll concentrations in seedlings of Salix integra(Mean±SE,n=10)
2.6 淹水胁迫对杞柳叶绿素荧光的影响
在B、C处理下,红皮柳的最大光化学效率(Fv/Fm)自34d开始出现了明显的下降趋势,75 d时B、C处理下的Fv/Fm平均值分别为0.74、0.69,对照的Fv/Fm值为0.811(图4)。青皮柳在整个淹水过程中,B处理和C处理的Fv/Fm值都在0.8—0.85的范围内波动,且与对照的Fv/Fm值十分接近。在B、C处理下红皮柳的非光化学淬灭系数(NPQ)自34d开始增加,淹水结束时B、C处理下的NPQ平均值分别为0.79、0.83,比对照分别高11%、17%。青皮柳的NPQ值在淹水过程中也呈增加的趋势,不同处理之间的差异不显著(p>0.05)。

图4 淹水期间红皮柳和青皮柳最大光化学量子效率及非光化学淬灭的变化(平均值±标准误差,n=10)Fig.4 Changes of the maximum quantum efficiency of the PSⅡ (Fv/Fm)and non-photochemical quenching coefficient(NPQ)in Salix integra seedlings during the flooded period(Mean±SE,n=10)
3 讨论
3.1 淹水胁迫对杞柳形态和生长的影响
在整个试验过程中,淹水胁迫下的红皮柳和青皮柳都产生了不定根和肥大的皮孔,这是耐淹木本植物对淹水的标志性形态反应[9-11]。在较长时间的淹水环境中,不定根的产生有利于植物的水分、养分及激素的供应和调节[12-13]。皮孔是植物茎杆和根系内部组织与大气进行气体交换的重要途径[14],肥大的皮孔和通气组织的产生可以增加气体扩散,提高露于空气中吸收O2的总面积,增加O2向根部的输送量[5,11]。青皮柳早于红皮柳形成肥大皮孔和不定根,而且不定根的数量和长度都明显高于红皮柳,说明青皮柳较红皮柳有更强的净光合速率和气孔导度的恢复能力。
在淹水胁迫下红皮柳和青皮柳的基径、条高和生物量都受到了一定程度的影响,轻度淹水胁迫处理明显降低了红皮柳的条高和生物量,而基径的降幅较小,有研究表明淹水胁迫通过阻碍植物节间的生长、叶原基的分化以抑制叶片的生长并诱导叶片脱落[15],基径的降幅较小可能是由于茎基部形成肥大的皮孔以及通气组织所致。青皮柳的基径、条高和生物量在渍水处理下都较对照有所提高,在轻度淹水胁迫下与对照无显著差异,说明适度的水分胁迫有利于青皮柳的生长。
3.2 淹水胁迫对杞柳光合的影响
淹水胁迫过程中红皮柳的净光合速率和气孔导度在19 d时有明显的下降,之后又有小幅的回升;青皮柳在轻度淹水胁迫下的净光合速率和气孔导度在淹水后期恢复到与对照相近的水平,这与对鹅掌楸(Liriodendron chinense)、水翁(Cleistocalyx operculatus)[10]及狐米草(Spartina patens)[16]的研究结果相似,淹水早期植物光合速率的降低与气孔的关闭、气孔导度下降有关,叶片吸收CO2能力的降低,从而增加了胞间CO2浓度,而光合酶底物的减少直接导致了净光合速率的降低[17-19],气孔导度的降低可能是土壤和植物间水力导度的降低或根系氧气缺乏所引起的[1]。淹水中后期不定根的出现以及与水接触的茎基部形成的肥大皮孔,一定程度上缓解了根系的低氧状态,净光合速率和气孔导度有所回升;渍水处理促进了青皮柳的净光合速率和气孔导度的增加,与对落羽杉及乌桕(Sapium sebiferum)[20]的研究结论一致,说明青皮柳较红皮柳更耐淹。
3.3 淹水胁迫对叶绿素含量的影响
在淹水胁迫下,植物的叶片会表现出失绿和脱落,这与细胞膜受损电解质外渗有关[5,13,21],但也有研究表明不耐淹植物在淹水胁迫下叶绿素含量没有变化[17]。在淹水过程前期,红皮柳和绿皮柳的叶绿素含量与对照无明显差异,在12d之后,红皮柳的Chla、Chlb的含量都开始下降,叶片逐渐出现失绿的现象,而青皮柳的叶绿素含量未出现较大变化,只在淹水后期有所降低,植株下部叶片有少量变黄脱落。此外,在淹水过程中红皮柳的Chla含量的下降幅度大于Chlb含量的下降幅度,这与对黄秋葵(Hibiscus esculentus)[22]的研究结果一致,说明淹水胁迫对红皮柳叶片光合反应中心的降解程度高于对捕光蛋白色素复合体的降解,在光合过程中Chla更多的结合在光系统反应中心上,而Chlb主要结合在捕光蛋白复合体上[23]。
3.4 淹水过程中叶绿素荧光的变化特征
叶绿素荧光参数的变化反映了环境胁迫对光系统Ⅱ的损伤程度,Fv/Fm的变化主要反映了植物净光合速率受到的影响,持续稳定的Fv/Fm值表明光反应系统未受到损伤[24-26],NPQ反映了光化学反应中热耗散的大小,也即未用于光化学反应中的那部分能量的大小[27]。红皮柳的Fv/Fm以及NPQ的值在淹水过程中持续下降,与净光合速率的下降趋势相一致,这与Close[9]及衣英华[28]的研究结果相似,体现了红皮柳在淹水过程中光化学活性的变化;青皮柳的Fv/Fm以及NPQ值在不同淹水胁迫下与对照相比差异不显著,与James[29]和Mielke[30]的研究结果相一致,说明在淹水胁迫下青皮柳有着良好的适应能力,其光化学系统Ⅱ的活力一直维持在正常的水平,净光合速率的波动可能更多的是由于气孔导度的变化引起的。
综上所述,随着淹水时间的增加,植物受损伤的潜在可能性就越大,绝大部分植物只能经受1—3个月的持续淹水[31],红皮柳和青皮柳在75 d的淹水之后存活率都为100%,说明杞柳对淹水有较强的忍耐力。在淹水胁迫初始时,红皮柳和青皮柳的生长无显著差异(P>0.05),随着淹水时间的持续,红皮柳的生长和光合机能都受到了一定程度的抑制,而渍水处理则促进了青皮柳的生长,因此青皮柳比红皮柳更耐淹,更适合在河岸带和消落区生长。由于试验是杞柳1年生扦插苗的盆栽淹水试验,试验结果可能与多年生的杞柳以及田间淹水试验的结果有所不同,淹水过后杞柳的光合生理恢复机制也是今后进一步研究的方向。
[1] Vartapetian B B,Jackson M B.Plant adaptation to an aerobic stress.Annals of Botany,1997,79(S1):3-20.
[2] Tang L Z,Xu X Z,Fang S Z.Influence of soil waterlogging on growth and physiological properties of poplar and willow seedlings.Chinese Journal of Applied Ecology,1998,9(5):471-474.
[3] Schwanz P,Picon C,Vivin P.Responses of antioxidative systems to drought stress in pendunculatae oak and maritime pine as modulated by elevated CO2.Plant Physiology,1996,110:393-402.
[4] Carvalho L C,Amancio S.Antioxidant defence wywtem in system transferred from in vitro to ex vitro effects of increasing light intensity and CO2concentration.Plant Science,2002,162(1):33-40.
[5] Kozlowski T T.Responses of woody plants to flooding and salinity.Tree Physiology,1997,(1):1-29.
[6] Li X M,Kakubari Y.Photosynthesis and chlorophyll a fluorescence of two poplars under water stress.Journal of Forest Research,2001,6(3):211-215.
[7] Nakai A,Yurugi Y,Kisanuki H.Stress responses in Salix gracilistyla cuttings subjected to repetitive alternate flooding and drought.Trees,2010,24(6):1087-1095.
[8] Nakai A,Kisanuki H.Stress responses of Salix gracilistyla and Salix subfragilis cuttings to repeated flooding and drought.Journal of Forest Research,2011,16(6):465-472.
[9] Close D C,Davidson N J.Long term waterlogging:nutrient,gas exchange photochemical and pigment characteristics of Eucalyptus nitens saplings.Russian Journal of Plant Physiology,2003,50(6):843-847.
[10] Jing Y X,Cheng Z P,Cheng H Y,Mo X M.The relationship between photosynthetic character and adventitious roots in flooded Cleistocalyx Operculatus seedlings.Journal of Tropical and Subtropical Botany,2000,8(1):361-364.
[11] Yamamoto F,Sakata T,Terazawa K.Physiological,morphological and anatomical responses of Fraxinus mandshurica seedlings to flooding.Tree physiology,1995,15(11):713-719.
[12] Tsukahara H,Kozlowski T T.Importance of adventitious roots to growth of flooded Platanus occidentalis seedlings.Plant and Soil,1995,88(1):123-132.
[13] Islam M A,Macdonald S E.Ecophysiological adaptations of black spruce(Picea mariana)and tamarack(Larix laricina)seedlings to flooding.Trees,2004,18(1):35-42.
[14] Kozlowski T T,Pallardy S G.Acclimation and adaptive responses of woody plants to environmental stresses.Botanical Review,2002,68(2):270-334.
[15] Cao F L,Robert E F.Effect of artificial flooding on physiological characteristics of Populus Deltoides clones.Journal of Nanjing Forestry University,1993,17(2):29-44.
[16] Pezeshki S R,Pardue J H,Delaune R D.The influence of soil oxygen deficiency on alcohol dehydrogenase activity,root porosity,ethylene production,and photosynthesis in Spartina patens.Environmental and Experiment Botany,1993,33(4):565-573.
[17] Pezeshki S R,Pardue J H,Delaune R D.Leaf gas exchange and growth of flood tolerant and flood sensitive tree species under low soil redox conditions.Tree Physiology,1996,16(4):453-458.
[18] Malik A I,Colmer T D,Lambers H,Schortemeyer M.Changes in physiological and morphological traits of roots and shoots of wheat in response to different depths of waterlogging.Australian Journal of Plant Physiology,2001,28(11):1121-1131.
[19] Farquhar G,Sharkey T D.Stomatal conductance and photosynthesis.Annual Review of Plant Physiology and Plant Molecular Biology,1982,33:317-345.
[20] Cao F L,Cai J F,Wang G B,Zhang W X.Effects of waterlogging stress on the growth and photosynthesis of Sapium sebiferum.Scientia Silvae Sinicae,2010,46(10):57-61.
[21] Smethurst C F,Shabala S.Screening methods for waterlogging tolerance in lucerne:comparative analysis of waterlogging effects on chlorophyll fluorescence,photosynthesis,biomass and chlorophyll content.Functional Plant Biology,2003,30(3):335-343.
[22] Ashraf M,Arfan M.Gas exchange characteristics and water relations in two cultivars of Hibiscus esculentus under waterlogging.Biologia Plantarum,2005,49(3):459-462.
[23] Larcher W.Physiological Plant Ecology.Berlin,Heidelberg,New York:Springer,2003.
[24] Ball M C,Butterworth J A,Roden J S,Christian R,Egerton J G.Applications of chlorophyll fluorescence to forest ecology.Plant Physiology,1994,22(2):311-319.
[25] Jones D T,Sah J P,Ross M S,Oberbauer S F,Hwang B,Jayachandran K.Responses of twelve tree species common in Everglades tree islands to simulated hydrologic regimes.Wetlands,2006,26(3):830-844.
[26] Lavinsky A O,De Souza Sant C,Mielke M S,De Almeida A F,Gomes F P,Franca S,Da Costa Silva D.Effects of light availability and soil flooding on growth and photosynthetic characteristics of Genipa Americana L.seedlings.New Forests,2007,34(1):41-50.
[27] Maxwell K,Johnson G N.Chlorophyll fluorescence a practical guide.Journal of Experimental Botany,2000,51(345):659-668.
[28] Yi Y H,Fan D Y,Xie Z Q,Chen F Q.Effects of waterlogging on the gas exchange,chloropgyll fluorescence and water potential of Quercus Variabilis and Pterocarya Stenoptera.Journal of Plant Ecology,2006,30(6):960-968.
[29] James R A,Rivelli A R,Munns R,Von Caemmerer S.Factors affecting CO2assimilation,leaf injury and growth in salt-stresses durum wheat.Functional Plant Biology,2002,29(12):1393-1403.
[30] Mielke M S,De Almeida A F,Gomes F P,Aguilar A G,Mangabeira P A.Leaf gas exchange,chlorophyll fluorescence and growth responses of Genipa Americana seedlings to soil flooding.Environmental and Experimental Botany,2003,50(3):221-231.
[31] Jing Y X,Li G L,Gu B H,Yang D J,Xiao L,Liu R X,Peng C L.Leaf gas exchange,chlorophyll fluorescence and growth responses of Melaleuca alternifolia seedlings to flooding and subsequent recovery.Photosynthetica,2009,47(4):595-601.
参考文献:
[2] 唐罗忠,徐锡增,方升佐.土壤涝渍对杨树和柳树苗期生长及生理性状影响的研究.应用生态学报,1998,9(5):471-474.
[10] 靖元孝,陈兆平,程惠青,莫熙穆.淹水时水翁幼苗光和特性与不定根的关系.热带亚热带植物学报,2000,8(1):361-364.
[15] 曹福亮,罗布特·法门.人工淹水逆境处理对美洲黑杨苗生理特性的影响.南京林业大学学报:自然科学版,1993,17(2):29-44.
[20] 曹福亮,蔡金峰,汪贵斌,张往祥.淹水胁迫对乌桕生长及光合作用的影响.林业科学,2010,46(10):57-61.
[28] 衣英华,樊大勇,谢宗强,陈芳清.模拟淹水对枫杨和栓皮栎气体交换、叶绿素荧光和水势的影响.植物生态学报,2006,30(6):960-968.
