茅苍术叶片可培养内生细菌多样性及其促生潜力
2013-12-19周佳宇王宏伟戴传超
周佳宇,贾 永,王宏伟,戴传超
(南京师范大学生命科学学院,江苏省微生物与功能基因组学重点实验室,江苏省微生物资源产业化工程技术研究中心,南京 210023)
茅苍术(Atractylodes lancea(Thunb.)DC.)为菊科苍术属多年生草本植物,其干燥根茎为著名药材苍术。江苏省茅山地区为茅苍术道地产区,由于近年来掠夺性的采挖,加之生境破坏严重,茅苍术资源面临濒危和枯竭[1]。目前,茅苍术药材基本来自人工栽培,因此,研究影响茅苍术活性成分积累和配比的因素对高质量茅苍术药材的栽培和生产至关重要[2]。一些植物内生菌与宿主植物长期共存、协同进化。茅苍术体内高挥发油含量的特殊环境使其蕴含有独特的内生菌资源,而内生菌也能够影响茅苍术的生长发育及其药用活性成分的组成和积累[3]。一些内生真菌能够促进茅苍术组培苗的生长,增强其对环境的适应性,提高其成活率[4]。
由于茅苍术叶片是挥发油合成的主要部位,且其中的内生细菌尚无相关研究,本文探究了茅苍术叶片中可培养内生细菌的多样性及其固氮、解磷、解钾和产生长素的能力。通过本研究筛选得到一些具有植物促生潜力的茅苍术内生细菌资源,初步揭示了内生细菌与茅苍术之间的相互关系,为进一步将内生细菌回接茅苍术植株,增加茅苍术药材的产量和药理活性物质的积累提供了重要依据。
1 材料与方法
1.1 植物来源与内生细菌的分离
多年生茅苍术植株100株来源于茅苍术道地产区江苏省茅山地区九龙药材公司茅苍术药材种植园,移栽至南京师范大学植物园生长超过2a,长势良好、无病虫害。2011年秋季,随机挑选20株花果期健康的茅苍术植株并摘取其完整的中上部叶片,共20片。
茅苍术叶片经自来水和双蒸水分别清洗后,用70%乙醇消毒1 min,0.1%升汞消毒10 min,无菌水冲洗多次[4],研磨后分别涂布于牛肉膏蛋白胨培养基和Luria Bertani(LB)培养基上,同时也分别涂布最后一次洗涤液,作为叶片表面灭菌彻底的对照。涂布好的培养基于30℃培养,待有菌落形成时,依据菌落形态的差异,分别挑取不同的内生细菌单菌落,纯化后于LB斜面上4℃保藏。主要依据的形态特征有:菌落大小、菌落形状、菌落边缘是否齐整、菌落颜色、菌落透明度、菌落光泽度以及菌落表面是否光滑、是否存在特殊结构。
1.2 茅苍术内生细菌的多样性分析
使用通用引物27F和1492R[5],采用菌液PCR对分离得到的茅苍术内生细菌进行16S rDNA片段的扩增。扩增后获得大小在1500 bp左右的片段,经1%琼脂糖凝胶电泳检验合格后进行核糖体DNA扩增片段限制性内切酶分析(ARDRA)。
将一部分16S rDNA片段扩增产物使用限制性内切酶HaeⅢ和AluⅠ在37℃下分别消化4 h,用3%琼脂糖凝胶120 V电泳后紫外成像并拍照。使用GelcomparⅡ软件[6]对获得的限制性片段多态性图谱进行UPGMA 聚类分析[7]。
在各ARDRA聚类簇中挑选代表菌株,对其16S rDNA片段进行测序。序列测定委托北京六合华大基因科技股份有限公司进行,测序引物与扩增相同,PCR产物直接测通。测序结果在Genbank中进行BLAST同源性比对,推测其分类地位。
对主要ARDRA聚类簇中的内生细菌进行BOX-PCR分析。BOX-PCR产物经上述凝胶电泳、成像、拍照和聚类分析后,得到主要ARDRA聚类簇中内生细菌的聚类分析图,研究聚类簇水平上内生细菌的多样性[8]。BOX-PCR采用通用引物BOX A1R[9],50 μL反应体系,扩增条件:94℃预变性5 min;94℃变性1 min,45℃退火1 min,72℃延伸1.5 min,35个循环;72℃延伸6 min。
1.3 茅苍术内生细菌促生潜力的分析
1.3.1 内生细菌固氮能力的测定
能够在Burk's无氮培养基上正常生长的内生细菌菌株具有固氮潜力[10]。提取具固氮潜力的内生细菌的总DNA,使用引物nifH-F和nifH-R[11]扩增其nifH基因,能够获得大小在450 bp左右条带的内生细菌含有nifH基因[12]。并对其16S rDNA片段进行扩增、测序,在Genbank中进行BLAST同源性比对后,获得相似菌株的序列,Clustal X多重比对后,使用Mega 5.0软件,采用Neighbor-Joining法构建系统发生树,对各固氮菌株的系统发生地位进行分析,Bootstrap 1000次检验各分支的置信值。
1.3.2 内生细菌解磷能力的测定
将内生细菌分别接种于National Botanical Research Institute Phosphate(NBRIP)培养基[13]和蒙金娜有机磷培养基[14]上后,通过观察是否有溶磷圈的形成来确定其是否具有溶解无机磷或有机磷的能力。进一步通过钼锑抗比色法定量测定细菌溶解无机磷或有机磷的能力[15],同时测定菌液的pH值。
钼锑抗比色法的具体步骤如下:将OD600调节一致的茅苍术内生细菌悬液1 mL接种于35 mL NBRIP液体培养基或蒙金娜有机磷液体培养基中。30℃,220 r/min培养7 d后8000 r/min离心10 min,取1 mL上清液于50 mL容量瓶中,加入钼锑抗混合显色剂5 mL后加水定容至刻度,静置30 min后,于660 nm测定吸光值。吸光值带入磷酸二氢钾标准曲线y=0.007x+0.026,R2=0.997即可计算得到发酵液中可溶性磷元素的含量[15]。每个样品3次重复。
1.3.3 内生细菌解钾能力的测定
内生细菌的解钾能力使用添加钾长石粉作为唯一钾源的硅酸盐培养基进行检测。将内生细菌分别接种于硅酸盐培养基上,于30℃培养10 d后观察,能够生长的菌株具有解钾潜力[16]。每个样品3次重复。
1.3.4 内生细菌产生长素能力的测定
将OD600调节一致的茅苍术内生细菌悬液1 mL接种于含5 mmol/L L-色氨酸的25 mL LB培养基中。220 r/min,30℃,避光培养48 h后,8000 r/min离心10 min,取1 mL上清液与2 mL Salkowski试剂混匀后于黑暗处室温温育30 min,使用分光光度计于530 nm处检测其吸光值,带入吲哚乙酸标准曲线计算出菌株48 h的生长素产生量[17]。每个样品3次重复。生长素标准曲线使用已知的吲哚乙酸浓度分别在0—60 μg/mL和60—300 μg/mL的标准溶液显色后在530 nm处的吸光值分别进行拟合[18]。生长素标准曲线分别为y=0.002x-0.001,R2=0.997(0—60 μg/mL)和 y=0.003x-0.079,R2=0.999(60—300 μg/mL)。
1.4 数据及图谱分析
使用Excel软件计算各菌株测定指标不同重复的平均值和标准差,并绘制图形。ARDRA和BOX-PCR指纹图谱分析使用GelcomparⅡ软件。系统发育树的构建使用Mega 5.0软件。
2 结果与分析
2.1 茅苍术内生细菌的分离
依据单菌落形态的差异,从茅苍术叶片中分离得到52株可培养内生细菌,其中7株在传代培养过程中停止生长,不纳入实验范围。对可正常传代培养的45株内生细菌分别编号为ALEB 1B、ALEB 2A、ALEB 2B、ALEB 3A、ALEB 3B、ALEB 4A、ALEB 5A、ALEB 5B、ALEB 6B、ALEB 7A、ALEB 7B、ALEB 8、ALEB 10、ALEB 11、ALEB 13—ALEB 15、ALEB 19—ALEB 22、ALEB 24—ALEB 47。
2.2 茅苍术内生细菌的多样性分析2.2.1 内生细菌的ARDRA分析
45株茅苍术内生细菌的限制性片段多态性图谱经UPGMA聚类分析后,以60%的相似度为标准划分为14个聚类簇(图1)。各聚类簇中代表菌株的16S rDNA全序列测定结果经Genbank同源性比对后,确定其可能的分类学地位(表1)。
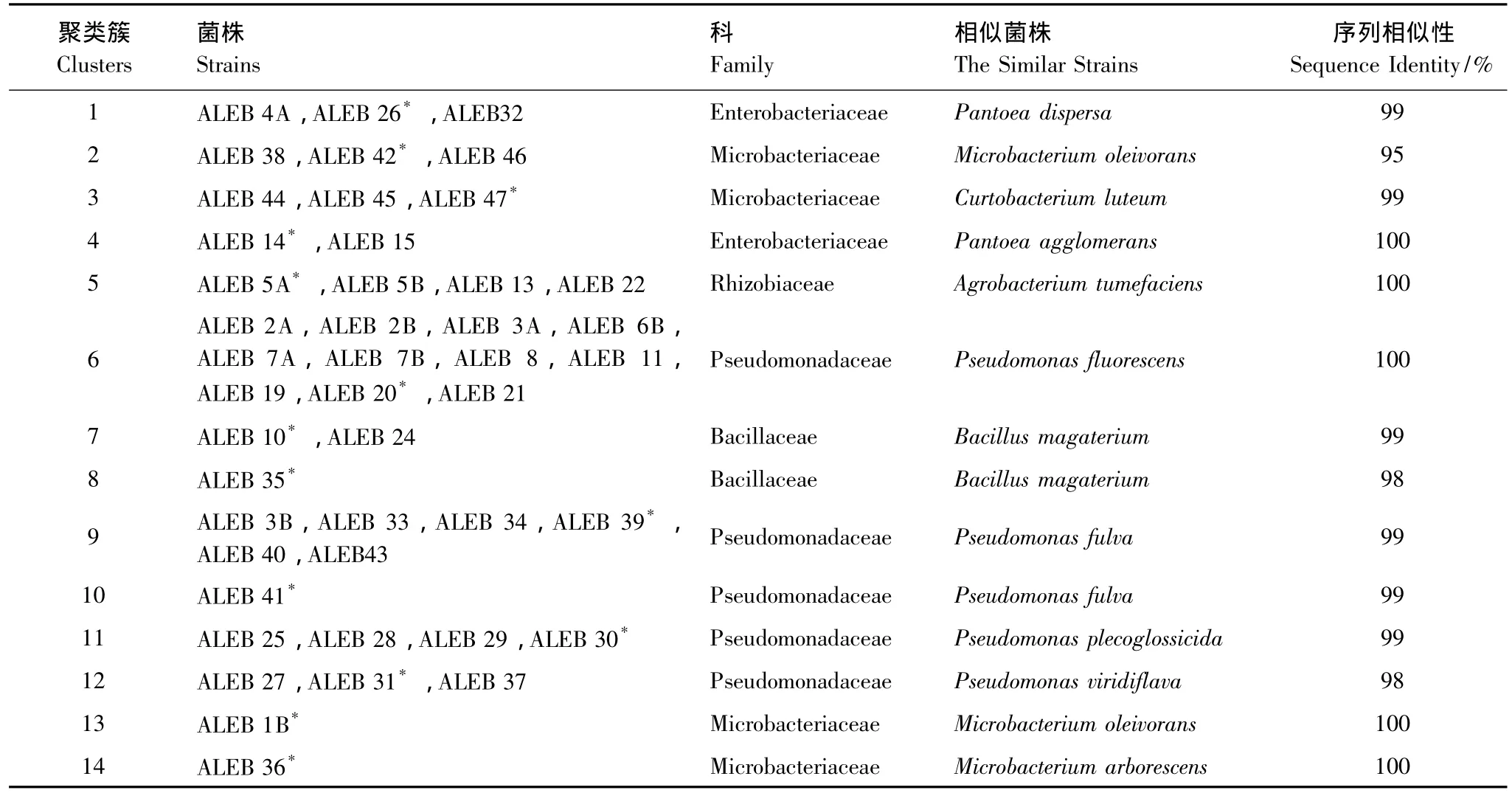
表1 茅苍术叶片可培养内生细菌ARDRA聚类簇Table 1 ARDRA clusters of the culturable endophytic bacteria from the leaves of Atractylodes lancea
2.2.2 主要ARDRA聚类簇内的BOX-PCR分析
在ARDRA聚类簇水平上使用BOX-PCR获得的指纹图谱对茅苍术内生细菌主要聚类簇6和9进行细分,并进行UPGMA聚类分析(图2)。聚类簇6中的11株内生细菌中亲缘关系最近的菌株ALEB 6B和ALEB 11及ALEB 7A和ALEB 7B的相似度为95%;聚类簇9中亲缘关系最近的菌株ALEB 40和ALEB 43的相似度为92%。说明相同茅苍术内生细菌ARDRA聚类簇中的菌株具有丰富的多样性,应属于同一属的不同种或同一种的不同菌株。BOX-PCR指纹图谱的分析结果也表明茅苍术体内蕴藏着丰富的内生细菌资源。
2.3 茅苍术内生细菌促生潜力的筛选
45株茅苍术内生细菌中有10株能够在Burk's无氮培养基上正常生长,表明其具有固氮潜力。分别有19株和15株内生细菌具有溶解无机磷和有机磷的能力。有24株茅苍术内生细菌能够在硅酸盐培养基上正常生长,具有解钾潜力。其中ALEB 5A、ALEB 13和ALEB 35同时具有固氮、溶解有机磷和解钾的能力,ALEB 14和ALEB 47同时具有固氮、溶解无机磷和解钾的能力,ALEB 11、ALEB 27、ALEB 29和ALEB 37同时具有溶解无机磷和有机磷的能力,但并没有发现同时具有固氮、溶解无机磷和有机磷、解钾和产生长素能力的内生细菌菌株。

图1 茅苍术内生细菌限制性内切酶酶切指纹图谱聚类分析Fig.1 Fingerprints and dendrogram of 45 endophytic bacteria based on ARDRA
45株茅苍术内生细菌中有43株具有生长素产生能力,其中ALEB 44产生长素的能力最强,在30℃,220 r/min培养48 h后的生长素产生量达到(268.44±10.12)μg/mL。有25株内生细菌的生长素产生量高于 100 μg/mL。
2.4 茅苍术内生固氮细菌nifH基因的扩增与16S r DNA的序列测定
2.4.1 茅苍术内生固氮细菌nifH基因的扩增
对茅苍术内生固氮细菌的nifH基因片段进行扩增后,ALEB 5A、ALEB 5B、ALEB 13、ALEB 14、ALEB 26、ALEB 35、ALEB 39、ALEB41和ALEB 47能够获得大小在450 bp左右的目的条带,表明这9株内生细菌中含有nifH基因[11]。而ALEB 33在450 bp处并没有条带,其可能通过其它途径获得生长所需的氮元素。结合ARDRA聚类分析的结果,有近1/2的聚类簇中包含有具固氮潜力的茅苍术内生细菌,其中ALEB 26属于聚类簇1,ALEB 47属于聚类簇3,ALEB 14属于聚类簇4,ALEB 5A、ALEB 5B和ALEB 13属于聚类簇5,ALEB 35属于聚类簇8,ALEB 33和ALEB 39属于聚类簇9,ALEB 41属于聚类簇10。

图2 聚类簇6和聚类簇9中内生细菌BOX-PCR指纹图谱聚类分析Fig.2 Fingerprints and dendrogram of endophytic bacteria from ARDRA cluster 6 and 9 based on BOX-PCR

表2 茅苍术内生细菌促生潜力的筛选Table 2 Plant growth-promoting potential of endophytic bacteria

续表
2.4.2 茅苍术内生固氮细菌16S rDNA序列的测定及系统发育树的构建
以10株具固氮潜力的茅苍术内生细菌16S rDNA基因为基础构建的系统发育树(图4)表明ALEB 5A、ALEB 5B和ALEB 13与土壤杆菌属的典型菌株聚在相同位置,ALEB 14和ALEB 26与泛菌属的典型菌株聚在相同位置,ALEB 33、ALEB 39和ALEB 41与假单胞菌属的典型菌株聚在相同位置,ALEB 35与芽孢杆菌属的典型菌株聚在相同位置,ALEB 47与短小杆菌属的典型菌株聚在相同位置。
2.5 茅苍术内生细菌溶解无机磷的定量检测及细菌发酵液pH值的测定
结合菌液中可溶性磷元素的含量和pH值进行分析(图5)。ALEB 43发酵液中可溶性磷元素的含量最高,达(251.43±4.16)mg/L,并且其 pH 值(pH=4.16)与不接菌的培养基(pH=6.90)相比明显下降。ALEB 3A、ALEB 7A、ALEB 7B、ALEB 21、ALEB 29和ALEB 47发酵液中可溶性磷元素的含量均大于100 mg/L,并且其发酵液的pH值均低于5.00。但ALEB 14和ALEB 20发酵液的pH值分别为4.62和4.53,其发酵液中可溶性磷元素的含量却较低,仅为(46.67±6.55)mg/L 和(60.95±21.33)mg/L。而 ALEB 2A、ALEB 31 和ALEB 34的溶磷量均超过了150 mg/L,但其发酵液的pH值却均高于6.00。
2.6 茅苍术内生细菌溶解有机磷的定量检测及细菌发酵液pH值的测定
茅苍术内生细菌中具溶解有机磷能力的菌株数要低于具溶解无机磷能力的菌株数,并且磷元素的释放量也较低,2/3解有机磷菌株的磷元素释放量低于5 mg/L。ALEB 4A溶解有机磷的能力最强,磷元素释放量为(23.63±1.46)mg/L。同时测定菌液的 pH 值(图6)。
3 讨论
3.1 茅苍术内生细菌多样性
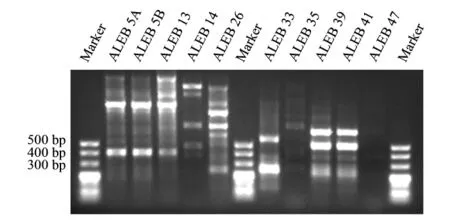
图3 茅苍术内生固氮细菌nifH基因的扩增Fig.3 Amplification of nifH genes from nitrogen-fixing endophytic bacteria

图4 茅苍术内生固氮细菌16S rDNA系统发育树Fig.4 Phylogenetic dendrogram of the nitrogen-fixing endophytic bacteria from Atractylodes lancea based on the 16S rDNA fragments
本课题组的前期研究已经证明茅苍术体内存在丰富的内生真菌资源,并且其对茅苍术的生长和道地性的形成产生了很大影响。本研究通过ARDRA和BOXPCR相结合的方法揭示了茅苍术内生细菌的多样性。ARDRA是一种简单而可靠的细菌分类方法[19],能够在16S rDNA片段的基础上估计分离物中存在的最低限度的细菌种类数目[20]。许多研究者将ARDRA应用于不同来源细菌的初步分类与鉴定[8,21]。本研究中的14个ARDRA聚类簇代表菌株的16S rDNA序列测定结果表明分离得到的茅苍术内生细菌与泛菌属、微杆菌属、短杆菌属、农杆菌属、假单胞菌属、芽孢杆菌属细菌亲缘关系相近,其中茅苍术叶片优势内生细菌与假单胞菌属细菌亲缘关系相近。这些属的细菌均已被报道作为内生细菌存在于不同植物体内,其中一些还具有植物促生能力[22-25]。与ARDRA相比,使用BOX-PCR获得的指纹图谱能够区分亲缘关系更近的细菌菌株[26],因此利用BOX-PCR对茅苍术内生细菌主要ARDRA聚类簇6和9中的菌株进行分析。BOX-PCR指纹图谱聚类分析结果表明,主要ARDRA聚类簇中的内生细菌菌株也具有丰富的多样性。
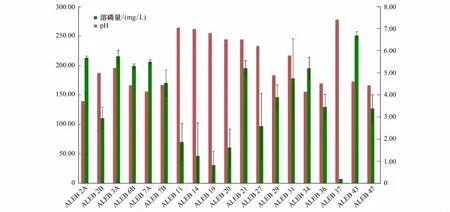
图5 茅苍术内生细菌无机磷溶解量与发酵液pH值Fig.5 The amountofdissociative phosphorusreleased by inorganic phosphate solubilizing bacteria and the pH oftheir fermentation solutions

图6 茅苍术内生细菌有机磷溶解量与发酵液pH值Fig.6 The amount of dissociative phosphorus released by organic phosphate solubilizing bacteria and the pH of their fermentation solutions
3.2 茅苍术内生细菌的促生潜力
氮、磷、钾是植物生长发育过程中不可缺少的重要营养元素。在作物生长过程中常需要人工施加氮、磷、钾等肥料以满足作物对养分的需求。本研究获得了多株具有固氮、溶解无机磷或有机磷、解钾和产生长素能力的内生细菌。如果这些具有多种促生潜力的内生细菌菌株能够与茅苍术建立良好的共生关系,那么它们能够为宿主植物提供更多可被利用的氮、磷、钾元素和植物激素,这必然会对茅苍术药材的产量和品质产生有益影响。但本实验中并没有发现同时具有固氮、溶解无机磷和有机磷、解钾和产生长素能力的内生细菌菌株,因此在生产实践中可以将不同茅苍术内生细菌组合使用,使它们协同发挥促生功能,从一定程度上解决茅苍术栽培过程中土壤营养元素失衡的问题,增加苍术药材的产量和品质[27]。
依据16S rDNA序列测定结果构建的系统发育树,茅苍术内生固氮细菌分别与土壤杆菌属、泛菌属、假单胞菌属、芽孢杆菌属和短小杆菌属的典型菌株聚为一类,应属于这些属的不同种或同一种的不同菌株,而这些属的细菌均已被报道具有固氮能力[24,28-29]。但不同无氮培养基间存在一定的差异,使用某一种无氮培养基进行固氮细菌的筛选不能够得到所有具固氮潜力的细菌,茅苍术体内应该还存在有其他种属的固氮细菌有待于进一步的发现与研究。
ARDRA聚类簇6中的9个菌株均具有溶解无机磷的能力,并且其溶磷量与产酸能力呈正相关。因此,推测部分茅苍术内生细菌通过分泌一些酸性物质来溶解磷酸钙,释放难溶性的磷元素。但有些内生细菌溶解无机磷的量很高,同时其菌液的pH值也较高。说明分泌酸性物质并不是内生细菌溶解磷酸盐的唯一途径,这些菌株可能通过分泌胞外磷酸酶来释放磷元素,并且不同的作用途径间可能存在协同。除ALEB 14和ALEB 47外,其他具溶解无机磷能力的菌株都与假单胞菌属菌株近缘,这与之前研究报道的假单胞菌属细菌溶解无机磷的能力相符[30]。具有机磷溶解能力的内生细菌菌株ALEB 10和ALEB 35经16S rDNA序列测定、比对,与巨大芽孢杆菌的相似度分别为99%和98%。巨大芽孢杆菌为已知的解磷菌种,并已经作为微生物菌剂广泛使用[31]。细菌发酵液pH值的测定结果表明,内生细菌溶解有机磷的能力与其产酸能力无相关性。因此推测茅苍术内生细菌通过分泌胞外磷酸酶来溶解卵磷脂,释放磷元素。植物促生细菌在植物体外,通过释放土壤中不溶性的磷元素,促进植物生长和次级代谢物积累的能力已有报道[32-33]。而植物内生细菌很可能来源于土壤,通过植物根部的自然孔洞或伤口侵入植物体内,成为植物体微生态体系的一部分,因此,可以利用内生细菌在植物根际土壤中的定殖来改善植物的磷素营养[34]。而具有解钾潜力的内生细菌几乎分布于各ARDRA聚类簇,不具有种属差异。
大多数茅苍术内生细菌能够将培养基中的L-色氨酸转化为IAA,并将其分泌至体外。虽然培养时间以及色氨酸含量可能对细菌的生长素产生量存在一定影响,但从本实验获得的结果可以看出很大一部分茅苍术内生细菌具有较强的IAA产生能力,并且部分菌株产生长素的能力要大于一些实验者分离得到的其他来源的细菌菌株[17]。虽然本实验未对茅苍术植株体内色氨酸的含量进行测定,但其作为植物合成IAA的前体物质,应当在菊科高等植物茅苍术中也广泛存在。因此,作者推测内生细菌在与茅苍术建立共生后,可以利用植物体内游离的色氨酸合成IAA,供宿主植物使用。
综上所述,本研究首次探究了江苏省道地药材茅苍术叶片内可培养内生细菌的多样性,并研究了其固氮、解磷、解钾和产生长素的促生潜力。初步揭示了内生细菌与茅苍术之间的相互关系,为进一步将内生细菌回接茅苍术植株,研究其对茅苍术药材产量和道地性形成的影响提供了重要依据。
[1] Guo L P,Huang L Q,Yan H,Lv D M,Jiang Y X.Habitat characteristics for the growth of Atractylodes lancea based on GIS.China Journal of Chinese Materia Medica,2005,30(8):565-569.
[2] Gu Y H,Feng X,Xia B.Dynamic change of essential oil content and increment in different organs of Atractylodes lancea.Journal of Plant Resources and Environment,2007,16(4):24-28.
[3] Wang Y,Dai C C,Cao J J,Xu D S.Comparison of the effects of fungal endophyte Gilmaniella sp.and its elicitor on Atractylodes lancea plantlets.World Journal of Microbiology and Biotechnology,2012,28:575-584.
[4] Chen J X,Dai C C,Li X,Tian L S,Xie H.Endophytic fungi screening from Atractylodes lancea and inoculating into the host plantlet.Guihaia,2008,28(2):256-260.
[5] Loaces L,Ferrando L,Scavino A F.Dynamics,diversity and function of endophytic siderophore-producing bacteria in rice.Microbial Ecology,2011,61:606-618.
[6] Fernández A,Huang S Y,Seston S,Xing J,Hickey R,Criddle C,Tiedje J.How stable is stable?Function versus community composition.Applied and Environmental Microbiology,1999,65(8):3697-3704.
[7] Lu J K,Chen J,Kang L H,Yang Z D.Analysis of the 16S rDNA PCR-RFLP and the phosphate-dissolving capacity of phosphate-dissolving bacteria isolated from rhizosphere of mangrove in southern china.Scientia Silvae Sinicae,2009,45(5):137-142.
[8] Yang J H,Liu H X,Zhu GM,Pan Y L,Xu L P,Guo J H.Diversity analysis of antagonists from rice-associated bacteria and their application in biocontrol of rice diseases.Journal of Applied Microbiology,2008,104:91-104.
[9] Carlos C,Alexandrino F,Stoppe N C,Sato M I Z,Ottoboni L M M.Use of Escherichia coli BOX-PCR fingerprints to identify sources of fecal contamination of water bodies in the State of Sao Paulo,Brazil.Journal of Environmental Management,2012,93:38-43.
[10] Park M,Kim C,Yang J,Lee H,Shin W,Kim S,Sa T.Isolation and characterization of diazotrophic growth promoting bacteria from rhizosphere of agricultural crops of Korea.Microbiological Research,2005,160:127-133.
[11] Rosch C,Mergel A,Bothe H.Biodiversity of denitrifying and dinitrogen-fixing bacteria in an acid forest soil.Applied and Environmental Microbiology,2002,68(8):3818-3829.
[12] Li Z D,Chen X R,Li P,Man B Y,Wang C Y,Zou Y K,Xu C L.Identification of endogenous nitrogen-fixing bacteria of Polygonum viviparum and analysis on nitrogen fixation gene(nifH).Acta Agrestia Sinica,2009,17(5):552-557.
[13] Dastager S G,Deepa1 C K,Pandey A.Plant growth promoting potential of Pontibacter niistensis in cowpea(Vigna unguiculata(L.)Walp.).Applied Soil Ecology,2011,49:250-255.
[14] Tian H,Li F X,Zhang D G,Yao T.Primary research on isolation and ability of phosphorus-solubilizing of turf phosphorus-solubilizing bacteria.Pratacultural Science,2005,22(10):92-96.
[15] Lin X G.Principles and methods of soil microbiology research.Beijing:Higher Education Press,2010:236-238.
[16] Yang L,Tang W Q,Jiang Y,Duan Y P.Isolation,identification of a potassium-solubilizing bacteria and analysis of the metabolites.Journal of Anhui Agricultural Science,2011,39(28):17265-17267.
[17] Martínez O A,Jorquera M A,Crowley D E,Mora M L.Influence of nitrogen fertilisation on pasture culturable rhizobacteria occurrence and the role of environmental factors on their potential PGPR activities.Biology and Fertility of Soil,2011,47:875-885.
[18] Mishra A,Chauhan P S,Chaudhry V,Tripathi M,Nautiyal C S.Rhizosphere competent Pantoea agglomerans enhances maize(Zea mays)and chickpea(Cicer arietinum L.)growth,without altering the rhizosphere functional diversity.Antonie van Leeuwenhoek,2011,100:405-413.
[19] Ponnusamy K,Jose S,Savarimuthu I,Michael G P,Redenbach.Genetic diversity study of Chromobacterium violaceum isolated from Kolli hills by amplied ribosomal DNA restriction analysis(ARDRA)and random amplified polymorphic DNA(RAPD).Letters in Applied Microbiology,2011,53:341-349.
[20] Dunbar J,White S,Forney L.Genetic diversity through the looking glass:effect of enrichment bias.Applied and Environmental Microbiology,1997,63:1326-1331.
[21] Sun L,Qiu F B,Zhang X X,Dai X,Dong X Z,Song W.Endophytic bacterial diversity in rice(Oryza sativa L.)roots estimated by 16S rDNA sequence analysis.Microbial Ecology,2008,55:415-424.
[22] Ferrara F S,Oliveira Z M,Gonzales H H S,Floh E S,Barbosa H R.Endophytic and rhizospheric enterobacteria isolated from sugar cane have different potentials for producing plant growth-promoting substances.Plant and Soil,2012,353:409-417.
[23] Ulrich K,Ulrich A,Ewald D.Diversity of endophytic bacterial communities in poplar grown under field conditions.FEMS Microbiology Ecology,2008,63(2):169-180.
[24] Taule C,Mareque C,Barlocco C.The contribution of nitrogen fixation tosugarcane(Saccharum officinarum L.),and the identification and characterization of part of the associated diazophic bacterial community.Plant and Soil,2012,356:35-49.
[25] Bacon C W,Hinton D M.Endophytic and biological control potential of Bacillus mojavensis and related species.Biological Control,2002,23(3):274-284.
[26] Binde D R,Menna P,Bangel E V,Barcellos F G,Hungria M.rep-PCR fingerprinting and taxonomy based on the sequencing of the 16S rRNA gene of 54 elite commercial rhizobial strains.Applied Microbiology and Biotechnology,2009,83:897-908.
[27] Guo L P,Huang L Q,Jiang Y X,Lv D M.Soil deterioration during cultivation of medicinal plants and ways to prevent it.China Journal of Chinese Materia Medica,2006,31(9):714-717.
[28] Karagoz K,Ates F,Karagoz H.Characterization of plant growth-promoting traits of bacteria isolated from the rhizosphere of grapevine grown in alkaline acidic soils.European Journal of Soil Biology,2012,50:144-150.
[29] Lin L,Guo W,Xing Y X.The actinobacterium Microbacterium sp.16SH accepts pBBR1-based pPROBE vectors,forms biofilms,invades roots,and fixes N2associated with micropropagated sugarcane plants.Applied Microbiology and Biotechnology,2012,93(3):1185-1195.
[30] Srinivasan R,Alagawadi A R,Yandigeri M.Characterization of phosphate-solubilizing microorganisms from salt-affected soils of India and their effect on growth of sorghum plants[Sorghum bicolor(L.)Moench].Annals of Microbiology,62(1):93-105.
[31] Gyaneshwar P,Naresh K G,Parekh L J,Poole P S.Role of soil microorganisms in improving P nutrition of plants.Plant and Soil,2002,245(1):83-93.
[32] Rana A,Saharan B,Joshi M,Prasanna R,Kumar K,Nain L.Identification of multi-trait PGPR isolates and evaluating their potential as inoculants for wheat.Annals of Microbiology,2011,61:893-900.
[33] Arun P,Sanjay K,Ankit P,Sukhmal C.Microbial and chemical sources of phosphorus supply modulate the yield and chemical composition of essential oil of rose-scented geranium(Pelargonium species)in sodic soil.Biology and Fertility of Soils,2012,48:117-122.
[34] Huang J,Sheng X F,He L Y.Biodiversity of phosphate-dissolving and plant growth-promoting endophytic bacteria of two crops.Acta Microbiologica Sinica,2010,50(6):710-716.
参考文献:
[1] 郭兰萍,黄璐琦,阎洪,吕冬梅,蒋有绪.基于地理信息系统的苍术道地药材气候生态特征研究.中国中药杂志,2005,30(8):565-569.
[2] 顾永华,冯煦,夏冰.茅苍术不同器官挥发油含量及其生长量的动态变化.植物资源与环境学报,2007,16(4):24-28.
[4] 陈佳昕,戴传超,李霞,田林双,谢慧.茅苍术内生真菌的分离鉴定及在组培苗中的回接.广西植物,2008,28(2):256-260.
[7] 陆俊锟,陈俊,康丽华,杨振德.华南红树林溶磷菌16S rDNA PCR-RFLP分析及其溶磷能力.林业科学,2009,45(5):137-142.
[12] 李振东,陈秀容,李鹏,满百膺,王辰月,邹雨坤,徐长林.珠芽蓼内生固氮菌鉴定及其固氮基因分析.草地学报,2009,17(5):552-557.
[14] 田宏,李凤霞,张德罡,姚拓.草坪草溶磷菌及溶磷能力的初步研究.草业科学,2005,22(10):92-96.
[15] 林先贵.土壤微生物研究原理与方法.北京:高等教育出版社,2010:236-238.
[16] 杨柳,唐旺全,蒋艳,段月鹏.解钾芽孢杆菌的分离·鉴定及其代谢产物分析.江苏农业科学,2011,39(28):17265-17267.
[27] 郭兰萍,黄璐琦,蒋有绪,吕冬梅.药用植物栽培种植中的土壤环境恶化及防治措施.中国中药杂志,2006,31(9):714-717.
[34] 黄静,盛下放,何琳燕.具溶磷能力的植物内生促生细菌的分离筛选及其生物多样性.微生物学报,2010,50(6):710-716.
