亚热带养殖海湾皱瘤海鞘生物沉积的现场研究
2013-12-19闫家国齐占会田梓杨史荣君张汉华黄洪辉
闫家国,齐占会,田梓杨,史荣君,张汉华,黄洪辉,*
(1.农业部南海渔业资源开发利用重点实验室,广东省渔业生态环境重点实验室,中国水产科学研究院南海水产研究所,广州 510300;2.上海海洋大学水产与生命学院,上海 201306)
海鞘(Ascidian)是脊索动物(Chordata)、尾索动物亚门(Urochordata)、海鞘纲(Ascidiacea)的尾索动物,是世界上广泛分布的附着生物。海鞘具有很强的适应能力,能够在码头、礁石、船底和养殖设施(如绳索、浮球和网箱等)以及养殖生物体(如牡蛎,贻贝和扇贝等的贝壳)上附着[1],因而在养殖区的数量巨大,其数量甚至会超过贝类等养殖生物[2]。
与牡蛎和扇贝等贝类相似,海鞘也属于滤食性生物,并具有很强的滤水能力,能够滤食海水中的悬浮颗粒物质(如浮游动植物和其它有机碎屑),其中一部分被同化吸收,其它则以粪和假粪的形式排出。滤食性生物的粪和假粪统称为生物沉积物,而其从水层沉降到底层的过程即为生物沉积。贝类的生物沉积及其影响因素已有很多研究。滤食性贝类的生物沉积过程加速了水体中颗粒物向底层的沉降速率,对近海养殖区的底部的物理、化学和生物环境均产生了重要影响,是贝类养殖环境自身污染的重要原因[3-6]。
近年来,浅海筏式养殖发展迅速,贝类成为养殖规模和产量最大的品种。贝类筏式养殖设施、养殖笼和贝壳等为海鞘等附着生物提供了大量理想的附着基,使其数量大大增加。研究显示,附着生物群落的生物沉积速率甚至超过了牡蛎(Crassostrea virginica)的生物沉积速率[7]。考虑到附着生物的巨大数量,其生物沉积过程很可能对养殖海域生态环境产生很大影响。因此,研究贝类筏式养殖对海湾生态系统影响,不能忽视海鞘等附着生物的作用。
皱瘤海鞘(Styela plicata)是亚热带海域分布最广和数量最多的附着生物种类之一,尤其在贝类筏式养殖区有大量附着。目前,对于皱瘤海鞘研究主要集中在生物活性物质提取和组织发育等方面的研究[8-10]。关于皱瘤海鞘生物沉积的研究还未见报道。本文对皱瘤海鞘生物沉积进行了现场测定,旨在为评价近岸筏式养殖对浅海生态环境的影响等研究提供基础数据。
1 材料和方法
1.1 实验地点
本研究于2012年1—7月在广东省大亚湾大鹏澳牡蛎筏式养殖海区进行(E 114°31',N 22°33')。大鹏澳是位于广东中部沿海大亚湾西南部的一个半封闭式的浅海内湾,面积约为l4 km2,湾内平均水深约为5 m,海水交换能力较弱,主要潮流方向为西南次向东北方向,流速<10 cm/s。湾内主要开展鱼类网箱养殖和牡蛎筏式养殖。牡蛎筏式养殖的吊养水深约为0.5 m,养殖密度约为200个/m2,目前养殖总面积103 hm2,并且正在不断扩大。
1.2 实验方法
海鞘生物沉积速率利用自制的沉积物捕集器在养殖海区进行现场测定。沉积物捕集器利用PVC圆柱桶制作(图1)。PVC圆桶直径25 cm,高度为60 cm。在距桶底部20 cm的桶壁上开一个直径1 cm的圆孔用橡胶塞堵住。实验结束时拔出橡胶塞,放掉桶内上浮海水。在距圆桶口部5 cm的地方固定一层网目1 cm的聚乙烯网片,实验海鞘放在该网片上,圆桶口部以同样的网片遮盖。从筏架和牡蛎贝体表面采集海鞘(体高1.4—6.3 cm,平均 3.14 cm),小心除去海鞘上所有附着生物。根据规格大小,每捕集器放海鞘4—8个。对照组捕集器不放置海鞘。每组实验设3个重复。
捕集器固定在在离牡蛎养殖区较远的空旷的筏架上。捕集器在水中放置5—7 d后取出海鞘,排掉上浮海水收集沉积物,用蒸馏水脱盐并在60℃下烘干。称量沉积物干重,并测定有机质(OM)、总碳(TC)、总氮(TN)含量。沉积物用稀盐酸(0.1 mol/L)酸化去碳酸盐后,测定有机碳(OC)、有机氮(ON)含量[11]。OM通过灰化前后的重量差计算(450℃,4.5 h)。碳、氮含量采用Vario ELⅢElementar元素分析仪测定。对每个捕集器中的海鞘,分别测量体高、湿重和干重(60℃,2 d)。实验期间测定水温、盐度和悬浮颗粒物(TPM)、颗粒有机物(POM)和叶绿素a(Chla)浓度。水温和盐度采用YSI 6600测定。TPM、POM和Chla采用2006年Mao 等的方法[12]。
实验期间对牡蛎筏式养殖区的海鞘密度进行统计。随机选取单位面积的吊绳和浮筏,统计贝壳、吊绳和浮筏上海鞘的数量。实验海域牡蛎在筏架上的吊养间距约0.3 m,筏间距2.5 m,每串牡蛎所占面积为0.75 m2,以此计算筏式养殖区海鞘附着密度(个/m2),并结合海鞘生物沉积速率实验结果,计算养殖区皱瘤海鞘生物沉积速率,即每天每平方米沉积量(g/m2)。
1.3 数据处理
生物沉积速率(BDR)=(Dt-Dc)/t×N( ),式中Dt和Dc分别为实验组和对照组捕集器中的沉积物干重(mg);t为实验时间(d);N为实验海鞘数量(个)。
差异性分析采用单因素方差分析(one-way ANOVA)和t检验(t-test)分析方法,显著差异设为p<0.05,数理统计采用采用SPSS 16.0软件进行统计分析。

图1 皱瘤海鞘生物沉积物捕集器Fig.1 Biodeposition trap of Styela plicata
2 结果与分析
2.1 实验海区水体环境变化
实验海区水环境特征见表1。实验期间海水水温逐渐升高,变化范围为17.7—31.5℃;海水盐度变化不大,为29.58—31.96;TPM含量在18.40—48.77 mg/L范围内,最高和最低值分别出现在4月和5月。POM浓度为 3.00—20.18 mg/L;叶绿素 a 含量为 2.41—9.69 μg/L,随水温升高而呈升高的趋势。
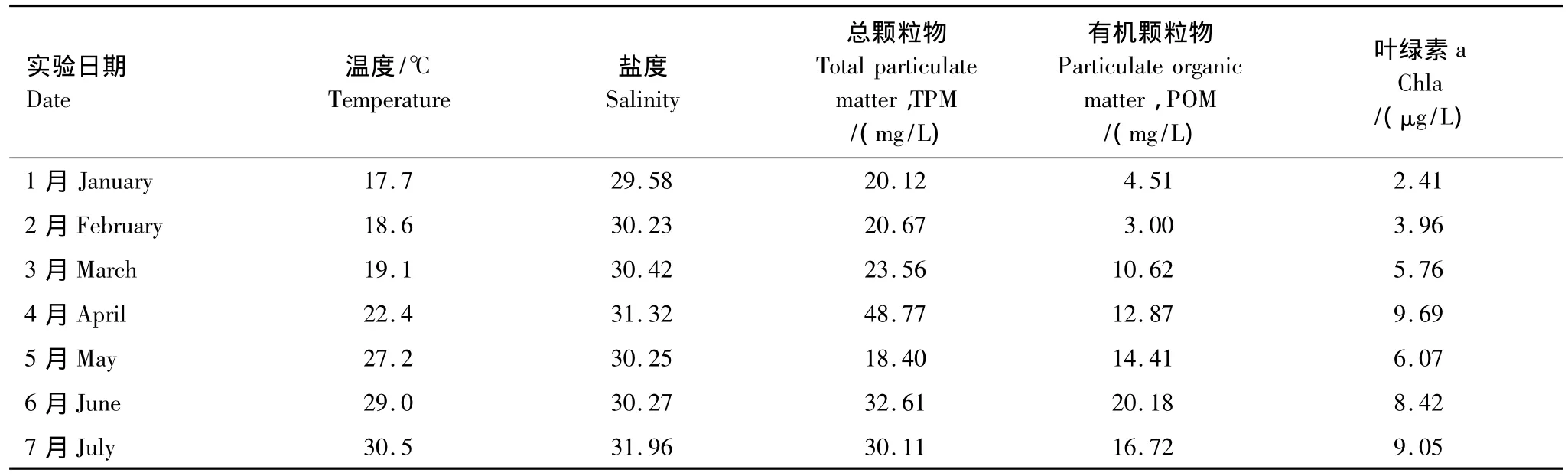
表1 实验海区水环境特征Table 1 Water column characteristics at experimental site in Dapeng Cove
2.2 皱瘤海鞘生物沉积速率
皱瘤海鞘的生物沉积速率现场测定结果见表2。实验期间,皱瘤海鞘的生物沉积速率范围为每天145.5—1011.8 mg/个,平均每天 516.0 mg/个,生物沉积速率为每天 154.8—1065.8 mg/g干重,平均每天463.3 mg/g干重。皱瘤海鞘生物沉积速率和自然沉积速率的最低和最高值均分别出现在1月和7月,除4月生物沉积速率较低外,海鞘生物沉积速率总体上呈逐渐升高的趋势。
实验期间附着在浮筏养殖设施和养殖牡蛎壳上的海鞘密度变化范围为54.9—222.1个/m2,平均147.5个/m2。单位面积海鞘生物沉积速率随季节波动较大,最低和最高值分别出现在1月和5月,沉积速率分别为每天85.4和1393.9 g/m2。实验期间单位面积海鞘生物沉积速率(平均每天76.1 g/m2)是自然沉降速率(平均每天62.7 g/m2)的 1.21 倍。
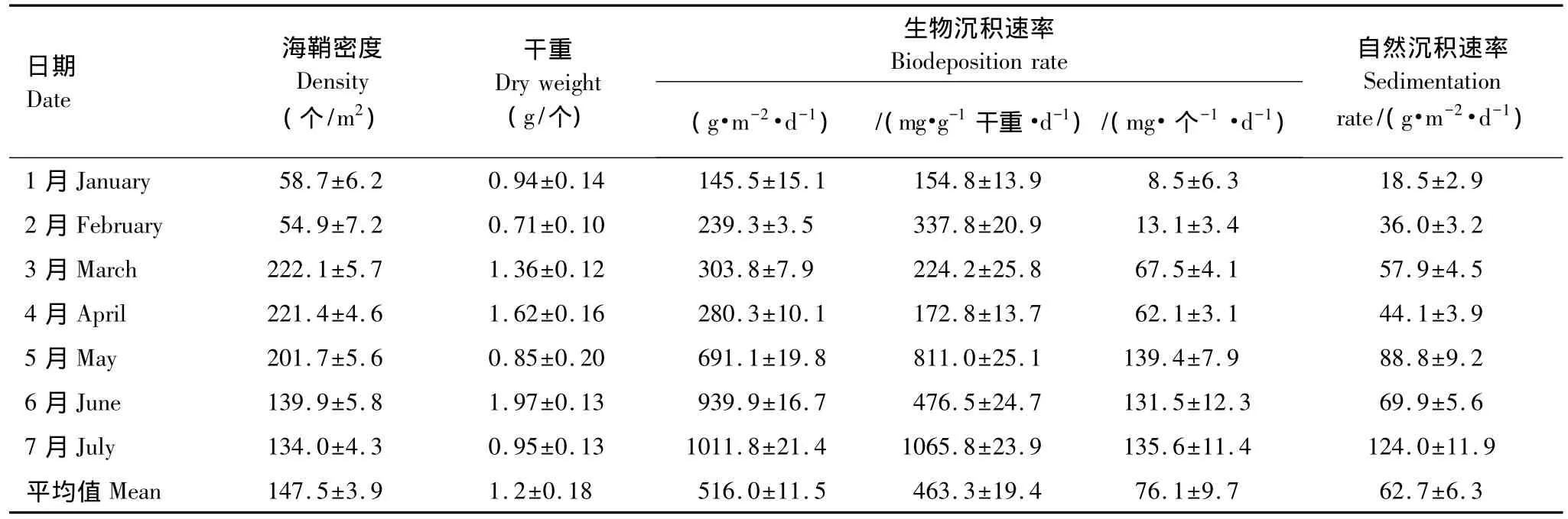
表2 大鹏澳养殖海区海鞘生物沉积速率(平均值±标准差)Table 2 Biodeposition rate of Styela plicata at experimental site in Dapeng Cove(mean±SD)
2.3 皱瘤海鞘生物沉积物和自然沉积物中OM、C和N含量
皱瘤海鞘生物沉积物和自然沉积物中的OM、C和N元素含量测定结果见表3。结果显示:皱瘤海鞘生物沉积物中OM、C和N含量高于自然沉积物含量,生物沉积物中TC和ON含量显著高于自然沉积物(P<0.05)。皱瘤海鞘生物沉积物中的OM、TN和OC含量以及OC/OM和OC/ON高于自然沉积物,但差异不显著(P>0.05)。研究说明皱瘤海鞘生物沉积作用加速了有机质由水体向沉积环境的沉降速度,同时增加C、N元素在沉积物中的含量。

表3 生物沉积物与自然沉积物中有机质、C和N含量Table 3 OM,C and N contents in biodeposits and natural sediment
3 讨论
本研究结果显示,皱瘤海鞘的生物沉积速率平均为每天516.0 mg/个,高于玻璃海鞘(Ciona intestinalis)(32.14 mg/个)和柄海鞘(Styela clava)(121.1 mg/个)的生物沉积速率。但皱瘤海鞘的生物沉积速率(每天463.3 mg/g干重)却低于Qi等研究的玻璃海鞘(每天658.99 mg/g干重)和柄海鞘(每天467.76 mg/g干重)[13]。这可能是因为皱瘤海鞘虽然个体较大,但其无生物活性的被囊(tunic)在总干重中比例相对较大,因此生物沉积速率较小。
贝类生物沉积速率的研究发现个体大小是影响生物沉积速率的重要因素[14-17]。本研究中体长1.4—3.0 cm的皱瘤海鞘生物沉积速率为每天145.5—239.3 mg/个,体长3.2—4.2 cm的皱瘤海鞘生物沉积速率为每天 303.8—691.1 mg/个,而体长为 4.8—6.3 cm 的皱瘤海鞘生物沉积速率为每天 939.9—1011.8 mg/个。这与贝类生物沉积速率与体长大小相关的规律一致。
本研究中皱瘤海鞘的生物沉积速率高于大小相近的长牡蛎(Crassostrea gigas)(每天26.3—69.9 mg/个)[14]、厚壳贻贝(Mytilus crassitesta)(每天 42.3—77.9 mg/个)[15]和栉孔扇贝(Chlamys farreri)(每天72.31—109.85mg/个)[16]的生物沉积速率,但低于周毅等[17]在桑沟湾现场测定的栉孔扇贝(壳长 4.10—6.74 cm)的沉积速率(每天520—6420 mg/个)。这可能与物种、实验方法以及实验海区不同有关。
本研究发现,在一定范围内,皱瘤海鞘的生物沉积速率随水温升高而呈升高的趋势,这与贝类生物沉积研究结果相一致[18-19]。有研究表明,在一定范围内生物沉积速率与水体中颗粒物浓度呈正相关[18-19]。但本实验中,4月水体TPM和POM浓度均较高,而海鞘的生物沉积速率却相对较低,分析原因可能是因为(1)滤食性生物的滤水率与饵料浓度有关,一定范围内滤水率和生物沉积速率随饵料浓度的升高而升高[20]。但是,当饵料浓度高于一定程度时,生物沉积速率并不随饵料浓度的增加而呈正比的增高[21-22],这与其滤水率随着饵料浓度的增加而降低的现象是一致的[23]。(2)4月份前后是海鞘繁殖季节[24],海鞘生理活动主要以生殖为主,其它生理活动减弱。1980年Tsuchiya观察到贻贝(Mytilus edulis)在排卵时几乎不产生生物沉积物,但产卵后恢复正常[22]。
本研究表明海鞘生物沉积物中OM、C和N的含量均高于自然沉积物中的含量,说明海鞘生物沉积作用加速了OM和C、N元素的沉降。Lee等[25]研究也发现真海鞘(Halocynthia roretzi)养殖区沉积物中OC和ON的含量要明显高于对照区。根据本研究中海鞘密度和沉积速率及元素含量的研究结果(表2,表3),皱瘤海鞘对 OM、TC、OC、TN 和 ON 的平均沉积速率分别为每天 74.20,55.73,14.80,15.79 和 4.43 mg/个。单位面积海鞘的平均生物沉积速率为每天76.1 g/m2,OM、TC、OC、TN和ON的平均沉积速率分别为每天10.94,8.21,2.18,2.32和0.65 g/m2。据此推算出大亚湾大鹏澳筏式养殖区的海鞘一年产生的生物沉积物、OM、TC、OC、TN 和 ON 分别为29000,4100,3100,820,870 和240 t。
大量的生物沉积物增加了养殖区底部的有机质,为底栖生物和微生物提供了营养,生物扰动作用增强,提高了营养元素的通量[26-28],并且降低了水体中悬浮颗粒物浓度,因此增加了水体透明度和光的通透性,促进底栖植物的生长[28-30]。但是,大量的沉积物堆积于海底,会导致沉积环境耗氧速率增强[25,31],严重时出现底部缺氧现象,对底栖生物产生严重的影响[6,32-34]。但是,滤食性生物的生物沉积作用对海区沉积物矿化速率和元素界面交换通量的影响,受到水深、水交换速率和水动力以及沉积物粒径等自然环境特征的综合影响[35]。本研究中的大鹏澳养殖区水深较浅,平均约为5 m,且湾口相对较窄,皱瘤海鞘和牡蛎等滤食性生物的生物沉积作用,对沉积环境中沉积物耗氧速率和海水-沉积物界面间物质通量产生了怎样的影响,需要深入研究。
[1] da Costa K G,Nalesso R C.Effects of mussel farming on macrobenthic community structure in Southeastern Brazil.Aquaculture,2006,258(1/4):655-663.
[2] Qi Z H,Fang J G,Zhang J H,Mao Y Z,Jiang Z J,Liu H M,Li B.Seasonal succession of fouling communities in the poly-culture area of scallop Chlamys farreri and kelp Laminaria japonica in Sanggou Bay.Progress in Fishery Sciences,2010,31(4):72-77.
[3] Kaspar H F,Gillespie P A,Boyer I C,Mackenzie A L.Effects of mussel aquaculture on the nitrogen cycle and benthic communities in Kenepuru Sound,Marlborough Sounds,New Zealand.Marine Biology,1985,85(2):127-136.
[4] Zhou Y,Yang H S,Zhang T,Liu S L,Zhang S M,Liu Q,Xiang J H,Zhang F S.Influence of filtering and biodeposition by the cultured scallop Chlamys farreri on benthic-pelagic coupling in a eutrophic bay in China.Marine Ecology Progress Series,2006,317:127-141.
[5] Beadman H A,Kaiser M J,Galanidi M,Shucksmith R,Willows R I.Changes in species richness with stocking density of marine bivalves.Journal of Applied Ecology,2004,41(3):464-475.
[6] Smith J,Shackley S E.Effects of a commercial mussel Mytilus edulis lay on a sublittoral,soft sediment benthic community.Marine Ecology Progress Series,2004,282:185-191.
[7] Haven D S,Morales-Alamo R.Aspects of biodeposition by oysters and other invertebrate filter feeders.Limnology and Oceanography,1966,11(4):487-498.
[8] Wan X X,Zhang X,Liu Q,Huagn X P,Zeng F L,Wang S N.Inhibitory effect of ethanol extract from Styela plicata on HBsAg and HBeAg in vitro.Chinese Journal of Marine Drugs,2003,22(3):40-42.
[9] Hu W J,Wan X X.The screening of effective fraction for anti hepatitis B virus from Styela.Plicata.Chinese Hospital Pharmacy Journal,2004,24(4):202-203.
[10] Fang Y Q,Feng T.Histological study on Gonadal Development of Styela plicata in Xiamen.Journal of Oceanography in Taiwan Strait,1997,16(3):275-279.
[11] Zhou Y.Foundational Studies on Effects of Raft Culture of Filter-feeding Bivalves on Coastal Ecological Environment[D].Qingdao:Chinese Academy of Sciences,2000.
[12] Mao Y Z,Zhou Y,Yang H S,Wang R C.Seasonal variation in metabolism of cultured Pacific oyster,Crassostrea gigas,in Sanggou Bay,China.Aquaculture,2006,253(1/4):322-333.
[13] Qi Z H,Wang J,Mao Y Z,Fang J G,Zhang J H.Biodeposition of two common ascidians Ciona intestinalis and Styela clava in a temperate sea,north China.Aquaculture Environment Interactions.
[14] Wang J,Jiang Z H,Chen R S.Study on biodeposition by oyster Crassostrea gigas.Journal of Fisheries of China,2005,29(3):343-349.
[15] Wang J,Jiang Z H,Chen R S.Assimilation efficiency and biodeposition of mussel Mytilus crassitesta.Journal of Fishery Sciences of China,2005,12(2):150-155.
[16] Wang J,Jiang Z H,Chen R S.Biodeposition by scallop Chlamys farreri.Journal of Fishery Sciences of China,2004,11(3):229-230.
[17] Zhou Y,Yand H S,Mao Y Z,Yuan X T.Biodeposition by the Zhikong Scallop Chlamys farreri in Sanggou Bay,Shandong,Northern China.Chinese Journal of Zoology,2003,38(4):40-44.
[18] Kautsky N,Evans S.Role of biodeposition by Mytilus edulis in the circulation of matter and nutrients in a Baltic coastal ecosystem.Marine Ecology Progress Series,1987,38:201-212.
[19] Grenz C,Plante-Cuny M R,Plante R,Alliot E,Baudinet D,Berland B.Measurement of benthic nutrient fluxes in Mediterranean shellfish farms:a methodological approach.Oceanologica Acta,1991,14(2):195-201.
[20] Tenore K R,Dunstan W M.Comparison of feeding and biodeposition of three bivalves at different food levels.Marine Biology,1973,21(3):190-195.
[21] Widdows J,Fieth P,Worrall C M.Relationships between Seston,Available food and feeding activity in the common mussel Mytilus edulis.Marine Biology,1979,50(3):195-207.
[22] Tsuchiya M.Biodeposit production by the mussel Mytilus edulis L.on rocky shores.Journal of Experimental Marine Biology and Ecology,1980,47(3):203-222.
[23] Epifanio C E,Ewart J.Maximum ration of four algal diets for the oyster Crassostrea virginica Gmelin.Aquaculture,1977,11(1):13-29.
[24] Zheng C X.Species diversity of ascidian in the coastal China Seas.Chinese Biodiversity,1995,3(4):201-205.
[25] Lee J S,Kim S H,Kim Y T,Hong S J,Han J H,Hyun J H,Shin K H.Influence of sea squirt(Halocynthia roretzi)aquaculture on benthicpelagic coupling in coastal waters:A study of the south sea in Korea.Estuarine,Coastal and Shelf Science,2012,99:10-20.
[26] Kaiser M J,Laing I,Utting S D,Burnell G M.Environmental impacts of bivalve mariculture.Journal of Shellfish Research,1998,17:59-66.
[27] Alonso-Pérez F,Ysebaert T,Castro C G.Effects of suspended mussel culture on benthic-pelagic coupling in a coastal upwelling system(Ría de Vigo,NW Iberian Peninsula).Journal of Experimental Marine Biology and Ecology,2010,382(2):96-107.
[28] Giles H,Pilditch C A.Effects of mussel(Perna canaliculus)biodeposit decomposition on benthic respiration and nutrient fluxes.Marine Biology,2006,150(2):261-271.
[29] Nakamura Y,Kerciku F.Effects of filter-feeding bivalves on the distribution of water quality and nutrient cycling in a eutrophic coastal lagoon.Journal of Marine Systems,2000,26(2):209-221.
[30] Yamamuro M,Hiratsuka J,Ishitobi Y.Seasonal change in a filter-feeding bivalve Musculista senhousia population of a eutrophic estuarine lagoon.Journal of Marine Systems,2000,26(2):117-126.
[31] Christensen P B,Glud R N,Dalsgaard T,Gillespie P.Impacts of longline mussel farming on oxygen and nitrogen dynamics and biological communities of coastal sediments.Aquaculture,2003,218(1/4):567-588.
[32] Grant J,Hatcher A,Scott D B,Pocklington P,Schafer C T,Winters G V.A multidisciplinary approach to evaluating impacts of shellfish aquaculture on benthic communities.Estuaries and Coasts,1995,18(1):124-144.
[33] Crawford C M,Macleod C K A,Mitchell I M.Effects of shellfish farming on the benthic environment.Aquaculture,2003,224(1/4):117-140.
[34] Beadman H A,Kaiser M J,Galanidi M,Shucksmith R,Willows R I.Changes in species richness with stocking density of marine bivalves.Journal of Applied Ecology,2004,41(3):464-475.
[35] Beck M,Dellwig O,Liebezeit G,Schnetger B,Brumsack H J.Spatial and seasonal variations of sulphate,dissolved organic carbon,and nutrients in deep pore waters of intertidal flat sediments.Estuarine,Coastal and Shelf Science,2008,79(2):307-316.
参考文献:
[2] 齐占会,方建光,张继红,毛玉泽,蒋增杰,刘红梅,李斌.桑沟湾贝藻养殖区附着生物群落季节演替研究.渔业科学进展,2010,31(4):72-77.
[8] 万新祥,张鑫,刘强,黄小平,曾凡林,王顺年.皱瘤海鞘乙醇提取物抗乙肝HBsAg和HBeAg的初步研究.中国海洋药物,2003,22(3):40-42.
[9] 胡文军,万新祥.皱瘤海鞘提取物体外抗乙肝病毒有效部位的筛选.中国医院药学杂志,2004,24(4):202-203.
[10] 方永强,冯涛.厦门皱瘤海鞘性腺发育的组织学研究.台湾海峡,1997,16(3):275-279.
[11] 周毅.滤食性贝类筏式养殖对浅海生态环境影响的基础研究[D].青岛:中国科学院海洋研究所,2000.
[14] 王俊,姜祖辉,陈瑞盛.太平洋牡蛎生物沉积作用的研究.水产学报,2005,29(3):343-349.
[15] 王俊,姜祖辉,陈瑞盛.厚壳贻贝的同化率及其生物沉积作用.中国水产科学,2005,12(2):150-155.
[16] 王俊,姜祖辉,陈瑞盛.栉孔扇贝生物沉积作用的研究.中国水产科学,2004,11(3):225-230.
[17] 周毅,杨红生,毛玉泽,袁秀堂,张涛,刘鹰,张福绥.桑沟湾栉孔扇贝生物沉积的现场测定.动物学杂志,2003,38(4):40-44.
[24] 郑成兴.中国沿海海鞘的物种多样性.生物多样性,1995,3(4):201-205.
