医学超声关键技术研究和进展(二)超声弹性成像技术、超声图像处理与分析
2013-12-18思平
, , #, ,,,思平*
1.医学超声关键技术国家地方联合工程实验室 2.广东省生物医学信息检测与超声成像重点实验室 3.深圳大学医学院生物医学工程系,广东省深圳市,518060
医学超声技术的发展使得超声成像在临床诊断领域发挥着巨大的作用。由于超声成像具有安全、无创、便携、易用、价格便宜等优势,20世纪末超声检查已占据各类医学影像检查方式的四分之一。然而,许多新的医学超声技术仍然在不断涌现,并且从诊断领域跨入了治疗领域。本文将从超声弹性成像技术、超声图像处理与分析技术方面进行简述和探讨。
1 超声弹性成像进展
人体组织病变与其硬度的改变有直接的关系,因此人体组织的硬度信息很早就被临床用来帮助诊断,医生用手指按压可触及的病变区域,感知肿块的大小、形状、可活动性和硬度,以此来诊断肿瘤的良恶性,其中硬度是区分良恶性最具特异性的指标。这就是广泛用于临床的检查手法,称为“触诊”(palpation)。“触诊”高度依赖于医生的经验,较为主观,并且无法检测难以触及的深在病灶,也很难发现早期的微小病变。
目前认为,粘弹性(viscoelasticity)受病理生理过程影响最大的人体组织的生物力学参数。Fung等人对物体应力-应变(stress-strain)关系进行了大量的研究,发现粘弹性作为人体软组织的基本属性是反映人体组织力学特性的最佳指标[1]。目前临床所用的超声、CT、MRI等影像学手段虽然具有较高的空间分辨率,但不能提供组织弹性改变的信息[2]。人体不同组织弹性模量的差异可达4个数量级,如果能用影像手段对人体组织粘弹性进行成像或测量,则有望获得直接反映组织力学特性的高对比度分辨率的图像,从而为临床诊断提供强有力的工具。
超声弹性成像是建立在组织弹性力学理论、声波在组织内的非线性传播理论、信号调制与处理等基础上的系统问题,以下将针对其关键技术的研究进展与现状进行综述。
1.1 现有超声弹性成像方法
超声弹性成像的核心是用一定的方法激励组织使其动起来,并用超声影像技术来检测组织对于激励的响应,从中可提取组织的粘弹性系数。基于不同的激励方法,有相应的组织弹性分布的重建算法。因此,在组织弹性成像中,组织激励方法是极为关键的问题。以下根据不同的激励方法,对各种超声弹性成像方法进行介绍。
1.1.1组织的自然激励
最早的研究利用了组织的自然激励,比如利用心脏运动引起附近肝脏组织的运动来观察肝的癌变情况,心脏运动引起的胎儿肺部组织运动来评估肺部的发育成熟度等,更为常见的是利用血管的收缩和舒张来测量血管壁在一定压力下的应变情况或者弹性模量,并在此基础上发展了实时血管内超声弹性成像技术(Intravascular ultrasound elastography)[3-6]。
1.1.2准静态激励方法研究
美国Texas大学Ophir教授领导的研究组于1991年首次报道了利用准静态施压(quasi-static compression)的方法获得的组织内部应变分布图,并首次提出超声弹性成像(Ultrasound Elastography)的概念[7]。这篇文献影响深广,突破了超声只用于解剖成像和血流成像的限制,证明超声还可对组织的力学特性成像。准静态弹性成像以美国Texas大学Ophir教授、Michigan大学O'Donnell教授[8]、日本Tsukuba大学的Shiina教授[9]、英国剑桥大学的Treece教授[10]等各自领导的研究组为代表。这种方法直接利用B超探头同时完成施压和信号采集,原理简单,操作方便,因此在之后的20年里被广泛应用于乳腺、肾脏、前列腺、眼球等静态器官[11-15],并已经获得FDA批准用于临床乳腺癌的早期诊断[16-17]。
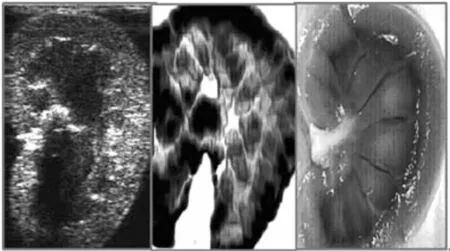
图1 肾脏的图片,从左往右分别是超声图像、弹性图像、病理切片[11]Fig.1 From left to right, longitudinal sonogram, elastogram and gross pathological specimen from an ovine kidney in vitro.
1.1.3低频振动激励方法研究
与准静态弹性成像同步进行的,是另一种基于低频振动方法(low frequency vibration)的弹性成像技术,以美国Rochester大学Parker教授[18-20]、日本东京理工学院(Tokyo Institute of Technology)的Sato教授[21,22]等各自领导的研究组为代表。他们的算法各有不同,但均采用了体外低频(20~1000 )Hz振动源的激励方法,即将低频振动器置于体表,或者将振动器和超声探头集成在一起,以便于操作。通过振动源向体内传播低频振动,用超声检测振动引起的剪切波在体内传播时的幅度、相位和速度信息,当体内有硬化组织时,波的传播模式会改变,由此可检测到组织内部的异变。
以上两类方法都采用了接触式的机械激励(mechanical stimulation)方法,作用力施加于人体的体表,以激励皮下组织,直接模拟了医生用手指以一定频率按压人体组织实施检查的过程,方法较为直观简单,但是由于两种方法都是对组织整体施加激励,因此在后续的重构组织弹性图像的过程中遇到了很多难题,也很难对深层的组织或腔内器官进行激励。
1.1.4声辐射力激励方法研究
为了解决上述难题,以日本东京理工学院的Sugimoto教授[23]、美国Duke大学的Nightingale教授[24-25]、俄罗斯Moscow大学的Sarvazyan教授[26-27]、法国巴黎大学的Fink教授[28-29]和美国Mayo Clinic的Greenleaf[30-32]教授为代表的研究组提出了最新的方法,采用声辐射力(acoustic radiation force)的方法来局部激励人体内部组织,并针对声辐射力引发的局部组织振动引起的体内剪切波进行检测,剪切波的振幅、传播速度、衰减距离等与组织的力学特性直接相关,因此通过测定剪切波的声学参数可推导组织的力学特性。这种方法借助了声波在组织内传播时与组织相互作用引起的声辐射力来对组织施加激励,通常采用聚焦超声在焦点处引起组织振动,并向外传播剪切波。现有的基于声辐射力的超声弹性成像方法有多种,包括:声辐射力脉冲成像(ARFI)[25],超音剪切波弹性成像(SSI)[33],剪切波频散振动成像(SDUV)[34]。
1.2 超声弹性成像方法与现有商用超声系统的集成
最早取得进展的是准静态弹性成像方法。日本的Hitachi公司与日本Tsukuba大学经过多年的合作,于2005年推出了世界上第一台实时组织弹性成像超声诊断仪(Hitachi EUB-8500),并且继超声各种成像模式包括A(amplitude)超、B(Brightness)超、D(Doppler)超、M(motion)超之后,将弹性成像模式命名为E(Elastography)超。另一个成功的例子是声辐射力弹性成像方法的商业化。西门子公司在2008年推出ACUSON S2000最新高档彩超,包含了“虚拟触诊”(Virtual Touch)功能,其原理就是利用ARFI方法,通过调控激励脉冲和追踪脉冲的间隔来实现对组织的声辐射力远程激励和信号追踪。法国Echosens公司根据瞬态弹性成像技术,研发了FibroScan产品,可提供组织的弹性模量,但该系统与现有彩超成像模式不能兼容,而且该设备只能专用于肝脏测量,其得到的结果是整个肝脏的平均弹性程度,还不能精细到肝脏内部每一点的弹性系数。但鉴于其重要的临床意义,该产品在中国的市场较好,目前已经在多家三甲医院用于肝硬化的检测。
1.3 超声弹性成像小结
综上所述,超声对人体组织硬度测量是一种新的成像方法,在肿瘤早期诊断及组织定征甚至材料力学特性检测中均有广阔的应用前景。在研究者提出的各种超声方法中,准静态弹性成像方法是最早开始研究,也是理论和算法最成熟的一种,但这种方法本身存在固有的缺点,使得它的推广受到一定的限制。声辐射力弹性成像方法是目前研究的热点,也是最有应用前景的一种方法。国外有多个团队正在分别进行这方面的研究,国内陈思平教授带领的团队也开展了利用SDUV方法进行大鼠肝脏粘弹性测量的初步研究[35],希望能早日实现临床上的应用。
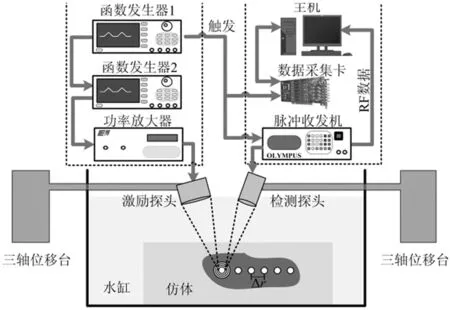
图2 基于声辐射力的超声弹性成像系统框图Fig.2 Diagram of ultrasound elastography system using acoustic radiation force
2 超声图像处理与分析
过去50年间,超声医学图像处理及分析技术得以迅猛发展。作为非侵入式成像设备的代表,超声成像具有安全、无创、实时、廉价、便携等优势,早在上世纪末,超声检查占各类医学影像检查方式的比例已超过四分之一[36],相应的超声图像可视化及分析技术也取得了长足进展。
起初,为方便后续的可视化及分析,图像可视化及预处理技术是研究的热点。自1970年开始,随着计算机视觉和模式识别技术的发展和逐渐成熟,研究者们把注意力转移到了超声医学图像分割、配准和理解等任务上。本节我们将分别对与超声医学图像相关的可视化、预处理、分割、配准和理解等技术方法进行综述。
2.1 超声图像三维可视化
超声图像可视化最具代表性的成果是在产科中有广泛应用的三维超声成像,其解决了人体组织表面形态及解剖结构的三维重建,为医生提供了一种直观地诊断手段。三维超声成像技术由三部分组成:获取、重建和显示。
1)图像的获取是精确三维超声成像的先决条件,其有三种方式,分别是机械驱动扫查、自由臂扫查和二维阵列探头扫查。
2)三维图像可由两种重建方式获得[37-38]:a)基于特征的重建,即通过对每一幅二维图像分割出感兴趣的特征(如脏器边界),重建出目标的表面信息。b)基于体素的重建,即通过将二维平面图像中的每一个像素都转换到一个三维坐标系中,来构建基于体素的立体图,此方法是目前最常用的重建方法。
3)三维图像的显示实际上是一个体数据的可视化问题,它除了能显示组织的立体形态和结构,还可以显示该组织的任意剖面。在实际应用中,大多数图像都采用体绘制技术产生[39],该技术最大的优点是可以显示实质性脏器的内部结构。直接体绘制算法大体可以分为三个大类[40]:以对象空间(Object Space)为序的体绘制算法、以图像空间(Image Space)为序的体绘制算法以及对象和物体空间混合体绘制算法。这三类算法都是属于纯软件的算法,随着普通显卡里的三维加速功能的逐渐强大,基于图形硬件的体绘制算法正逐渐成为主流。现在最活跃的研究领域是彻底在GPU上实现光线投射算法[41],从而实现基于硬件的体绘制算法可以达到和基于软件的算法同样的绘制效果。
2.2 超声图像预处理
超声医学图像预处理主要包括图像滤波和增强。由于超声图像中的斑点噪声大大降低了图像的对比度和组织内可获取的细节信息,因此,关于超声图像的滤波技术一直是一个热门话题。这里主要介绍超声图像滤波算法。传统滤波方法如均值滤波、中值滤波、Lee滤波、同质滤波等,实现简单,滤波效果也有限。Donoho[42]提出的通过修改变换小波域中的小波系数来滤除噪声的方法和Yu和Acton[43]提出的各向异性扩散方程(SRAD),在平滑噪声和保留图像细节上均有良好性能,从而成为这一时期的研究热点。Comaniciu和Meer[44]提出的均值移位滤波(mean shift)算法也能在滤除噪声的同时保持边界。上述滤波技术都将超声图像中的斑点看作噪声来滤除,实际上,斑点包含了关于成像组织中散射体密度这样很有价值的信息。飞利浦医疗推出了一套实时自适应灰度图像滤波方法XRES[45],其基于多分辨率算法,通过对局部梯度的估计来选择是做平滑处理还是增强处理,能提高超声图像的质量。
事实上,没有一个滤波算法能保证在所有应用中都是最优的。对于特定图像,以定性和定量的方式比较各种滤波算法的性能以择优选择,是一种较简单可行的方案。
2.3 超声图像分割
图像分割一直都是超声医学图像分析领域研究的热点[46],其目标是按照某种规则将图像中的像素划归为不同的类别。早期的技术如阈值化、区域生长和聚类,利用的是图像的灰度信息,然而这类方法难以分开拥有类似灰度值的两类物体;基于边缘检测的方法利用图像的梯度信息,然而这类方法对噪声敏感,且不能正确提取边界模糊的物体。由于超声图像质量较差,对于复杂的待分割目标,通常需要利用先验信息才有能取得较好的分割效果。形状先验信息随着活动轮廓模型[47]的提出而引起了广泛关注,2000年以后提出的标准割[48]、均值移位[44]和图割[49]等算法则考虑到了如区域内的连续性和区域间的差异性等信息。基于神经网络的方法[50]则更加专注于特定的分割目标,可融入多种图像特征。2005年出现了一种全新的分割模式--数据库引导的分割[51],其通过学习一个判别分类器来区分目标和背景,从而利用隐含在专家标注数据库中的信息实现分割。
上述分割算法各有其优缺点,通常说来,对于特定的分割任务,如何在某种分割算法中融入特定目标的图像底层信息如:轮廓、纹理和某些统计特征参数,以及先验信息如:解剖结构形状先验、平滑先验和成像物理等先验才是一个分割算法成功的关键。
2.4 超声图像配准
图像配准是医学图像处理中的基本任务之一[52],是指将不同时间或者不同成像设备获取的图像或体数据进行匹配,并求出图像或体数据间的空间变换关系。按照图像来源来分,医学图像配准可分为单模态和多模态配准两种;按照空间变换的种类来分,医学图像配准主要可以分为刚体和非刚体配准两种,刚体配准通常作为非刚体配准的初始条件。超声图像之间的配准主要用于超声宽景成像[53-54](如图3所示)、空间复合成像[55]以及自由臂三维超声成像的自动校准[56]等。近年来,由于超声成像具有无辐射、实时及廉价等优点,超声成像被广泛应用于手术引导,但是超声图像固有的斑点噪声、分辨率低及对比度差等问题影响了手术引导的效果,因此术中超声成像与术前其它模态影像的结合正成为当前的研究热点,超声图像与其它成像模式间的多模态配准正是其中的关键技术。由于成像原理的不同,超声图像与其它模态图像(如CT,MRI)之间差异较大,因此配准是非常困难的,通常需要基于定位器来提供自动配准的初始条件。目前常用的超声与其它模态图像间的配准方法主要可以分为两种:(1)基于灰度的方法,如Correlation Ratio[57-58],Cross Correlation[59],互信息[60]等;(2)基于表面(Surface)匹配的方法[61-62]等。
超声图像与其它模态图像配准的关键是根据特定的临床应用,寻找两者之间的有效相似测度,如Wein[63]提出通过将CT模拟成超声图像再与超声图像进行配准的方法可有效提高配准的鲁棒性。虽然现有方法已经取得了一定进展,但是超声图像与其它模态影像间的刚体和非刚体配准仍将是未来研究的重点和难点。

图3 基于3D SIFT特征匹配的三维超声宽景成像[53]Fig.3 Volumetric ultrasound panorama based on 3D SIFT
2.5 超声图像理解
机器学习在医学图像理解任务中起到了至关重要的作用,其成功地促成了大量的应用,包括计算机辅助诊断、病案检索、组织器官分割、定量分析等[64]。对于那些缺乏精确知识和难以分析推导的问题来说,从实例中自动学习的算法就能发挥其重要作用。近年来,由于许多高性价比的超声成像设备正越来越广地应用于临床,从而积累了大量的医学图像数据库,这使得机器学习在医学中的应用变得更加可行。用于超声医学图像理解的机器学习算法中,核学习和概率模型扮演着关键角色:核学习(支持向量机)能给超声医学计算机辅助检测及诊断任务提供最佳分类器;概率模型(朴素贝叶斯、图模型、马尔可夫随机场)为医学图像分析任务如图像重建、分割、配准等提供理论框架。对于学习分类器来说,线性模型(线性判别分析)、人工神经网络(误差反向传播、自组织映射)和集成学习(Boosting、AdaBoost)是除核学习之外的选择。降维和特征选择是计算机辅助诊断的关键技术。聚类分析可用于识别超声医学图像中的相似病灶。
国内汪天富教授的团队较早开展了超声图像理解方面的研究工作,主要基于人工神经网络方法,分别研究了基于组织多普勒图像的窦房结定量分析[65]、基于B超图像的脂肪肝与正常肝自动识别[66]和基于彩色多普勒血流图像和B超图像相结合的乳腺肿瘤计算机辅助诊断[67]等;最近,陈思平教授的团队提出二维超声“智能扫查”理念,并基于集成学习方法,实现了二维超声影像中早孕囊标准切面的自动提取和径线的自动测量,如图4所示[68],从而有望提高产前超声检测的标准化和规范化程度。
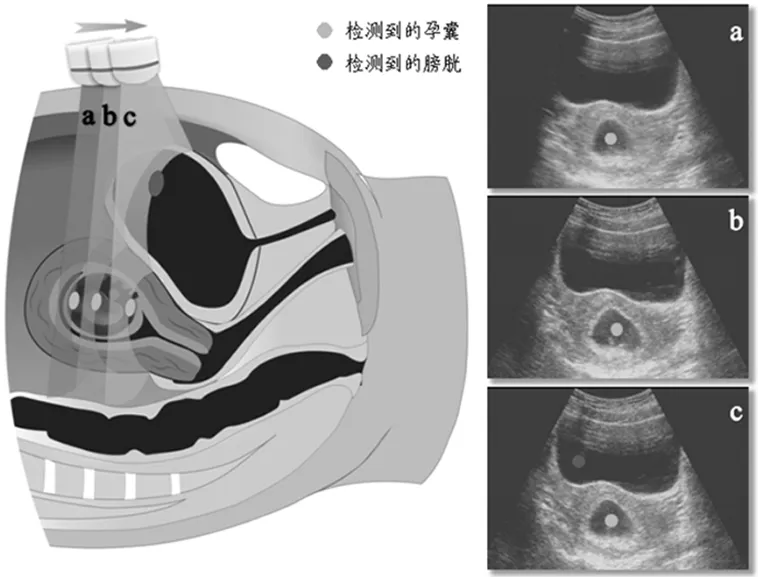
图4 二维超声“智能扫查”示意图Fig.4 Illustration of 2D intelligent ultrasound scanning method
医生手持超声探头扫过孕妇腹部,产生一系列切面图像(a、b、c……),计算机则自动从中找出标准切面图像(即b,该切面上所含的孕囊最大)[68]。
在模式分类领域,我们没有理由偏好任何一个分类器[69]。因此,实际应用时,通常需要对比多种分类器的分类性能来选取一个对该应用、该组数据、该组特征较优的分类器。Forsyth和Ponce[70]指出,可先尝试核学习,然后线性模型和神经网络等。
超声图像处理与分析涉及内容广泛,远不止以上综述的五个部分,随着计算机科学和超声成像设备的发展,超声图像处理和分析也将向智能化、鲁棒性强和实时快速等方向发展。
[1] Fung Y C. Biomechanics: Mechanical properties of living tissues[M]. 2nd Edition ed: Springer. 1994.
[2] Greenleaf J F, Fatemi M, Insana M. Selected methods for imaging elastic properties of biological tissues [J]. Annu. Rev. Biomed. Eng., 2003, 5: 57-78.
[3] de Korte C L, Sierevogel M J, Mastik F, et al. Identification of atherosclerotic plaque components with intravascular ultrasound elastography in vivo a Yucatan pig study[J]. Circulation, 2002, 105(14): 1627-1630.
[4] Lee W N, Ingrassia C M, Fung-Kee-Fung S D, et al. Theoretical quality assessment of myocardial elastography with in vivo validation[J]. IEEE Trans. Ultrason. Ferroelectr. Freq. Control, 2007, 54(11): 2233-2245.
[5] Schaar J A, de Korte C L, Mastik F, et al. Characterizing vulnerable plaque features with intravascular elastography[J]. Circulation, 2003, 108(21): 2636-2641.
[6] Zhang P, Zhang Y. The technical principle and clinical application of intravascular ultrasound elastogram[J]. J Biomed Eng, 2005, 22(1): 163.
[7] Ophir J, Cespedes I, Ponnekanti H, et al. Elastography: a quantitative method for imaging the elasticity of biological tissues[J]. Ultrasonic imaging, 1991, 13(2): 111-134.
[8] Lubinski M A, Emelianov S Y, O'Donnell M. Speckle tracking methods for ultrasonic elasticity imaging using short-time correlation[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 1999, 46(1): 82-96.
[9] Yamakawa M, Shiina T. Strain estimation using the extended combined autocorrelation method[J]. Jpn J Appl Phys, 2001, 40: 3872.
[10] Treece G M, Lindop J E, Gee A H, et al. Freehand ultrasound elastography with a 3-D probe[J]. Ultrasound Med Biol, 2008, 34(3): 463-474.
[11] Ophir J, Alam S K, Garra B S, et al. Elastography: imaging the elastic properties of soft tissues with ultrasound[J]. J Med, 2002, 29: 156.
[12] 罗建文, 白净. 超声弹性成像的研究进展[J]. 中国医疗器械信息, 2005, 11(005): 23-31.
[13] Itoh A, Ueno E, Tohno E, et al. Breast Disease: Clinical Application of US Elastography for Diagnosis[J]. Radiology, 2006, 239(2): 341-350.
[14] 关少卿, 罗葆明, 欧冰等. 超声弹性成像诊断乳腺局灶性病变价值的初步探讨[J]. 临床超声医学杂志, 2006, 8(10): 598-601.
[15] 王怡, 王涌, 张希敏等. 实时组织弹性成像技术在鉴别诊断乳腺良恶性肿块中的价值评估[J]. 中华超声影像学杂志, 2005, 14(12): 911-913.
[16] Ginat D T, Destounis S V, Barr R G, et al. US Elastography of Breast and Prostate Lesions[J]. Radiographics, 2009, 29(7): 2007-2016.
[17] Salomon G, K?llerman J, Thederan I, et al. Evaluation of prostate cancer detection with ultrasound real-time elastography: a comparison with step section pathological analysis after radical prostatectomy[J]. Eur Urol, 2008, 54(6): 1354-1362.
[18] Huang S R, Lerner R M, Parker K J. Time domain Doppler estimators of the amplitude of vibrating targets[J]. J Acoust Soc Am, 1992, 91: 965.
[19] Rubens D J, Hadley M A, Alam S K, et al. Sonoelasticity imaging of prostate cancer: in vitro results[J]. Radiology, 1995, 195(2): 379-383.
[20] Parker K J, Taylor L S, Gracewski S, et al. A unified view of imaging the elastic properties of tissue[J]. J Acoust Soc Am, 2005, 117: 2705.
[21] Yamakoshi Y, Sato J, Sato T. Ultrasonic imaging of internal vibration of soft tissue under forced vibration[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 1990, 37(2): 45-53.
[22] Yamakoshi Y, Otaki H, Shinozuka N, et al. Internal tissue displacement measurement based on ultrasonic wave Doppler signal digital detection and its application to fetal movement monitoring[J]. Ultrasonics, 1996, 34(8): 769-775.
[23] Sugimoto T, Ueha S, Itoh K. Tissue hardness measurement using the radiation force of focused ultrasound[C]. IEEE Ultrasonics Symposium. Honolulu, HI: IEEE, 1990.
[24] Nightingale K R, Kornguth P J, Trahey G E. The use of acoustic streaming in breast lesion diagnosis: a clinical study[J]. Ultrasound Med Biol, 1999, 25(1): 75-87.
[25] Nightingale K, Soo M S, Nightingale R, et al. Acoustic radiation force impulse imaging: in vivo demonstration of clinical feasibility[J]. Ultrasound Med Biol, 2002, 28(2): 227-235.
[26] Rudenko O, Sarvazyan A, Emelianov S Y. Acoustic radiation force and streaming induced by focused nonlinear ultrasound in a dissipative medium[J]. J Acoust Soc Am, 1996, 99: 2791.
[27] Sarvazyan A P, Rudenko O V, Swanson S D, et al. Shear wave elasticity imaging: a new ultrasonic technology of medical diagnostics[J]. Ultrasound Med Biol, 1998, 24(9): 1419-1435.
[28] Muller M, Gennisson J L, Deffieux T, et al. Quantitative viscoelasticity mapping of human liver using supersonic shear imaging: preliminary in vivo feasibility study [J]. Ultrasound Med Biol, 2009, 35(2): 219-229.
[29] Bavu E, Gennisson J, Couade M, et al. Noninvasive in vivo liver fibrosis evaluation using supersonic shear imaging: a clinical study on 113 hepatitis C virus patients [J]. Ultrasound Med Biol, 2011, 37(9): 1361-1373.
[30] Fatemi M, Greenleaf J F. Ultrasound-stimulated vibro-acoustic spectrography[J]. Science, 1998, 280(5360): 82-85.
[31] Fatemi M, Greenleaf J F. Vibro-acoustography: An imaging modality based on ultrasound-stimulated acoustic emission[J]. Proc Natl Acad Sci U.S.A., 1999, 96(12): 6603-6608.
[32] Fatemi M, Wold L E, Alizad A, et al. Vibro-acoustic tissue mammography[J]. IEEE Trans Med Imaging, 2002, 21(1): 1-8.
[33] Bercoff J, Tanter M, Fink M. Supersonic shear imaging: a new technique for soft tissue elasticity mapping[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 2004, 51(4): 396-409.
[34] Chen S, Urban M, Pislaru C, et al. Shearwave dispersion ultrasound vibrometry (SDUV) for measuring tissue elasticity and viscosity[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 2009, 56(1): 55-62.
[35] Wang Y, Chen S, Wang T, et al. Development of a generic ultrasound vibro-acoustic imaging platform for tissue elasticity and viscosity[J]. J Innovative Opt Health Sci, 2012, 5(1): 1-7.
[36] 陈思平. 医学超声影像产业现状和发展[J]. 应用声学, 2005(4): 201-207.
[37] Fenster A, Downey D B. Three-dimensional ultrasound imaging[J]. Annu Rev Biomed Eng, 2000, 2: 457-475.
[38] Solberg O V, Lindseth F, Torp H, et al. Freehand 3D ultrasound reconstruction algorithms--a review[J]. Ultrasound Med Biol, 2007, 33(7): 991-1009.
[39] 汪天富, 郑昌琼, 李德玉等. 超声心脏图像多维重建研究进展[J]. 生物医学工程学杂志, 2001, 18(1): 133-137.
[40] Preim B, Bartz D. Visualization in medicine: theory, algorithms, and applications[M]. Morgan Kaufmann. 2007.
[41] Kruger J, Westermann R. Acceleration techniques for GPU-based volume rendering[C]. Proceedings of the 14th IEEE Visualization 2003: IEEE Computer Society, 2003.
[42] Donoho D L. De-noising by soft-thresholding[J]. IEEE Trans Inf Theory, 1995, 41(3): 613-627.
[43] Yu Y, Acton S T. Speckle reducing anisotropic diffusion[J]. IEEE transactions on image processing : a publication of the IEEE Signal Processing Society, 2002, 11(11): 1260-1270.
[44]Comaniciu D, Meer P. Mean shift: A robust approach toward feature space analysis[J]. IEEE Trans Pattern Anal Mach Intell, 2002, 24(5): 603-619.
[45] Jago J, Collet-Billon A, Chenal C, et al. XRES: adaptive enhancement of ultrasound images[J]. Medicamundi, 2002, 46(3): 36-41.
[46] Noble J A, Boukerroui D. Ultrasound image segmentation: a survey[J]. IEEE Trans Med Imaging, 2006, 25(8): 987-1010.
[47] Kass M, Witkin A, Terzopoulos D. Snakes: Active contour models[J]. Int J Comput Vision, 1988, 1(4): 321-331.
[48] Shi J, Malik J. Normalized cuts and image segmentation[J]. IEEE Trans Pattern Anal Mach Intell, 2000, 22(8): 888-905.
[49] Boykov Y, Veksler O, Zabih R. Fast approximate energy minimization via graph cuts[J]. IEEE Trans Pattern Anal Mach Intell, 2001, 23(11): 1222-1239.
[50] 汪天富, 郑昌琼, 李德玉等. 用神经网络进行超声医学图像分割[J]. 生物医学工程学杂志, 1998, 15(4): 397-399.
[51] Georgescu B, Zhou X S, Comaniciu D, et al. Database-guided segmentation of anatomical structures with complex appearance[C]. IEEE Computer Society Conference on Computer Vision and Pattern Recognition: IEEE, 2005.
[52] Maintz J B A, Viergever M A, An overview of medical image registration methods. 1998.
[53] Ni D, Qul Y, Yang X, et al. Volumetric ultrasound panorama based on 3D SIFT[J]. Medical image computing and computer-assisted intervention : MICCAI . International Conference on Medical Image Computing and Computer-Assisted Intervention, 2008, 11(Pt 2): 52-60.
[54]Weng L, Tirumalai A P, Lowery C M, et al. US extended-field-of-view imaging technology[J]. Radiology, 1997, 203(3): 877-880.
[55] Krucker J F, LeCarpentier G L, Fowlkes J B, et al. Rapid elastic image registration for 3-D ultrasound[J]. IEEE Trans Med Imaging, 2002, 21(11): 1384-1394.
[56] Blackall J, Rueckert D, Maurer C, et al. An image registration approach to automated calibration for freehand 3D ultrasound[C]. Medical Image Computing and Computer Assisted Intervention: Springer, 2000.
[57] Leroy A, Mozer P, Payan Y, et al. Rigid registration of freehand 3D ultrasound and CT-scan kidney images[C]. Medical Image Computing and Computer-Assisted Intervention - MICCAI 2004, 2004.
[58] Roche A, Pennec X, Malandain G, et al. Rigid registration of 3-D ultrasound with MR images: a new approach combining intensity and gradient information[J]. IEEE Trans Med Imaging, 2001, 20(10): 1038-1049.
[59] Penney G P, Blackall J M, Hamady M S, et al. Registration of freehand 3D ultrasound and magnetic resonance liver images[J]. Med Image Anal, 2004, 8(1): 81-91.
[60] Wein W, Roper B, Navab N. Integrating Diagnostic B-Mode Ultrasonography Into CT-Based Radiation Treatment Planning[J]. IEEE Trans Med Imaging, 2007, 26(6): 866-879.
[61] Brendel B, Winter S, Rick A, et al. Registration of 3D CT and ultrasound datasets of the spine using bone structures[J]. Computer Aided Surgery, 2002, 7(3): 146-155.
[62] Martin S, Baumann M, Daanen V, et al. MR prior based automatic segmentation of the prostate in TRUS images for MR/TRUS data fusion[C]. IEEE International Symposium on Biomedical Imaging: From Nano to Macro: IEEE,2010.
[63] Wein W, Brunke S, Khamene A, et al. Automatic CT-ultrasound registration for diagnostic imaging and image-guided intervention[J]. Med Image Anal, 2008, 12(5): 577-585.
[64] Wang S, Summers R M. Machine learning and radiology[J]. Med Image Anal, 2012, 16(5): 933-951.
[65] Zhao S, Li D Y, Zheng Y, et al. Quantitative analysis of sinoatrial node using Doppler tissue images[J]. IEEE Trans Ultrason Ferroelectr Freq Control, 2003, 50(10): 1336-1341.
[66] 汪小毅, 林江莉, 李德玉等. 基于纹理分析的脂肪肝B超图像识别[J]. 航天医学与医学工程, 2004, 17(2): 144-148.
[67] Diao X F, Zhang X Y, Wang T F, et al. Highly sensitive computer aided diagnosis system for breast tumor based on color Doppler flow images[J]. J Med Syst, 2011, 35(5): 801-809.
[68] Zhang L, Chen S, Chin C T, et al. Intelligent scanning: automated standard plane selection and biometric measurement of early gestational sac in routine ultrasound examination[J]. Med Phys, 2012, 39(8): 5015-5027.
[69] Duda R O, Hart P E, Stork D G. Pattern Classification[M]. Wiley-Interscience. 2001.
[70] Forsyth D A, Ponce J. Computer vision: a modern approach[M]. Prentice Hall Professional Technical Reference. 2002.
