甲状旁腺切除术纠正继发性甲状旁腺功能亢进改善肾性贫血的临床研究
2013-12-18,,,
, , ,
(大连医科大学 附属第一医院 肾内科,辽宁 大连 116011)
临床医学
甲状旁腺切除术纠正继发性甲状旁腺功能亢进改善肾性贫血的临床研究
赵光本,杨宁,辛竹,杭宏东
(大连医科大学 附属第一医院 肾内科,辽宁 大连 116011)
目的探讨甲状旁腺切除术(PTX)纠正重度继发性甲状旁腺功能亢进(SHPT)对难治性肾性贫血的影响。方法选取并发重度SHPT及难治性肾性贫血的维持性血液透析(MHD)患者33例,均为药物治疗无效后行PTX。观察术前、术后第1、3、6、12个月时患者血清全段甲状旁腺激素(iPTH)、钙(Ca)、磷(P)、血红蛋白(Hb)及红细胞压积(Hct)、重组人促红细胞生成素(rHuEPO)用量、血清铁蛋白(SF)、转铁蛋白饱和度(TSAT)、血清白蛋白(ALB)、C反应蛋白(CRP)及Kt/V等指标的变化情况。结果与术前相化,PTX术后1月血清iPTH、Ca、P显著下降(P<0.05);术后3月开始,贫血明显改善,血Hb、Hct显著升高(P<0.05);术后6月rHuEPO用量显著减少(P<0.05)。PTX前后SF、TSAT、ALB、CRP及Kt/V等指标均无显著改变(P>0.05)。结论采用PTX纠正SHPT可显著改善MHD患者的肾性贫血,同时改善rHuEPO抵抗,提示重度SHPT是影响肾性贫血及rHuEPO疗效的一个重要因素。
继发性甲状旁腺功能亢进;肾性贫血;甲状旁腺切除术
肾性贫血是维持性血液透析(maintenance hemodialysis, MHD)患者常见而重要的并发症。自重组人促红细胞生成素(recombinant human erythropoietin, rHuEPO)广泛应用于临床以来,贫血的治疗达标率有了极大的提高。然而,临床上仍有部分患者出现rHuEPO的抵抗现象,导致贫血难以纠正。出现rHuEPO抵抗的常见原因有铁剂不足、感染、炎症状态、营养不良、溶血或失血、肿瘤、铝中毒及透析不充分等[1]。此外,临床上容易忽略的是继发性甲状旁腺功能亢进(secondary hyperparathyroidism, SHPT)对贫血的影响。重度SHPT是MHD患者常见而严重的并发症,通过药物保守治疗大多难以有效控制,同时导致肾性贫血亦难以纠正。对于药物治疗无效的重度SHPT,甲状旁腺切除术(parathyroidectomy, PTX)是一种安全有效的治疗手段[2]。因此,本研究通过分析本院血液净化中心近年来采用PTX治疗重度SHPT的MHD患者的临床资料,探讨采用PTX纠正重度SHPT对难治性肾性贫血的影响。
1 资料与方法
1.1 研究对象
选取大连医科大学附属第一医院血液净化中心2006年1月—2012年12月期间的MHD患者33例,其中男18例,女15例,平均年龄(54. 6±16.3)岁。透析方式:每周3次或两周5次(每次4 h)规律血液透析;透析龄:13.6~223.2月,平均 (121.1±29.3)月。原发病分别为:慢性肾小球肾炎13例,糖尿病肾病7例,高血压肾损害5例,多囊肾3例,痛风性肾病2例,慢性肾盂肾炎2例,梗阻性肾病1例。
入选标准:年龄18~65周岁;透析龄>6个月;伴有重度SHPT且经过规范活性维生素D3冲击治疗无效或有药物治疗禁忌而选择PTX治疗;术前经过规范rHuEPO、铁剂及叶酸治疗6个月,血红蛋白(Hb)及红细胞压积(Hct)处于稳定状态,但贫血未能纠正(Hb<100 g/L);透析充分,尿素清除率(Kt/V)≥1.4;签署知情同意书。重度SHPT定义为血清全段甲状旁腺激素(intact parathyroid hormone, iPTH)水平>800 pg/mL,除外原发性及其他继发性甲状旁腺功能亢进。
排除标准:严重营养不良;感染或炎症状态;各种原因导致的缺铁或铁储备不足;叶酸或维生素B12不足;溶血及出血性疾病或近3个月有输血史;恶性肿瘤;活动性系统性疾病;严重心力衰竭;PTX治疗失败。
1.2 贫血治疗方法
根据检测结果,缺铁的患者给予静脉补铁,补铁量为:总缺铁量(mg)=体质量(kg)×(Hb目标值-Hb实际值)(g/L)×0.24+贮存铁量(mg),贮存铁量=500 mg,此后每月给予100~200 mg维持量,无明显缺铁的患者直接给予维持量;或采用口服补铁150 mg,1~2次/d,维持铁蛋白(SF)200~400 ng/mL,转铁蛋白饱和度(TSAT)25%~50%;同时给予叶酸10 mg,3次/d口服。给予rHuEPO (167.77±31.34)IU/kg·W,透析后静推。
1.3 PTX治疗方案
术前1周口服活性维生素D30.5 μg/d,术前1天充分透析,完善常规术前检查。术式均为甲状旁腺全切不移植,同时行甲状旁腺周围淋巴、脂肪组织、胸腺舌叶的切除。术后严密监测血钙,发现离子钙<0.8 mmol/L或总钙<1.7 mmol/L,伴有低钙症状或血钙有出现下降趋势时,给予10%葡萄糖酸钙1~2 g稀释静注或泵入,胃肠功能恢复后给予活性维生素D30.5~3.0 μg/d及碳酸钙0.9~2.7 g/d(以元素钙计),同时采用2.0 mmol/L高钙透析液进行透析,待稳定在2.2 mmol/L后逐渐停用静脉补钙,继续口服活性维生素D3及碳酸钙。
1.4 观察指标
检测PTX前及PTX后1、3、6、12个月时患者血清iPTH、钙(Ca)、磷(P)、血红蛋白(Hb)、红细胞压积(Hct)、血清铁(Fe)、铁蛋白(SF)、转铁蛋白饱和度(TSAT)、白蛋白(ALB)及C-反应蛋白(CRP)等,以上指标均为本院检验中心监测。同时记录同期rHuEPO用量,计算透析充分性。随访期为PTX后1年。
透析充分性评估:采用DaugirdasⅡ公式计算尿素清除率(Kt/V),即Kt/V=-Ln(R-0.008t)+(4-3.5R)×UF/W,其中R=透析后BUN/透析前BUN,Ln为自然对数,UF 为超滤量(L),W透析后体重(Kg),t为透析时间(hr)。
1.5 统计学方法
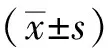
2 结 果
2.1 PTX前后SHPT纠正情况
PTX术后1月,血清iPTH及Ca、P水平明显下降,与PTX前比较,差异有显著性意义(P<0.01),见表1。

表1 PTX前后iPTH, Ca和P的变化情况
1)与治疗前比较,P<0.01
2.2 PTX前后贫血指标及rHuEPO用量比较
术后3月开始,贫血指标明显改善,血Hb、Hct持续升高,与PTX前比较,差异有显著性意义(P<0.05);术后6月开始rHuEPO用量显著减少,与PTX前比较,差异有显著性意义(P<0.05),见表2。

表2 PTX前后贫血指标及rHuEPO用量变化
与治疗前比较,1)P<0.05,2)P<0.01
2.3 PTX前后影响贫血的其他参数比较
PTX前后铁代谢情况(Fe、SF、TSAT)、营养状况(ALB)、炎症状态(CRP)及透析充分性(Kt/V)等指标均无明显改变(P>0.05),见表3。
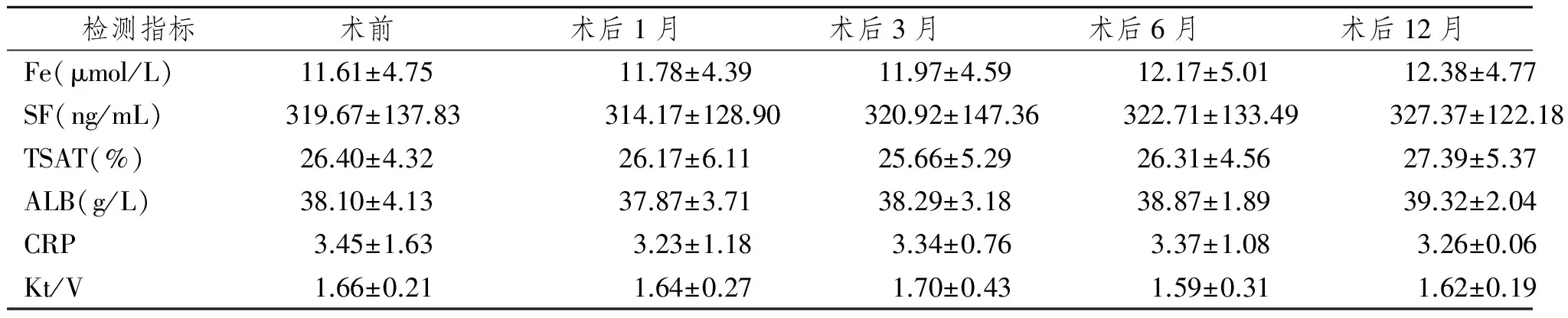
表3 PTX前后影响贫血的其他指标比较
3 讨 论
重度SHPT是MHD患者常见而严重的并发症,是钙磷代谢紊乱、肾性骨病及血管钙化的重要原因,同时参与难治性肾性贫血的发病,与MHD患者的致残率及死亡率密切相关[3-4],药物治疗无效时应考虑行PTX治疗[2]。本研究中,PTX前血清iPTH 高达(1524.87±463.21) pg/L,PTX后迅速降至(51.47±48.97) pg/L,血清Ca、P随之下降,结合补钙等措施,无严重并发症发生,随访1年,上述指标一直保持在理想水平。上述结果提示,PTX是治疗重度SHPT的一种安全有效的方法,与文献报道相符[2]。
贫血是MHD患者的另一重要并发症,是导致MHD患者住院、心血管病死亡和全因死亡的独立危险因素,严重影响患者的器官功能、生活质量和远期预后[5],积极纠正贫血有十分重要的临床意义。然而,MHD并发重度SHPT时贫血发生率高且难以纠正,通过增加rHuEPO用量及铁剂的补充对贫血的改善意义不大,而且会导致高血压、癫痫、血栓栓塞及铁沉积等不良事件的增加。有研究表明,SHPT时高浓度的甲状旁腺激素(parathyroid hormone, PTH)参与贫血的发生[6-9],其主要机制如下:通过下调骨髓红系干细胞膜上的红细胞生成素受体表达,抑制红系祖细胞的的增值与分化,直接抑制骨髓造血;抑制红细胞膜钙三醇受体活性,钙泵失活而使细胞脆性增加,易于被破坏;抑制Na-K-ATP 酶活性,干扰能量代谢,使红细胞寿命缩短;高 PTH 血症增加红细胞的渗透脆性,从而加速溶血。此外,高浓度的PTH 直接或间接地影响促红细胞生成素释放;抑制外周红细胞克隆生成,降低外周组织对rHuEPO 的敏感性,造成rHuEPO的低反应性或抵抗,切除甲状旁腺后rHuEPO抵抗现象改善,贫血好转。而且,在原发性甲状旁腺功能亢进患者中亦发现,随着PTH的下降,贫血随之改善[10]。此外,临床研究也发现,纠正SHPT可以改善rHuEPO抵抗。 Chow TL等[9]发现采用PTX纠正SHPT后应用rHuEPO的患者贫血有明显改善,而未用rHuEPO的患者贫血无明显改善,提示PTX纠正SHPT后主要是改善了rHuEPO的疗效,进而改善贫血。 Trunzo JA等[11]研究发现,对于PTX前无贫血的患者,PTX后观察到Hb及Hct有上升的趋势,并且发现PTX后患者对rHuEPO的需求量显著下降,说明rHuEPO抵抗情况得到改善。由此可见,高浓度的PTH是造成MHD并发重度SHPT患者出现rHuEPO抵抗及难治性肾性贫血的关键性原因。
本研究采用自身对照的方法观察PTX前后患者贫血的改善情况,同时观察PTX对rHuEPO疗效的影响。从研究结果看出,PTX前rHuEPO的用量高达(167.77±31.34) U/kg·W,但贫血仍很严重,血Hb只有(88.32±23.17) g/L,Hct为(30.44±7.23)%,远未达标,提示重度SHPT可能是贫血难以纠正的重要原因。PTX后随着iPTH的迅速下降,贫血逐步改善,术后3月血Hb达(103.33±21.71) g/L,Hct达(32.41±6.47)%,均较PTX治疗前有显著改善。此后贫血持续改善,至术后12月,Hb达(121.27±11.36) g/L,Hct达(35.86±4.47)%,贫血治疗完全达标。此外,在贫血逐步改善的同时,rHuEPO用量在逐步减少,至术后6月, rHuEPO用量已降至(103.50±18.67) U/kg·W,与PTX前相比差异有显著性意义,术后12月时rHuEPO仅需要(76.77±15.08) U/kg·W。这些结果证实了采用PTX治疗SHPT可以纠正难治性肾性贫血,减少rHuEPO用量,其机制可能与rHuEPO抵抗的改善有关。
当然,引起贫血及rHuEPO抵抗的常见原因还包括缺铁、感染、营养不良、肿瘤、炎症状态及透析不充分等因素。为了排除上述常见因素对研究结果的影响,本组在PTX前后积极纠正缺铁、感染及炎症状态、营养不良,入组时排除肿瘤及其他系统疾病,同时注意充分透析性(Kt/V>1.4),保持患者的基线水平一致。从研究结果中可以看出,PTX前后患者铁代谢情况(TSAT、SF)、营养状况(ALB)、炎症状态(CRP)及透析充分性(Kt/V)等因素均保持在相对稳定状态,统计学分析无明显差异(P>0.05),从而排除了上述常见因素对贫血的影响。这进一步从侧面说明,PTX后贫血的显著改善及rHuEPO的疗效改善与SHPT的纠正有关。
本研究结果提示,采用PTX纠正重度SHPT可显著改善MHD患者的肾性贫血,同时可减少rHuEPO的用量,提示重度SHPT是影响肾性贫血及rHuEPO疗效的一个重要因素。
[1] Tilman Druoke. Hyporesponsiveness to recombinant human erythropoietin [J]. Nephrol Dial Transplant, 2001,16(suppl7): 25-28.
[2] 姚力,张凌,刘鹏,等.甲状旁腺切除术治疗难治性甲状旁腺功能亢进症89例疗效评价[J]. 中国血液净化, 2009,8(8):431-436.
[3] Stephen J Marx. Hyperparathyroid and Hypoparathyroid Disorders [J]. N Engl J Med, 2000,343:1863-1875.
[4] Nikodimopoulou M, Liakos S. Secondary hyperparathyroidism and target organs in chronic kidney disease [J]. Hippokratia,2011, 15 (Suppl 1): 33-38.
[5] Kause AT, Solid C, Perira BJ, et al. Intractable anemia among hemodialysis patients: a sign of suboptimal management or a marker of disease? [J]. Am J Kidney Dis, 2005, 45(1): 136-147.
[6] Rao DS, Shih MS, Mohini R. Effect of serum parathyroid hormone and bone marrow fibrosis on the response to erythropoietin in uremia [J]. N Engl J Med, 1993, 328(3): 171-175.
[7] Sikole A. Pathogenesis of anaemia in hyperparathyroidism [J].Med Hypotheses, 2000, 54(2): 236-238.
[8] Wu SG, Jeng FR, Wie SY, et al. Red blood cell osmotic fragility in chronically hemodialyzed patients [J]. Nephron,1998, 78: 28-32.
[9] Chow TL, Chan TT, Ho YW, et al. Improvement of anemia after parathyroidectomy in Chinese patients with renal failure undergoing long-term dialysis [J]. Arch Surg,2007,142(7):644-648.
[10] Bhadada SK, Sridhar S, Ahluwalia J, et al. Anemia and thrombocytopenia improves after curative parathyroidectomy in a patient of primary hyperparathyroidism (PHPT) [J]. J Clin Endocrinol Metab,2012,97(5):1420-1422.
[11] Trunzo JA, McHenry CR, Schulak JA, et al. Effect of parathyroidectomy on anemia and erythropoietin dosing in end-stage renal disease patients with hyperparathyroidism [J]. Surgery,2008,144(6):915-918.
Studyonimprovementofrenalanemiaafterparathyroidectomyfortreatmentofsecondaryhyperparathyroidism
ZHAOGuang-ben,YANGNing,XINZhu,HANGHong-dong
(DepartmentofNephrology,theFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116011,China)
ObjectiveTo evaluate the effects of parathyroidectomy (PTX) on renal anemia in maintenance hemodialysis (MHD) patients with severe secondary hyperparathyroidism (SHPT).MethodsThirty-three MHD patients with severe SHPT were enrolled,all these patients were underwent PTX after failure of medical therapy. The iPTH, Ca, P and anemia levels, iron homeostasis, dose of rHuEPO requirement and nutritional state were assessed before and 1,3,6,12 months after PTX, and Kt/V were calculated.ResultsThe levels of iPTH, Ca, P were decreased significantly from 1 month after PTX. The hemoglobin level and hematocrit showed a significant increase at 3 months after PTX, and rHuEPO dose requirement decreased remarkablely from 6 months after PTX. There was no statistically significant difference in serum iron and transferrin saturation, CRP, and the adequacy of dialysis before and after PTX.ConclusionWe conclude that PTX can improve renal anemia and decrease the resistance to rHuEPO therapy at the same time in MHD patients with severe SHPT.
secondary hyperparathyroidism;renal anemia; parathyroidectomy
10.11724/jdmu.2013.04.11
R459.9
A
1671-7295(2013)04-0352-04
赵光本,杨宁,辛竹,等. 甲状旁腺切除术纠正继发性甲状旁腺功能亢进改善肾性贫血的临床研究[J].大连医科大学学报,2013,35(4):352-355.
赵光本(1976-),男,湖北十堰人,主治医师。E-mail:zhgb-2005@163.com
杭宏东,教授。E-mail:hhdyb@yahoo.com.cn
2013-05-14;
2013-06-25)
