香港巨牡蛎与长牡蛎种间配子兼容性
2013-12-16张跃环王昭萍闫喜武霍忠明苏家齐
张跃环,王昭萍,闫喜武,霍忠明,姚 托,苏家齐
(1.中国海洋大学水产学院教育部重点实验室,青岛 266071;2.海洋生物资源可持续利用重点实验室中国科学院南海海洋研究所,广州 510301 3.大连海洋大学水产与生命学院辽宁省贝类良种繁育工程技术研究中心,大连 116023)
配子兼容是指物种间或者物种内的雌雄个体之间精卵能够识别,完成受精作用,从而繁育子代。对于同一物种而言,绝大部分情况下雌雄配子都具有很好的兼容性;但对于种间杂交来讲,会出现配子不兼容或者不对称兼容现象[1]。这种配子不兼容往往会导致种间产生生殖隔离。生殖隔离是指由于各方面的原因,使亲缘关系接近的物种之间在自然条件下不交配,即使能交配也不能产生后代或不能产生可育性后代的隔离机制。生殖隔离如果发生在受精以前,就称为受精前隔离,包括地理隔离、生态隔离、季节隔离、生理隔离、形态隔离和行为隔离等;若隔离发生在受精以后,就称为受精后的生殖隔离,包括杂种不活、杂种不育和杂种衰败等[2]。在自然界中,种间配子不兼容是保证物种单一性的一种有效手段。
对于海洋无脊椎动物而言,生活在重叠区域内的近缘种的生殖隔离大部分是由于种间配子不兼容引发的[3]。学者们先后从受精水平上研究了长牡蛎Crassostrea gigas×熊本牡蛎C.sikamea[4]、长牡蛎C.gigas×美洲牡蛎 C.virginica[5]、紫贻贝 Mytilus edulis× 盖勒贻贝 M.trossulus[1]、3 种热带海胆 Echinometra lucunter×E.viridis×E.lucunter[6]的种间配子不兼容格局,从而进一步解释生殖隔离机制。香港巨牡蛎(Crassostrea hongkongensis)是暖温性近岸生长的一个经济价值极高的种类,喜好高温低盐环境,是我国南方养殖的主要经济种,分布长江以南,核心区为福建、广东、广西,年产量在100多万吨[7]。而长牡蛎(C.gigas)分布在我国长江以北,喜好低温高盐环境,为世界性养殖品种,主要集中在我国辽宁、山东等地,年产量近100万吨。由于生长速度快、环境适应性强、肉味鲜美,深受广大消费者青睐[8]。作为我国最重要的两种牡蛎经济种,从分布范围上,他们之间无生活重叠区;从其生活环境上看,它们生态类型截然相反;从其遗传进化角度上,这两个种类在巨蛎属牡蛎中遗传距离较远,而且种间分化较早,大约在2880万年前发生了种间分歧,并成功进化为两个物种[9]。为了探讨这两个物种间的配子兼容性问题,本文从外界因子(温度、盐度)及内在因子(精子浓度、个体差异水平)水平上检测了它们对其配子兼容性的影响,并且求算了F50临界值,旨在为这两个物种的种间杂交及其遗传进化奠定了理论与实践基础。
1 材料与方法
1.1 实验材料
于2010年5月下旬,采集2龄香港巨牡蛎Crassostrea hongkongensis(广东深圳)和1龄长牡蛎C.gigas(辽宁大连)样本,置于大连庄河海量水产食品有限公司生态虾池进行生态促熟。由于2龄香港巨牡蛎及1龄长牡蛎具有较好的繁殖能力,故本实验选用该年龄段亲本作为实验样品。促熟期间,水温22.5—29.3℃,盐度24—30,pH值7.86—8.92;生态虾池中富含大量的有机碎屑及单胞藻类,可以满足亲本对天然饵料的需求,故亲本性腺可以正常发育。至7月初,两种牡蛎的性腺已经完全成熟。
1.2 实验设计
为了查明最主要外界环境因子温度、盐度对两种牡蛎种间配子不兼容格局影响。考虑到香港巨牡蛎繁殖季节水温一般不高于30℃,盐度大多不低于12[7];而长牡蛎繁殖季节水温基本均在20℃以上,盐度不超过30[8]。本文分别设计 5 个温度(16、20、24、28、32 ℃)梯度及 5 个盐度梯度(10、15、20、25、30),每个梯度重复实验36次,每次均为单对杂交实验(表1)。采用解剖方法获取牡蛎精卵,选取配子优良的个体用于实验。实验在100 mL烧杯中进行,卵子密度控制在40—50个/mL,精子浓度控制在120 000—150 000个/mL。温度实验中,利用恒温箱来控制温度,盐度控制在25;盐度实验中,利用自然海水(盐度30)作为母液,加经过24 h曝气的淡水来配置其它盐度梯度,温度控制在32℃。
海洋无脊椎动物的配子兼容性分析中,精子浓度至关重要,因为它是配子兼容性中的内在因素。通常情况下,较低的浓度会导致种间配子兼容性较差,过高的浓度虽然会得到较高受精率,但经常会造成孵化中畸形率过高。参照 Banks[4],Lyu 和 Allen[5]对牡蛎配子不兼容格局分析,本实验设计了 100、101、102、103、104个/μL 5个精子浓度梯度,其中,精子通过血球计数板来测定密度,实验中卵子密度控制在40—50个/mL。在温度32℃、盐度25的条件下,采用100 mL烧杯作为实验容器,开展36次单对杂交实验(表1)。为了进一步探讨牡蛎个体间差异对配子兼容性的影响,在温度32℃、盐度25、精子浓度104个/μL的条件下,采用建立单对杂交家系(表1)的方法测定个体间差异。其中,受精成功的标志为受精膜举起,释放出两个极体,之后进入2—4细胞卵裂状态;受精率为发生卵裂受精卵数量与总卵量的百分率。

表1 单对杂交家系设计Table 1 The design of diallel cross by one female to one male method
1.3 F50临界值计算
为了探讨温度、盐度、精子浓度及个体差异与配子兼容性之间的关系。参照贻贝[1]及海胆[6,10]配子不兼容分析方法,制定了牡蛎种间配子F50临界值,是指雌雄配子发生50%受精率时的临界温度、盐度、精子浓度及其单对杂交的中个体差异比例。以往学者采用了一种比较繁琐的非线性动态模型来计算配子兼容性,该模型对于海胆比较实用,但是对于贻贝等贝类不太合适。因此,本实验尚未采用以上作者方法,而是参照菲律宾蛤仔[11]及青蛤[12]幼虫饥饿中的不可逆点求算方法,采用如下二次函数公式来计算F50临界值:

式中,y表示受精率(%),x表示温度(℃)、盐度、精子浓度的对数(log[个/μL])、个体间杂交次数,a为二次项系数,b为一次项系数,c为常数。
1.4 数据处理
为了保持方差齐性,所有受精率均转化为反正弦函数Asin,精子浓度转化为log10。利用SPSS18.0统计软件对数据进行分析处理,不同实验组间数据比较采用单因素方差分析方法(Turkey HSD),差异显著性设置为 P <0.05,极显著设置为 P <0.01,Excel作图。
2 结果
2.1 温度对配子兼容性的影响
如图1所示,对长牡蛎GG而言,受精率随着温度的升高先增大而后趋于平稳;至于香港巨牡蛎HH及其杂交组HG,二者受精率均随着温度的升高而增大;杂交组GH受精率为0,也就说在香港巨牡蛎与长牡蛎的杂交过过程中,存在着明显的单向受精现象。在16℃时,杂交组HG受精率(8.28%)高于香港巨牡蛎(1.72%),且都显著小于长牡蛎(28.28%)(P<0.05)(表2)。这主要是由于长牡蛎的精子在较低的温度下具有一定活力,而香港巨牡蛎精子活力较差造成的。20℃时,每个实验组的受精率均得到了明显提高。GG的受精率高达92.45%,显著高于 HH(48.78%)与 HG(38.83%)(P <0.05)(表2)。24—32℃期间,GG 受精率最高接近100%,HH与HG的受精率具有显著提高,且HH的受精率一直高于HG(图1)。32℃时,各实验组受精率均达到最高水平,其中,GG受精率为99.38%,HH为94.58%,HG为86.59%(图1)。经过二次函数模型推算,HG的温度F50临界值介于两亲本GG及HH之间,GG,HG及HH的F50临界值分别为17.12℃,20.29 ℃,21.45 ℃(表 3)。

图1 温度对配子兼容性的影响Fig.1 Effect of temperature on gamete compatibility

图2 盐度对配子兼容性的影响Fig.2 Effect of salinity on gamete compatibility
2.2 盐度对配子兼容性的影响
GG受精率随着盐度的升高而增大,HH及HG 的受精随着盐度升高先增大后减;HH最高受精率出现在盐度18左右,而HG最高受精率出现在盐度25(图2),GH尚未发生受精,受精率为0。在盐度10时,HH受精率最大为46.84%,HG居中为27.30%,GG最小为10.27%,且三者之间存在显著差异(P<0.05)(表4)。在盐度15时,HH受精率仍然最高,但此时GG受精率大于HG,且三者之间差异显著(P<0.05)(表4)。盐度20时,GG与HH受精率大小相似,均显著大于HG(P<0.05)(表4)。盐度25-30期间,GG受精率最高,显著大于HH和HG(P<0.05)(表4)。经过二次函数模型推算,HG的盐度F50临界值为14.70,大于GG的13.12。在图2中,虽然可以看到HH的F50临界值在盐度10.20左右,但是经过二次函数模拟,得不到该临界值,因为模型中的y轴截距已经大于50%(表3)。

表2 温度对配子兼容性影响的方差分析Table 2 Analysis of variance for the effect of temperature on gamete compatibility

表3 不同温度、盐度、精子浓度及个体差异下的F50临界值Table 3 The critical value of F50under different temperature,salinity,sperm concentration and individual variation
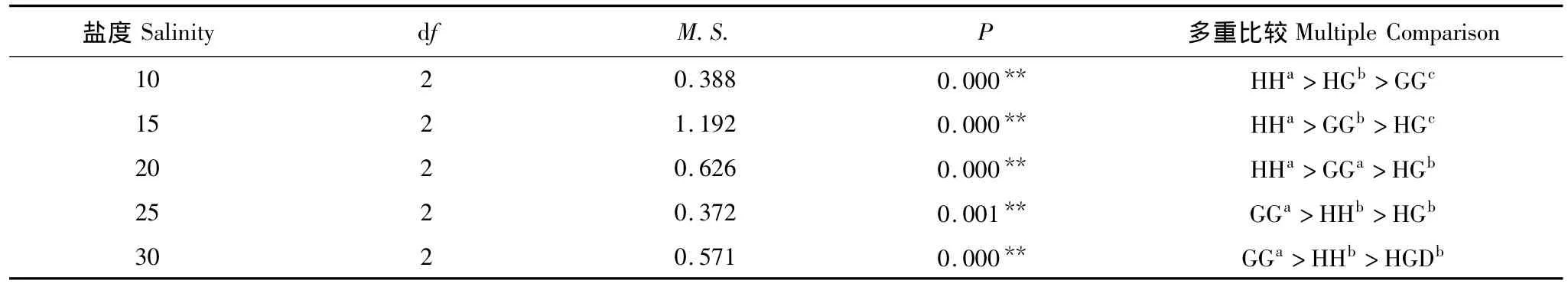
表4 盐度对配子兼容性影响的方差分析Table 4 Analysis of variance for the effect of salinity on gamete compatibility
表5为温度,盐度两种外界环境因子对配子兼容性的交互作用应。对于GG来讲,温度是影响其配子兼容性的主要因子,次要因子为盐度。对于HH而言,盐度是影响其配子兼容性的主要因子,其次为温度。至于HG,温度及盐度的交互作用是影响配子兼容性的主要因子,其次为温度,最后是盐度。
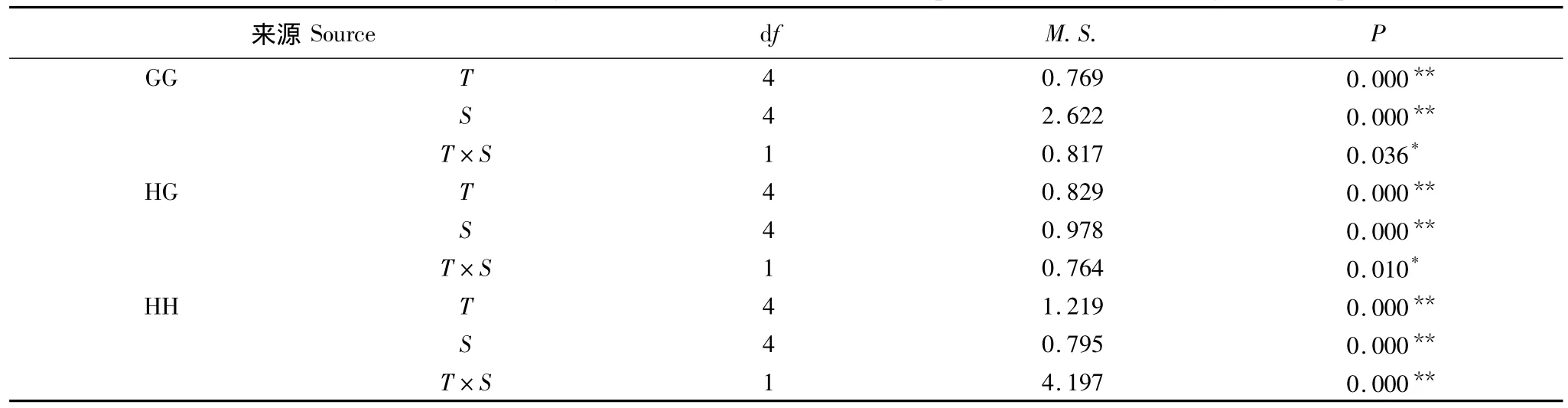
表5 温度及盐度交互作用对配子兼容性的影响Table 5 Analyses of variance showing the interaction effect between temperature and salinity for gamete compatibility
2.3 S精子浓度对配子兼容性的影响
GG受精率几乎不受精子浓度的影响,其受精率在不同精子浓度下均接近100%;HH和HG受精率随着精子浓度增加先快速增加后缓慢增长(图3),GH受精率为0。在精子100个/μL浓度时,GG受精率为97.32%,HH为67.74%,而HG仅为37.98%,且彼此间差异显著(P<0.05)(图3)(表6)。由此可以看出在较低精子浓度下,配子兼容性存在着较大的种内及其种间差异。在精子浓度101—104个/μL过渡过程中,HH及HG受精率随着精子浓度缓慢增长,均显著小于GG受精水平(P<0.05)(图3)(表6)。在精子浓度104个/μL时,GG、HH 及HG 受精率分别为99.47%、90.91%、85.52%(图3)。经过二次函数模型推算,HG 的精子浓度F50临界值为2.40个/μL。由于GG及HH受精率均在50%以上,故二者不存在F50临界值(表3)。
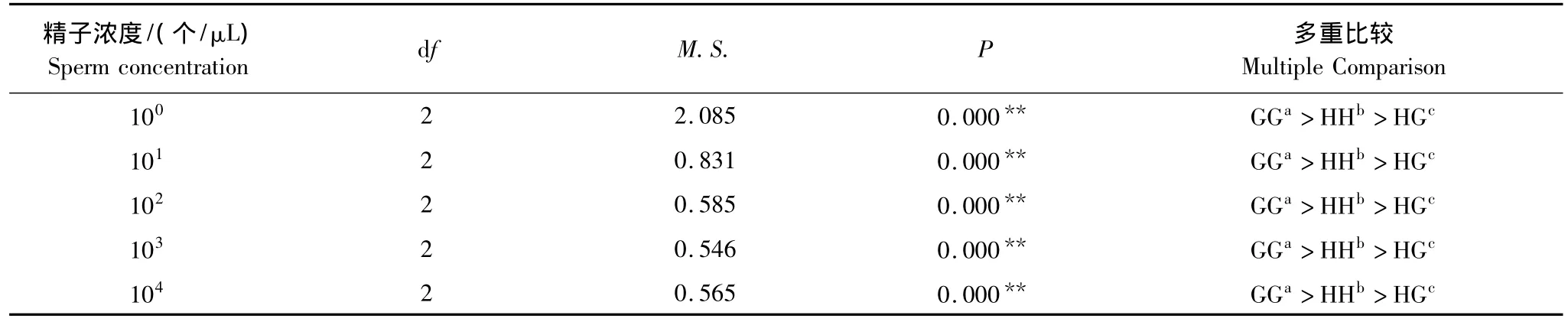
表6 精子浓度对配子兼容性影响的方差分析Table 6 Analysis of variance for the effect of sperm concentration on gamete compatibility
2.4 个体间配子兼容性差异分析
如图4所示,按照上面最佳的优化条件,在240次杂交实验中,GG受精水平最高,平均为96.83%;其次为HH,平均水平为70.98%;受精率最低的是HG,为58.70%,GH受精率仍为0。从HG受精水平上看,实际超过F50临界值的杂交实验次数为164次,但如果按照模拟曲线看为149次,二者较为接近,大约有2/3的比例可以突破种间配子兼容性F50临界值(表3)。至于HH,实际上一共有216次超过了F50临界值,但理论上只有197次,二者仍比较接近,说明动态函数曲线具有较好的拟合性(表3)。为了进一步查明个体间差异对其配子兼容性的影响,作者按照受精水平不同划分了10个受精级别,并计算了各级别受精水平的分布频率。其中,HG在级别1—10均有分布,受精率从3.60%至97.60%分布范围最广,说明种间配子识别存在非常大的个体差异;但平均水平最低,说明种间配子存在一定程度的生殖隔离障碍(图4)(表7)。HH分布在2—10级别受精水平上,受精率从12.0%至98.5%,说明香港巨牡蛎本身就存在较大的个体差异(图4)(表7)。而GG受精水平仅仅分布在9—10级别上,三者中受精水平最高,且受精率相对比较一致,也说明长牡蛎种内配子兼容性较好(图4)(表7)。
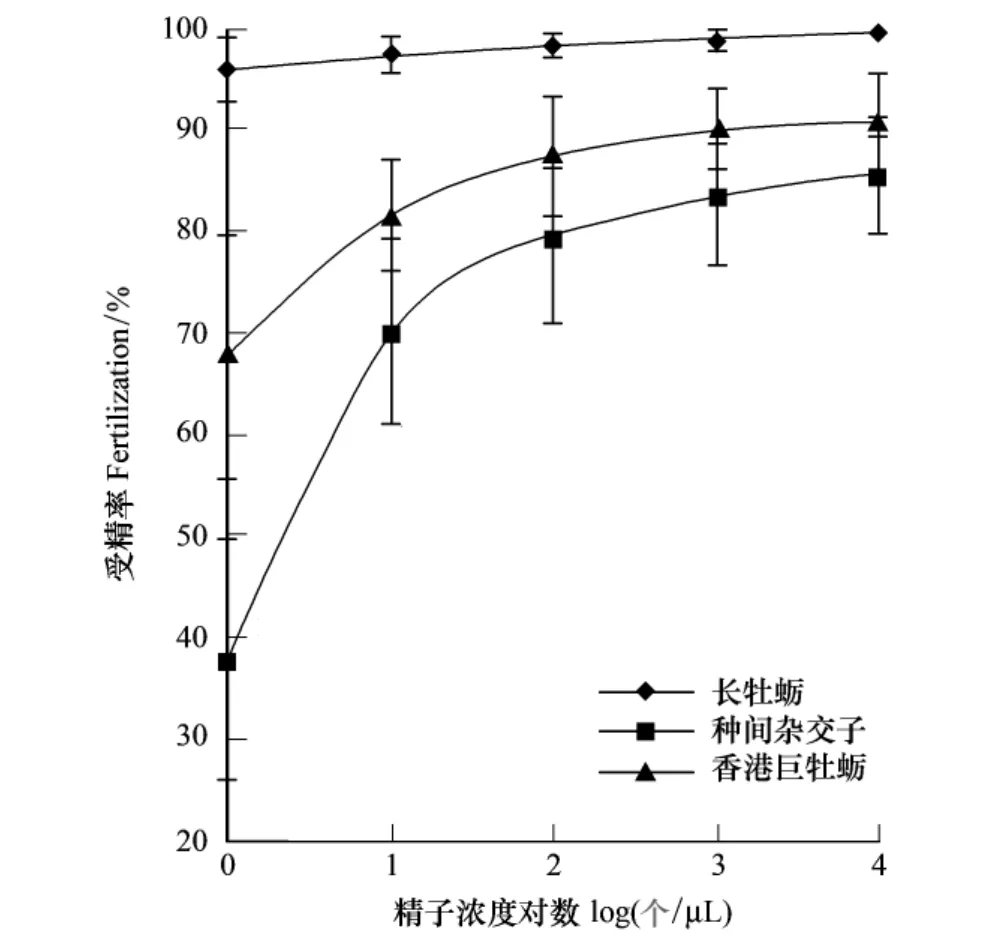
图3 精子浓度对配子兼容性的影响Fig.3 Effect of sperm concentration on gamete compatibility
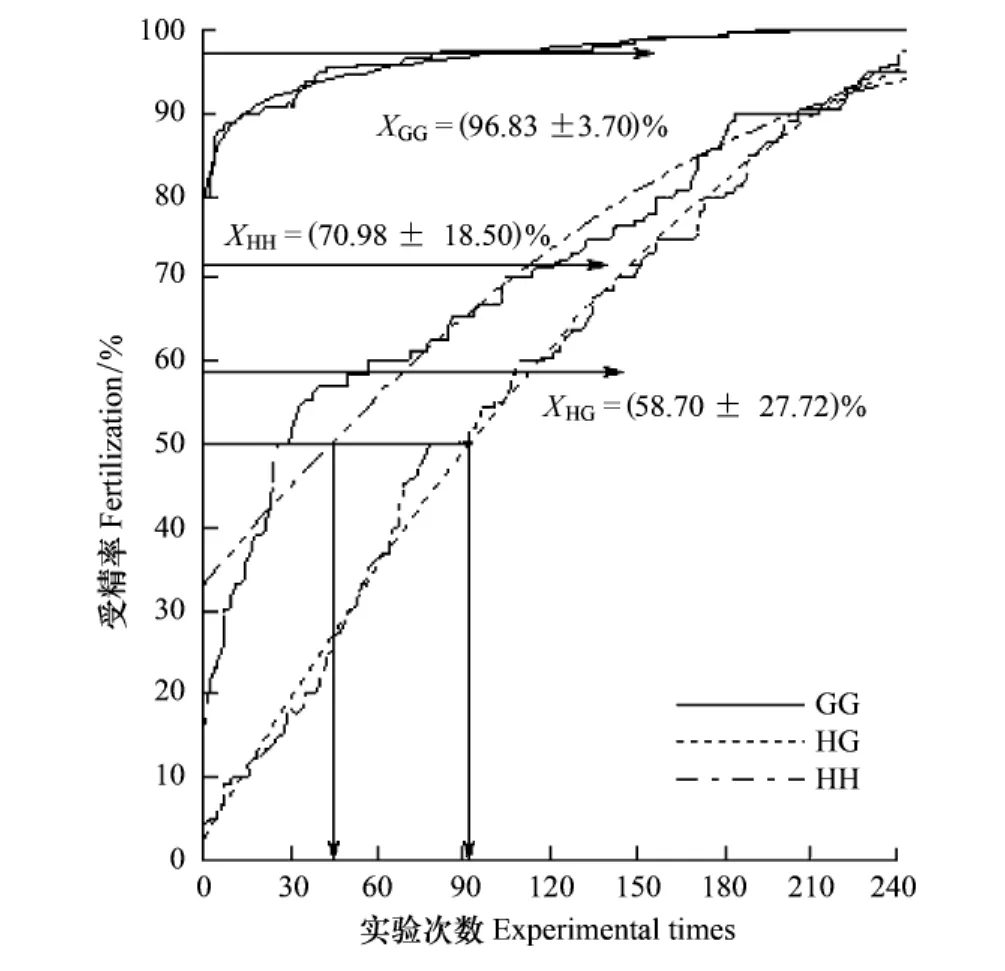
图4 配子兼容性的个体差异比较Fig.4 Comparison of individual variation on gamete compatibility

表7 不同受精水平级别下各实验组分布频率Table 7 Distribution frequency of each experimental group under different sperm concentrations this should be given in the form of table
3 讨论
3.1 单向受精
香港巨牡蛎的卵子可以与长牡蛎的精子受精,而长牡蛎的卵子不能够与香港巨牡蛎的精子受精,也就是说,在香港巨牡蛎与长牡蛎杂交中,存在着明显的不对称受精现象。这种单向受精不受温度、盐度等外界环境因子和内在的精子浓度及个体差异影响,已有研究表明:在精卵识别的过程中,精子结合素蛋白是决定能否受精的一个关键基因家族,这种基因家族进化速度较快,往往导致了不对称受精现象的发生[13-14]。这种单向受精机制引发了不对称的受精前生殖隔离机制,使得种间配子兼容性效应减半。在以往的牡蛎配子兼容性分析中,单向受精比较常见,学者们先后发现了熊本牡蛎C.sikamea(♀)×长牡蛎C.gigas(♂)[15]、近江牡蛎C.rivularis(♀)×美洲牡蛎 C.virginica(♂)[16],熊本牡蛎 C.sikamea(♀)×近江牡蛎 C.ariakensis(♂)[17]具有单向受精现象。香港巨牡蛎卵子可以与长牡蛎精子受精说明,雌性香港巨牡蛎与雄性长牡蛎遗传分化具有一定的相似性;而香港巨牡蛎精子不能与长牡蛎卵子受精说明,香港巨牡蛎雄性与长牡蛎雌性之间存在着一定程度的遗传歧化,这可能是性别非趋同进化的结果[17]。
3.2 外界因子
外界环境因子温度、盐度对香港巨牡蛎与长牡蛎配子兼容性有较大影响。这主要是由于香港巨牡蛎与长牡蛎的生态类型截然相反,一种是喜好高温低盐,另一种是喜好低温高盐[7]。从实验结果中可以看出,温度是影响长牡蛎配子兼容性的最主要因子,而盐度是影响香港巨牡蛎的主要因子,种间配子兼容性主要受到温度、盐度二者交互作用影响。以往学者们的研究对象均是针对分布在相同生活重叠区的近缘种,故他们一般不做温度、盐度这样的外在因子影响分析,而是完全模拟生活区的环境来完成实验,由于本实验对象生活生态型不同,故有必要对其进行探讨、摸索,以便获取更好的种间配子兼容性,有利于以后的种间杂交研究[1,4,6,10]。温度的F50临界值从长牡蛎、杂交子、香港巨牡蛎逐渐升高,说明长牡蛎耐低温能力要强一些,香港巨牡蛎需更要高温环境,杂交子恰恰居于二者中间;盐度的F50临界值长牡蛎最低,说明长牡蛎对盐度具有一定的耐受能力;杂交子较大,表明杂交时应该注意盐度控制,以获取更好的配子兼容性。
3.3 内在因子
通常情况下,精子浓度对配子兼容性有一定影响。学者们发现,在远缘杂交中,提高精子浓度有利于提高种间受精率[17-20]。实验结果表明,随着精子浓度的增加,不管是种内还是种间受精率均得到了提高,但是种间杂交组受精率一直低于种内组,说明存在一定程度的种间配子不兼容。其中,在实验设计的精子浓度中,种间配子精子浓度的F50临界值为2.40个/μL,而种内自交组不存在F50临界值,说明在较低精子浓度情况下,种间配子不兼容性更强一些。随着精子浓度的增大,种间杂交组受精率一直低于香港巨牡蛎自交组,但是他们之间受精相对比较接近,说明种间配子兼容性具有明显的母本效应。
个体差异也是影响配子兼容性的一个重要因素[1-2,4,6]。从实验结果中可以看到,种间配子兼容性存在着较大的个体差异,其受精率分布范围最广,从3.60%至97.60%。在240次单对单双列杂交实验中,有37.92%比例受精率不足50%,62.08%比例受精率超过50%,说明种间配子虽然存在着不兼容,但是不兼容性不强,可以经过筛选优良亲本,获取较高的受精率。从其平均受精水平上看,长牡蛎受精率很高,且比较一致,说明其个体间差异较小;香港巨牡蛎受精率高于杂交子,但是分布范围较广,说明香港巨牡蛎存在着明显的个体差异。
总之,本文发现温度、盐度、精子浓度及个体差异对配子兼容性均具有明显的影响,其F50临界值随着条件不同而变化;而且香港巨牡蛎与长牡蛎之间存在单向受精现象,这可能是由于种间性别非趋同进化造成的;香港巨牡蛎与长牡蛎存在着不对称的受精前生殖隔离,至于受精后隔离机制有待深入研究。
[1] Rawson P D,Slaughter C,Yund P O.Patterns of gamete incompatibility between the blue mussels Mytilus edulis and M.trossulus.Marine Biology,2003,143(2):317-325.
[2] Palumbi S R.Genetic divergence,reproductive isolation,and marine speciation.Annual Review of Ecology and Systematics,1994,25:547-572.
[3] Palumbi S R.Marine speciation on a small planet.Trends in Ecology and Evolution,1992,7(4):114-118.
[4] Banks M A,McGoldrick D J,Borgeson W,Hedgecock D.Gametic incompatibility and genetic divergence of Pacific and Kumamoto oysters,Crassostrea gigas and C.sikamea.Marine Biology,1994,121(1):127-135.
[5] Lyu S,Allen S K.Effect of sperm density on hybridization between Crassostrea virginica,Gmelin and C.gigas(Thunberg).Journal of Shellfish Research,1999,18(2):459-464.
[6] McCartney M A,Lessios H A.Quantitative analysis of gametic incompatibility between closely related species of neotropical sea urchins.The Biological Bulletin,2002,202(2):166-181.
[7] Xiao S.Studies on Quantitative Genetics and Selective Breeding of the Hongkong Oyster Crasstrea Hongkongensis[D].Guangzhou:South China Sea Institute of Oceanology,Chinese Academy of Sciences,2010:28-29.
[8] Zhang Y H,Wang Z P,Yan X W,Yu Z F,Huo Z M,Yao T,Liu X H,Yu R H.Phenotypic traits of both larvae and juvenile Crasstrea hongkongensis and C.gigas.Acta Ecologica Sinica,2012,32(4):1105-1114.
[9] Ren J F,Liu X,Jiang F,Guo X M,Liu B.Unusual conservation of mitochondrial gene order in Crassostrea oysters:evidence for recent speciation in Asia.BMC Evolutionary Biology,2010,10(1):394.
[10] Geyer L B,Palumbi S R.Conspecific sperm precedence in two species of tropical sea urchins.Evolution,2005,59(1):97-105.
[11] Yan X W,Zhang Y H,Huo Z M,Yang F,Zhang G F.Effects of starvation on larval growth,survival,and metamorphosis of Manila clam Ruditapes philippinarum.Acta Ecologica Sinica,2009,29(6):327-334.
[12] Yang F,Zhang Y H,Yan X W,Zhang G F.Effects of starvation and refeeding on larval growth,survival,and metamorphosis of clam Cyclina sinensis.Acta Ecologica Sinica,2008,28(5):2052-2059.
[13] Springer S A,Moy G W,Friend D S,Swanson W J,Vacquier V D.Oyster sperm bindin is a combinatorial fucose lection with remarkable intraspecies diversity.International Journal of Developmental Biology,2008,52(5/6):759-768.
[14] Wu Q,Li L,Zhang G F.Crassostrea angulata bindin gene and the divergence of fucose-binding lectin repeats among three species of Crassostrea.Marine Biotechnology,2011,13(2):327-335.
[15] Camara M D,Davis J P,Sekino M,Hedgecock D,Li G,Langdon C J,Evans S.The Kumamoto oyster Crassostrea sikamea is neither rare nor threatened by hybridization in the Northern Ariake sea,Japan.Journal of Shellfish Research,2008,27(2):313-322.
[16] Allen S K,Gaffney P M,Scarpa J,Bushek D.Inviable hybrids of Crassostrea virginica(Gmelin)with C.rivularis(Gould)and C.gigas(Thunberg).Aquaculture,1993,113(4):269-289.
[17] Xu F,Zhang G F,Liu X,Zhang S D,Shi B,Guo X M.Laboratory hybridization between Crassostrea ariakensis and C.sikamea.Journal of Shellfish Research,2009,28(3):453-458.
[18] Ke C H,Tian Y,Li S Q,Li F X.Preliminary studies on hybridization of three species of abalone.Marine Sciences,2000,24(11):39-41.
[19] Zheng H P,Xu F,Zhang G F.Crosses between two subspecies of bay scallop Argopecten irradians and heterosis for yield traits at harvest.Aquaculture Research,2011,42(4):602-612.
[20] Zhang G F,Zheng H P.Aquaculture Genetics in bay Scallop.Beijing:Science Press,2009:92.
参考文献:
[7] 肖述.香港巨牡蛎(Crassostrea hongkongensis)数量遗传学与选择育种研究[D].广州:中国科学院南海海洋研究所,2010:28-29.
[8] 张跃环,王昭萍,闫喜武,虞志飞,霍忠明,姚托,刘晓赫,于瑞海.香港巨牡蛎与长牡蛎幼虫及稚贝的表型性状.生态学报,2012,32(4):1105-1114.
[12] 杨凤,张跃环,闫喜武,张国范.饥饿和再投喂对青蛤 (Cyclina sinensis)幼虫生长、存活及变态的影响.生态学报,2008,28(5):2052-2059.
[18] 柯才焕,田越,周时强,李复雪.杂色鲍与皱纹盘鲍、盘鲍杂交的初步研究.海洋科学,2000,24(11):39-41.
[20] 张国范,郑怀平.海湾扇贝养殖遗传学.北京:科学出版社,2009:92-92.
