年龄、性别及季节因素对千岛湖岛屿社鼠最大活动距离的影响
2013-12-16沈良良鲍毅新
叶 彬,沈良良,鲍毅新,张 旭
(浙江师范大学生态研究所,金华 321004)
动物对空间资源的利用表现为一定的巢区范围,并在其中完成动物的生长、繁殖、觅食等日常活动[1]。动物在巢区内的活动受到其行为、生理、种群密度的重要影响,在种群内部和外部因子作用下呈现复杂的变化[2-4],其活动能力可间接地反映动物个体的能量需求及与生态或环境因子之间的相互作用[5]。有研究表明,个体的活动能力不仅受到食物、配偶资源的可获得性等外部因素的影响[6-8],还与性别、年龄的差异性等内部因素密切有关[9-12]。最大活动距离是对动物在巢区中活动能力大小的直接反映,研究动物的最大活动距离不仅能够丰富巢区行为理论,还能反映动物个体和种群对复杂生态因子的响应。
诸多关于小型哺乳动物巢区及活动距离的研究都揭示了巢区行为与生物因子或非生物因子的关系,但大多数研究是在开放生境或人为围栏中进行的,如对东方田鼠(Microtus fortis)[4]、野生小家鼠(Mus domesticus)[13]、黑腹绒鼠(Eothenomys melanogaster)[12]、社鼠(Niviventer confucianus)[14]等的研究,而在具有复杂地形和特殊生境资源的岛屿环境下,关于动物在巢区中活动的研究还缺乏系统的分析。隔离的岛屿种群在数量变化、行为、形态学上都表现出与陆地种群的不同,在岛屿隔离的环境和种群内部因素共同作用下,小型哺乳动物的形态学进化在不断加快,并呈现出特殊的岛屿效应[15-17]。在这种岛屿化的进化压力下,小型哺乳动物的活动能力如何受到隔离岛屿环境的影响则有待探讨。本研究以千岛湖岛屿社鼠为研究对象,探讨社鼠在隔离岛屿环境下最大活动距离的特征。
1 方法
1.1 研究地概况
千岛湖位于浙江省西部淳安县和建德市境内(29°22′—29°50′N,118°34′—119°15′E),是1959 年因建设新安江电站大坝而形成的大型人工湖泊,因湖内有2500 m2以上岛屿1078个而得名,是典型的岛屿化生境,属亚热带季风气候区北缘,气候温暖湿润,四季分明。本研究的样地选择在属于千岛湖桐子坞岛范围的2个无名岛屿,分别记作 A 岛(29°33′27.37″N,118°52′51.55″E)和 B 岛(29°33′56.96″N,118°53′30.43″E),面积分别为5.54 hm2和5.80 hm2,相距近1200 m且中间隔有多个岛屿,2岛植被类型相似,均由阔叶林、针叶林及灌木组成[18]。
1.2 社鼠标志重捕
2009年7—11月及2010年3—11月,使用捕鼠笼诱捕进行社鼠的标志重捕,2岛分别放置205个和206个捕鼠笼,笼距10 m,捕鼠笼布放位置如图1所示,尽量满足全岛均匀布笼,并避开岛屿上陡峭的岩石裸露区、岛屿外围经常被水淹没以及无植被区域等不适于布笼的区域(用虚线表示)。以红枣为饵料,每月标志重捕10 d,采用改进的切趾标志编码系统对社鼠进行编号[18-19],同时记录个体的捕获位置、性别、体重等数据。
1.3 季节和年龄组划分
根据千岛湖地区气候特点,将每年的3—5月划分为春季,6—8月划分为夏季,9—11月划分为秋季,由于冬季气温较低进笼社鼠的死亡率较高,故未在冬季进行诱捕。将各岛2a重捕数据按季节合并,按照社鼠体重划分年龄组,其中体重≤35.0 g为幼年组,35.0 g<体重≤50.0 g为亚成年组,50.0 g<体重≤80.0 g为成年组,体重>80.0 g为老年组[20-21]。本研究持续时间较长,个体随着生长其年龄将发生变化,因此考虑到个体在不同季节间体重增长,划分其在各自季节的年龄组。
1.4 最大活动距离计算
对每个岛上重捕次数不小于4次的社鼠进行最大活动距离的计算[12]。使用Biotas 2.0,根据个体的活动轨迹,计算相邻2次重捕时,相隔最远的2个重捕地点间的直线距离作为个体的最大活动距离,以作为社鼠的活动能力指标[9],由于所选岛屿形状无规则并呈突出的半岛状,某些个体活动时会绕过半岛水湾,对于这样的个体则根据绕过水湾的折线距离计算。将2岛所得社鼠最大活动距离数据整理,利用PASW Statistics 18.0进行统计分析,数据分析之前利用Kolmogorov-Smirnov检验数据是否符合正态分布,若不符合,则对数据进行自然对数转换进而使用独立样本T检验或单因素方差分析,若仍不符合方差分析条件,则使用Mann-Whitney U test进行非参数检验,其中P<0.05为差异显著水平,P<0.01为差异极显著水平。使用Origin 8进行最大活动距离对体重的一元线性回归分析。

图1 A岛和B岛捕鼠笼布放方式示意图(虚线外表示岛屿上不适于布笼的区域)Fig.1 Location of cages for trapping in island A and B(Areas outside the dotted line is not applicable to locating cages on the island)
2 结果
整个取样期间,A岛捕获社鼠96只,释放1193笼次,B岛捕获社鼠81只,释放1047笼次。由于社鼠年龄不断增长,同一社鼠个体在不同季节可划分为不同的年龄段,经统计,整个取样期间A岛与B岛重捕4次以上的社鼠个体数分别为101只,82只。
2.1 岛屿差异
A岛与B岛社鼠的平均最大活动距离分别为(99.32±7.12)m,(86.14±6.87)m,两岛最大活动距离差异不显著(t=1.342,df=181,P>0.05),因而在以下分析中均将两岛的数据合并计算。
2.2 不同年龄的最大活动距离
2个岛屿内幼年、亚成年、成年及老年社鼠平均最大活动距离分别为(55.68±8.23)m,(72.48±7.76)m,(116.47±7.70)m,(109.20±16.36)m,4 个年龄组间差异极显著(F3,179=12.422,P<0.01)。经 LSD 法(Least-significant difference)多重比较,幼年鼠最大活动距离与亚成年鼠之间差异不显著(P>0.05),但均极显著小于成年鼠和老年鼠(幼年与成年:P<0.01;幼年与老年:P<0.01);亚成年鼠与成年鼠最大活动距离之间差异极显著(P<0.01),与老年鼠之间差异显著(P<0.05);成年鼠最大活动距离虽大于老年鼠,但差异不显著(P>0.05)(图2)。
雄性社鼠4个年龄组最大活动距离之间方差不同质,故采用Mann-Whitney U test非参数检验进行两两比较。结果显示,雄鼠成年与幼年、亚成年最大活动距离之间均存在极显著差异(成年与幼年:U=-3.950,P<0.01;成年与亚成年:U=-3.898,P<0.01),雄鼠老年与幼年最大活动距离之间差异显著(U=-2.308,P<0.05),其他组间显著不差异(表1,图2)。

表1 雄性社鼠不同年龄组最大活动距离两两比较Table 1 Pair-compare of the maximum movement distance of male Niviventer confucianus among different age groups
雌性社鼠没有重捕4次以上的老年组个体,而在幼年、亚成年、成年最大活动距离之间存在极显著差异(F2,89=5.391,P<0.01),经LSD法多重比较,幼年雌鼠最大活动距离与成年雌鼠之间存在极显著差异(P<0.01),而与亚成年最大活动距离之间差异不显著(P>0.05),但成年雌鼠与亚成年雌鼠最大活动距离之间差异显著(P<0.05)(图2)。
2.3 不同性别的最大活动距离
2个岛屿内雄性社鼠的平均最大活动距离为(107.86±7.47)m,雌性社鼠的平均最大活动距离为(79.13±6.36)m,两者差异极显著(t=3.041,df=181,P<0.01)。
幼年雄鼠与雌鼠最大活动距离之间经Mann-Whitney U test检验,差异不显著(U=-0.843,P>0.05);亚成年雄鼠与雌鼠最大活动距离之间同样差异不显著(t=0.528,df=56,P>0.05);成年雄鼠与雌鼠最大活动距离之间存在极显著差异(t=3.519,df=85,P<0.01);老年组中没有重捕4次以上的雌性个体,故性别差异无从比较(图2)。
2.4 不同季节的最大活动距离
2.4.1 最大活动距离的季节差异
春夏秋3个季节社鼠的平均最大活动距离分别为 (81.25±6.92)m,(104.12±7.92)m,(113.44±15.58)m,3个季节间存在极显著差异(F2,180=4.835,P<0.01),其中春季最大活动距离显著小于夏季(P<0.01)和秋季(P<0.05),但夏季与秋季之间差异并不显著(P>0.05)。
2.4.2 不同年龄社鼠最大活动距离的季节差异
幼年社鼠秋季无重捕4次以上的个体,最大活动距离在春、夏2个季节中差异不显著(t=-0.995,df=24,P>0.05);亚成年社鼠最大活动距离在3个季节间差异极显著(F2,55=5.985,P<0.01),经LSD法多重比较,春季与夏季亚成年鼠最大活动距离差异显著(P<0.05),与秋季差异极显著(P<0.01),而夏秋2季之间差异不显著(P>0.05),呈现春季<夏季<秋季;成年社鼠最大活动距离3个季节间无显著性差异(F2,96=1.162,P>0.05),且各个季节组之间差异均不显著(P>0.05);老年社鼠春季只有1个个体,因此对夏、秋2季老年社鼠最大活动距离进行T检验,二者差异并不显著(t=-0.495,df=9,P>0.05)(图3)。
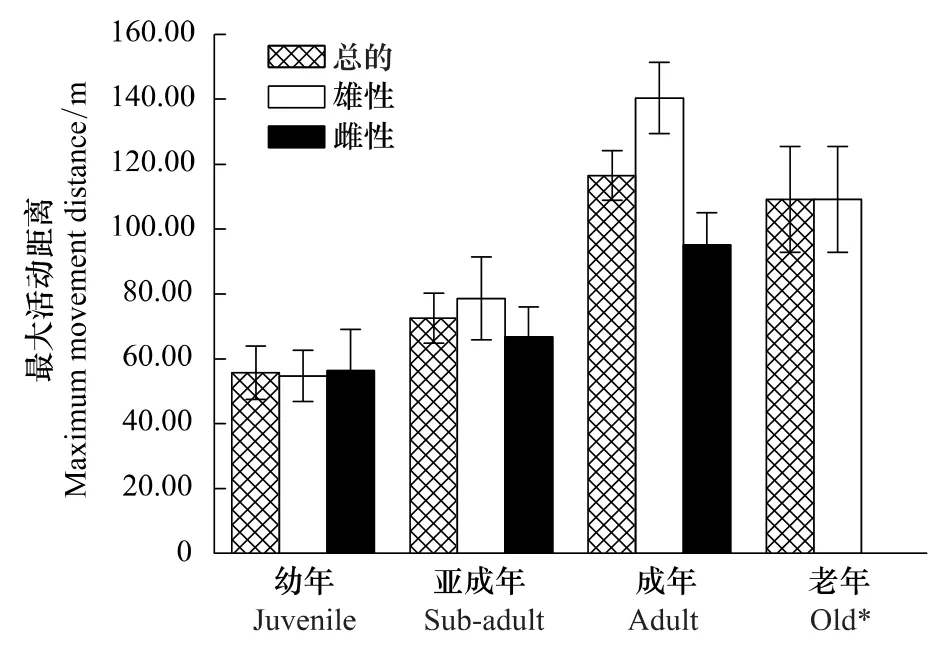
图2 社鼠最大活动距离的性别和年龄差异Fig.2 Difference of the maximum movement distance of Niviventer confucianus in opposite-sex and different age groups
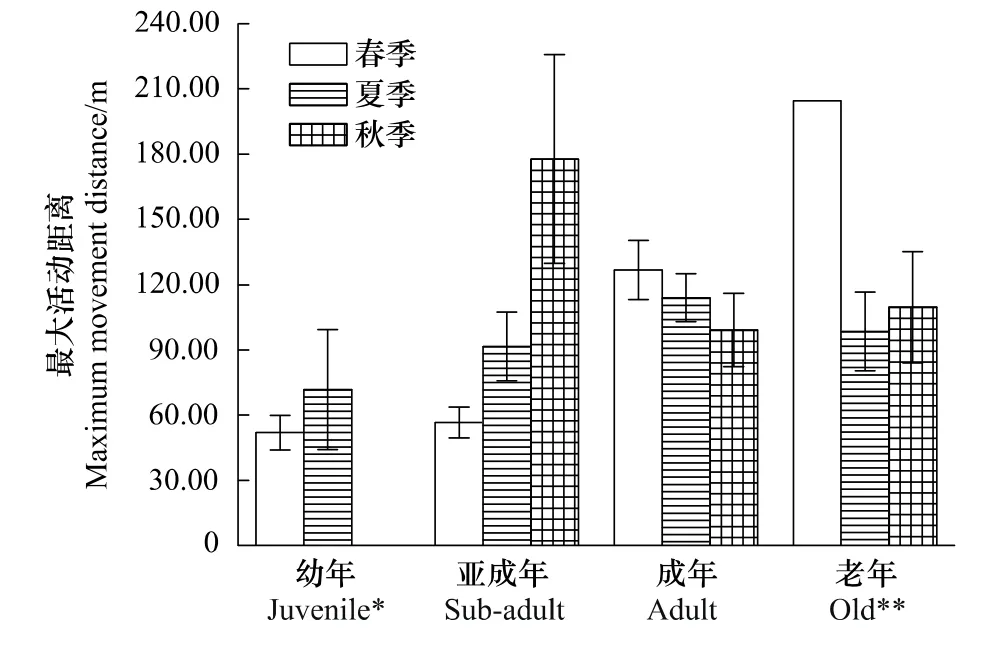
图3 年龄对春、夏、秋社鼠最大活动距离的影响Fig.3 Age effects of the maximum movement distance of Niviventer confucianus in different seasons
2.4.3 不同性别社鼠最大活动距离的季节差异
雄性社鼠在春、夏、秋3个季节的巢区面积表现为春季<夏季<秋季,但3个季节间差异不显著(F2,88=3.015,P>0.05);雌性社鼠的最大活动距离在3个季节中同样表现为春季<夏季<秋季,也没有显著性差异(F2,89=2.668,P>0.05)(图 4)。
春季雄鼠的最大活动距离显著大于雌鼠(t=2.215,df=91,P<0.05),夏秋2季虽然雄鼠的最大活动距离均比雌鼠大,但2个季节均没有显著性差异(夏季雄鼠与雌鼠:t=1.651,df=70,P>0.05;秋季雄鼠与雌鼠:t=1.695,df=16,P>0.05)(图4)。
2.5 最大活动距离与体重的关系
对社鼠最大活动距离自然对数与体重做一元线性回归分析,结果显示最大活动距离与体重具有极显著的正相关性(R2=0.167,P<0.01)(图5)。
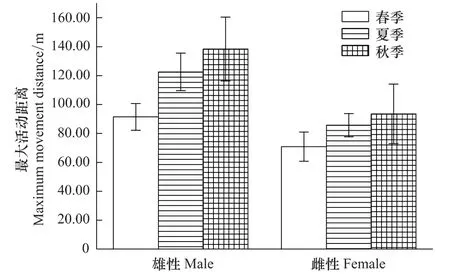
图4 性别对春、夏、秋社鼠最大活动距离的影响Fig.4 Sexual effects of the maximum movement distance of Niviventer confucianus in different seasons

图5 社鼠的最大活动距离自然对数与体重的关系Fig.5 Correlation of natural logarithm of the maximum movement distance and weight of Niviventer confucianus
3 讨论
3.1 年龄差异
小型啮齿动物的年龄直接反映在体重的增长上[22-24],随着个体的生长,对能量和资源的需求量逐渐增大,势必会增大获取资源的渠道——增大活动距离或范围。社鼠从幼年到亚成年,其最大活动距离不存在显著差异(P>0.05),而到了成年和老年,最大活动距离与幼年和亚成年之间的差异变得显著或极显著(成年与幼年:P<0.01,成年与亚成年P<0.01;老年与幼年:P<0.01,老年与亚成年:P<0.05),表明成年之后社鼠的最大活动距离显著增加了,无论雄性还是雌性社鼠均符合这一特点(图2)。大量研究表明,通常情况下哺乳动物个体的巢区面积和活动距离会随着体重的增加而增大[2,25-27],本研究同样得出了类似的结论,千岛湖岛屿社鼠的最大活动距离与体重有极显著的正相关关系(图5)。并且由于千岛湖地区成年和老年社鼠是繁殖的主体[24],繁殖过程中个体不仅需要寻找合适的配偶,还需更多高质量的食物资源以满足繁殖耗费,这很可能是造成成年、老年与幼年、亚成年最大活动距离极显著或显著差异的主要原因。
3.2 性别差异
性别差异普遍影响到小型哺乳动物的行为生态学[28],无论个体在巢区内部的活动还是在不同家群间的扩散都存在性别差异[11,29-30]。然而也有研究表明雌雄个体的活动距离不受性别影响[9,12]。在本研究中,千岛湖岛屿上雄性社鼠的最大活动距离极显著大于雌性社鼠(t=3.041,df=181,P<0.01),但不同年龄雌雄间表现有所不同,其中幼年雄雌之间、亚成年雄雌之间没有显著差异(幼年雄雌:U=-0.843,P>0.05;成年雄雌:t=0.528,df=56,P>0.05),而成年雄鼠与成年雌鼠差异极显著(t=3.519,df=85,P<0.01)。这表明随着年龄增长,雄性和雌性社鼠的活动能力也都随之提高。只有不断扩展活动范围才能获得充足资源,以满足生长过程中的消耗,但这种活动范围的扩展很可能在雌雄两性中存在着不平衡,参与繁殖的成年雄性社鼠比成年雌性运动得更远,这样才可得到更好的配偶资源而使繁殖成功最大化[31]。春季雄鼠最大活动距离显著大于雌鼠(t=2.215,df=91,P<0.05),该时期怀孕或哺乳的雌鼠维持较小活动范围有利于提高自身及子代的存活率[32]。但以往关于巢区的研究显示,春季雄性社鼠的巢区面积与雌鼠之间并无显著差异[18],说明春季社鼠繁殖期时活动范围的增加与巢区面积的变化是不一致的,只体现在距离增加上,很可能归结于隔离岛屿上活动面积和资源的有限性,制约了社鼠的活动。另外,夏季和秋季雄鼠与雌鼠最大活动距离差异不显著(夏季:t=1.651,df=70,P>0.05;秋季:t=1.695,df=16,P>0.05),夏季是社鼠的非繁殖高峰期,雌性在繁殖结束后不会再受到繁殖期特殊生理状态的限制,因而活动范围有所扩大;秋季虽然是另一繁殖高峰期,但社鼠可能存在对越冬食物资源的保护行为[33]而使两性间活动差异不显著。
3.3 季节差异
一般说来,鼠类在繁殖期间巢区面积和活动距离比其繁殖停止后要大[11,28,34],千岛湖岛屿环境下的社鼠在4—5月和9—10月为繁殖高峰期,在秋季11月份繁殖基本结束[24],此外,以往研究发现A岛与B岛种群数量动态表现为4—6月为数量高峰期,9—11月为低潮期[35],季节间种群密度的变化可能也是导致社鼠活动距离季节差异的因素。本研究发现,4个年龄组中,仅亚成年社鼠最大活动距离在春、夏、秋3个季节间差异极显著(F2,55=5.985,P<0.01),由于春季是社鼠的繁殖高峰期之一,成年和老年个体在资源竞争上占优势,亚成年个体可能被排挤到很小的活动范围,夏季随着繁殖结束,亚成年个体受到的排挤作用较小,到了秋季种群密度降低种内竞争减弱,亚成年可在更大范围利用资源,并且部分亚成年个体参与繁殖[24],可能也是导致活动范围增加的因素。雄性和雌性社鼠最大活动距离的季节变化均表现为秋季>夏季>春季(F2,88=3.015,P>0.05),与以往研究的巢区面积差异雄性:夏季>秋季>春季、雌性:秋季>春季>夏季都不一致[18],表明雄鼠秋季最大活动距离是最大的,但秋季巢区面积不如夏季大,且雌鼠春季最大活动距离小于夏季,而春季巢区面积则比夏季大。这种最大活动距离与巢区面积的不一致,可能是由于岛屿环境中各种内外因子共同作用导致的,初步认为雄性社鼠在秋季受到的竞争压力降低,而岛屿大小及资源的有限性[15,36-37]又使在扩大活动距离时并未伴随巢区的增加;雌鼠可能由于在种群密度较高的夏季,获取食物、空间等资源的耗费增大,而形成最大活动距离与巢区面积的不一致变化。这种内外因子对社鼠最大距离和巢区面积的复杂作用还有待进一步研究。
综上所述,岛屿环境中社鼠的最大活动距离随着年龄增长而显著增加,雄性社鼠的最大活动距离显著大于雌性,且不同季节下社鼠的繁殖期、种群数量动态等的变化可能对其最大活动距离影响显著。这不仅与不同年龄段、性别社鼠的生理生态有关,还受到不同季节气候、种群内部动态及岛屿资源可利用性等外部因素的作用。隔离岛屿环境的特殊性对小型兽类种群巢区和空间利用的影响仍待深入研究。
[1] Burt W H.Territoriality and home range concepts as applied to mammals.Journal of Mammalogy,1943,24(3):346-352.
[2] Haskell J P,Ritchie M E,Olff H.Fractal geometry predicts varying body size scaling relationships for mammal and bird home ranges.Nature,2002,418(6897):527-530.
[3] Giuggioli L,Abramson G,Kenkre V M,Parmenter R R,Yates T L.Theory of home range estimation from displacement measurements of animal populations.Journal of Theoretical Biology,2006,240(1):126-135.
[4] Yang Y W,Liu J K,Liu Z.Effects of external and intrinsic factors on home range size in reed vole populations.Acta Zoologica Sinica,2005,51(2):205-214.
[5] Xu J L,Zhang X H,Zhang Z W,Zheng G M,Ruan X F,Zhang K Y.Home range and habitat use of male Reeves′s pheasant(Syrmaticus reevesii)in winter in Dongzhai National Nature Reserve,Henan Province.Chinese Biodiversity,2005,13(5):416-423.
[6] Huang Z H,Zhou Q H,Huang C M,Meng Y J,Wei H.Home range and daily ranging distance of Francois′langur(Trachypithecus francoisi)in Nonggang Nature Reserve,Guangxi,China.Acta Theriologica Sinica,2011,31(1):46-54.
[7] Kong L X,Zhang H,Ren J,Sun Y B,Song P F,Guo C.Variations in home range of Callosciurus erythraeus during different breeding periods.Acta Theriologica Sinica,2011,31(3):251-256.
[8] Cai L Y,Xu Y P,Jiang P P,Ding P,Yao X H,Xu X R,Wang G B.Home range and daily moving distance of Elliot′s pheasant.Journal of Zhejiang University:Science Edition,2007,34(6):679-683.
[9] Zhou Y L,Wang L M,Bao W D,Hou X X.A study on home range and movement distance of Phodopus roborovskii.Acta Scientiarum Naturalium Universitatis Neimongol,1998,29(2):258-263.
[10] Wu D L,Deng X F,Wang G H,Gan Z P.Home range of A.Draco(Barett Hamilton).Acta Theriologica Sinica,1987,7(2):140-146.
[11] Dong W H,Hou X X,Yang Y P.Study on home range of Striped Hamster.Acta Theriologica Sinica,1989,9(2):103-109.
[12] Bao Y X,Zhuge Y.An ecological study on Eothenomys melanogaster.Acta Theriologica Sinica,1986,6(4):297-305.
[13] Chambers L K,Singleton G R,Krebs C J.Movements and social organization of wild house mice(Mus domesticus)in the wheatlands of Northwestern Victoria,Australia.Journal of Mammalogy,2000,81(1):59-69.
[14] Wang Y,Hu J C,Zhan L M.Study on spatial patterns of Niviventer Confucianus population at Tangjiahe Natural Reserve,Sichuan Province,China.Sichuan Journal Zoology,1994,13(2):67-68.
[15] Millien V.Mammals evolve faster on smaller islands.Evolution,2011,65(7):1935-1944.
[16] Millien V.Morphological evolution is accelerated among island mammals.PLoS Biology,2006,4(10):1863-1868.
[17] Forsman A,Merila J,Ebenhard T.Phenotypic evolution of dispersal-enhancing traits in insular voles.Proceedings of the Royal Society BBiological Sciences,2011,278(1703):225-232.
[18] Shen L L,Bao Y X,Zhang X,Wei D Z,Liu J.Effect of different seasons and sex of Niviventer confucianus on islands at Thousand Island Lake.Journal of Zhejiang Normal University:Natural Sciences,2011,34(3):328-332.
[19] Wan X R,Zhong W Q.A revised convenient toe-clipping system for rodent species.Chinese Journal of Zoology,2001,36(5):36-39.
[20] Bao Y X,Zhuge Y.The age estimation and age structure in the population of Rattus Niviventer confucianus.Acta Theriologica Sinica,1984,4(2):127-137.
[21] Zhang J.Studies on the population ecology of sulphur bellied rat.Acta Theriologica Sinica 1993,13(3):198-204.
[22] Zhang T Z,Cui Q H,Lian X M,Su J P.Rodent pest control on reclaimed forest and pasture land from cropping——Studies on population age structure of large field mouse.Pratacultural Science,2006,23(2):67-70.
[23] Pan S C,Yang Z X,Yang X Q,Gui X X,Li M.Carcass weight index dividing population age for Mus musculus.Guizhou Agricultural Sciences,2006,34(S1):18-20.
[24] Sun B,Bao Y X,Zhang L L,Zhao Q Y.Age-structure and reproduction investigation on Niviventer confucianus living on islands at Qiandao Lake in autumn.Acta Theriologica Sinica,2009,29(3):112-119.
[25] Milton K,May M L.Body weight,diet and home range area in primates.Nature,1976,259(5543):459-462.
[26] Walter J,Carbone C,Fulford J,Brown J H.The scaling of animal space use.Science,2004,306(5694):266-268.
[27] White E C,Dikangadissi J T,Dimoto E,Karesh W B,Kock M D,Abiaga N O,Starkey R,Ukizintambara T,White L J T,Abernethy K A.Home-range use by a large horde of wild Mandrillus sphinx.International Journal of Primatology,2010,31(4):627-645.
[28] Farentinos R C.Seasonal changes in home range size of tassel-eared squirrels(Sciurus aberti).The Southwestern Naturalist,1979,24(1):49-62.
[29] Bowler D E,Benton T G.Causes and consequences of animal dispersal strategies:relating individual behaviour to spatial dynamics.Biological Reviews,2005,80(2):205-225.
[30] Pasch B,Koprowski J L.Sex differences in space use of Chiricahua fox squirrels.Journal of Mammalogy,2006,87(2):380-386.
[31] Schradin C,Pillay N.Female striped mice(Rhabdomys pumilio)change their home ranges in response to seasonal variation in food availability.Behavior Ecology,2006,17(3):452-458.
[32] Mikesic D G,Drickamer L C.Factors affecting home-range size in house mice(Mus musculus domesticus)living in outdoor enclosures.American Midland Naturalist,1992,127(1):31-40.
[33] Vlasman K L,Fryxell J M.Seasonal changes in territory use by red squirrels,Tamiasciurus hudsonicus,and responses to food augmentation.Canadian Journal of Zoology,2002,80(11):1957-1965.
[34] Ortega J C.Reproductive biology of the rock squirrel(Spermophilus variegatus)in southeastern Arizona.Journal of Mammalogy,1990,71(3):448-457.
[35] Zhang X,Bao Y X,Liu J,Lin J J,Shen L L,Wang Y N.A suggestion on the estimation method of population sizes of Niviventer confucianus in Land-bridge island.Acta Ecologica Sinica,2012,32(5):1562-1569.
[36] Adler G H,Levins R.The island syndrome in rodent populations.The Quarterly Review of Biology,1994,69(4):473-490.
[37] Pergams O R,Ashley M V.Microevolution in island rodents.Genetica,2001,112-113:245-256.
参考文献:
[4] 杨月伟,刘季科,刘震.种群外部及内部因子对东方田鼠巢区大小的效应.动物学报,2005,51(2):205-214.
[5] 徐基良,张晓辉,张正旺,郑光美,阮祥锋,张可银.白冠长尾雉雄鸟的冬季活动区与栖息地利用研究.生物多样性,2005,13(5):416-423.
[6] 黄中豪,周岐海,黄乘明,蒙渊君,韦华.广西弄岗黑叶猴的家域和日漫游距离.兽类学报,2011,31(1):46-54.
[7] 孔令雪,张虹,任娟,钟雪,孙玉波,宋鹏飞,郭聪.繁殖期不同时段赤腹松鼠巢域的变化.兽类学报,2011,31(3):251-256.
[8] 蔡路昀,徐言朋,蒋萍萍,丁平,姚小华,徐向荣,王国兵.白颈长尾雉的活动区和日活动距离.浙江大学学报:理学版,2007,34(6):679-683.
[9] 周延林,王利民,鲍伟东,侯希贤.小毛足鼠(Phodopus roborovski)巢区和活动距离的初步研究.内蒙古大学学报:自然科学版,1998,29(2):258-263.
[10] 吴德林,邓向福,王光焕,甘正平.中华姬鼠巢区的研究.兽类学报,1987,7(2):140-146.
[11] 董维惠,侯希贤,杨玉平.黑线仓鼠巢区的研究.兽类学报,1989,9(2):103-109.
[12] 鲍毅新,诸葛阳.黑腹绒鼠生态学的研究.兽类学报,1986,6(4):297-305.
[14] 王淯,胡锦矗,谌利民.唐家河自然保护区社鼠种群空间格局研究.四川动物,1994,13(2):67-68.
[18] 沈良良,鲍毅新,张旭,魏德重,刘军.千岛湖社鼠巢区面积的季节与性别差异.浙江师范大学学报:自然科学版,2011,34(3):328-332.
[19] 宛新荣,钟文勤.一种简易的啮齿动物切趾编码方法.动物学杂志,2000,35(4):22-24.
[20] 鲍毅新,诸葛阳.社鼠的年龄鉴定和种群年龄组成.兽类学报,1984,4(2):127-137.
[21] 张洁.社鼠种群生态研究.兽类学报,1993,13(3):198-204.
[22] 张同作,崔庆虎,连新明,苏建平.退耕还林还草地鼠害治理——大林姬鼠种群年龄结构的研究.草业科学,2006,23(2):67-70.
[23] 潘世昌,杨再学,杨秀群,归贤祥,李梅.小家鼠胴体重指标划分种群年龄的研究.贵州农业科学,2006,34(S1):18-20.
[24] 孙波,鲍毅新,张龙龙,赵庆洋.千岛湖秋季社鼠种群年龄结构及繁殖状况初探.兽类学报,2009,29(3):269-276.
[35] 张旭,鲍毅新,刘军,林杰君,沈良良,王艳妮.陆桥岛屿环境下社鼠种群数量的估算方法.生态学报,2012,32(5):1562-1569.
